重症脓毒血症和脓毒性休克解析
- 格式:ppt
- 大小:248.00 KB
- 文档页数:24



脓毒症和脓毒性休克定义国际共识解读(完整版)脓毒症(sepsis)是由感染诱发的机体生理、病理、生化异常的综合征。
由于一些众所周知的原因,近年脓毒症发病率有所上升,仍是全球范围内导致死亡及残疾的主要原因之一。
1991年脓毒症共识会议首次定义脓毒症为由感染引起的机体全身炎症反应综合征(SIRS),而有器官功能障碍者定义为重症脓毒症,脓毒性休克则定义为"充分液体复苏后持续存在的脓毒症诱导的低血压"[1]。
2001年第二次共识会议虽然认识到这些定义的局限[2],并且列出了扩展的诊断标准,但由于缺少循证医学证据,并未提出新的定义,事实上,脓毒症及脓毒性休克定义20多年来并无显著改变。
大家认为目前脓毒症定义不能代表当前对脓毒症的新认识,有必要重新审视现有相关定义及诊断标准,并且制定新的更符合脓毒症病理生理及临床的定义,为规范统一脓毒症诊断、流行病学及临床治疗、研究打下基础[3,4,5]。
为此,欧洲危重病学会2014年1月起发起了19个相关组织的特别专家组。
这个小组从2014年1月到2015年1月召开4次面对面的会议,并通过邮件联系及投票方式讨论并对相关问题作出决议,基于对脓毒症病理学的进一步加深认识及临床大数据分析,提出了脓毒症及脓毒性休克新的定义及诊断标准,结果发表于2016年2月美国医学会杂志(JAMA)上[6]。
限于篇幅,本文省略了有关制定新定义的方法学及过程,而主要介绍新定义及临床诊断标准。
1 共识提出的问题1.1 目的如何区别脓毒症和无并发症的感染是本次共识的主要目的,而与病理学进展一致的定义更新是共识的另一项任务。
专家组认为重要的是寻找可靠的指标,而且这些指标最好涵盖所有脓毒症因素(感染、宿主反应及器官障碍),易于获得,价格合理,最终应该能够前瞻性测定这些标准的有效性。
此外,这些标准应适用于医院外、急诊及医院内患者。
另外,共识试图寻求脓毒症生物学、临床诊断及流行病学的一致性。


JAMA:脓毒症和脓毒性休克最新诊断标准脓毒症/ 全身性感染(Sepsis)是感染导致的生理性、病理性和生物化学性异常综合征。
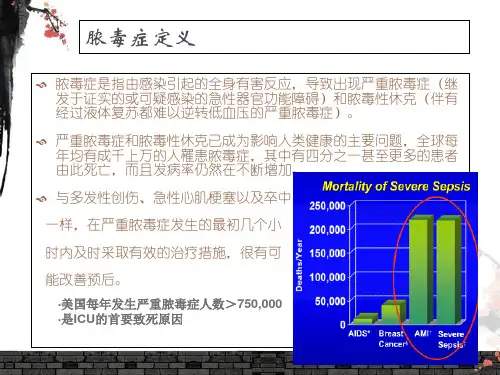
2011 年占全美住院费用的5.2 %(200 亿美元)。
目前,脓毒症的发病率仍在升高,成为世界范围内死亡和病危的主要原因。
患者即使存活下来,也会存在长期的生理、心理及认知障碍,对医疗卫生和社会有重要影响。
近期,脓毒症定义工作小组的研究成果在JAMA 上发表,大幅更新了脓毒症和脓毒性休克/ 感染性休克(Septic shock)的定义和临床标准。
1991 年会议共识提出最初的脓毒症定义:脓毒症是宿主对感染的全身炎症反应综合征;脓毒性休克定义为:经充足补液后,仍持续存在脓毒血症性低血压。
脓毒症不是一种特定的疾病,而是一组综合征,目前没有明确的临床诊断标准。
对脓毒症患者进行早诊断、早干预可改善预后,故可准确量化的诊断标准尤为重要,可为临床医生判断可疑感染发展至危及生命的状态提供更好的依据。
脓毒症的定义脓毒症定义为针对感染的宿主反应失调导致危及生命的器官功能障碍。
这一新定义强调了感染引发的宿主非稳态反应的重要性,超出感染本身的可能致死性,以及及时诊断的必要性。
正如后面所提到的,当怀疑存在感染时即使中等程度的器官功能障碍也伴随10 % 以上的住院病死率。
因此,及时诊断以采取迅速而适当的干预措施尤为重要。
全身炎症反应综合征(SIRS)非特异性诊断标准(如发热或白细胞增多)仍有助于一般感染的诊断。
可与感染的某些特异性表现(如皮疹、肺实变、尿痛、腹膜炎)共同提示最可能的感染部位及病原。
脓毒症可引起器官功能障碍,提示其病理生理机制远较感染及其伴随的炎症反应更为复杂。
所谓「重症脓毒症」就显得多余了。
脓毒症的诊断标准器官功能障碍指感染引起的SOFA 评分(见表)在基线水平上升高≥ 2 分。
对于无基础器官功能障碍的患者,SOFA 的基线为0 分。
对于可疑感染的住院患者而言,SOFA 评分≥ 2 分提示总死亡风险约为10%。




脓毒血症名词解释
脓毒血症名词解释:脓毒血症是指由感染引起的全身炎症反应综合征,可以发展为严重脓毒血症和脓毒性休克,严重脓毒血症和脓毒性休克是重症医学面临的重要临床问题。
随着人口老龄化、肿瘤发病率上升,以及侵入性医疗手段的增加,脓毒血症的发病率不断上升。
脓毒血症早期的临床表现一般包括发热、心率加快、呼吸困难、精神状态的改变、水肿、高血糖等等,随着病情加重,可以出现低氧血症、低血压、器官功能衰竭,甚至休克、死亡,治疗比较棘手,死亡率较高。
专家提示:脓毒血症是指由感染引起的全身炎症反应综合征,感染人体之后,人可以出现明显发热、呼吸急促、白细胞计数明显增高等情况。
可以发展为严重脓毒血症和脓毒性休克,发病率不断提高。

脓毒症与脓毒性休克脓毒症综合征是一个具有不同预后的临床连续体。
脓毒性休克是脓毒症最严重的并发症,死亡率高。
作为对一种激发剂的反应,免疫系统的促炎和抗炎与单核细胞、巨噬细胞和中性粒细胞的激活相一致,这些细胞通过病原体识别受体与内皮细胞相互作用,从而产生细胞因子、蛋白酶、激肽、活性氧和一氧化氮作为这种反应的主要部位,内皮细胞不仅受到微血管损伤,而且激活凝血和补体级联,进一步加重血管损伤,导致毛细血管渗漏。
这一系列事件导致了脓毒症的临床症状和体征,以及从脓毒症到脓毒症性休克的进展。
平衡促炎反应以消除入侵微生物的能力与控制整个炎症级联的抗炎信号的能力最终决定了患者的发病率和/或死亡率。
明智和早期使用抗菌药物、脓毒症集束化诊疗以及早期目标导向治疗对脓毒症相关死亡率有显著和积极的影响。
然而,早期识别仍是脓毒症治疗和管理的最佳治疗手段。
病因学2009年欧洲重症监护感染率(EPIC II研究)确定,革兰氏阴性细菌感染是脓毒症综合征最常见的病因,其发病率远远超过其他病因,其次是革兰氏阳性感染,占47%。
后者的患病率增加可能归因于更具侵入性的操作的执行以及医院感染的发生率增加。
患者中分离出的主要微生物包括金黄色葡萄球菌(20%),假单胞菌(20%)和大肠杆菌(16%)。
感染的主要部位包括呼吸道(42%),血液(21%)和泌尿生殖道(10%)。
在了解超过三分之一的患者从未培养阳性培养物的情况下,需要评估这些数据。
大型荟萃分析说明了细菌菌株和感染部位对死亡率的影响,在这项研究中,革兰氏阴性感染总体上与更高的死亡率有关。
然而,不动杆菌革兰氏阳性菌血症或葡萄球菌引起的肺炎的死亡率为40%,假单胞菌肺炎的死亡率最高,为70%。
由耐多药细菌菌株(耐甲氧西林的葡萄球菌(MRSA),耐万古霉素的肠球菌(VRE)引起的脓毒症综合征正在上升,目前的发病率高达25%;病毒和寄生虫引起的病例要少得多,在2%至4%的病例中被发现。
流行病学每年,脓毒症发病率几乎增加了9%。
脓毒症休克中西医详解脓毒症休克是一种严重的感染性疾病,常常导致器官功能衰竭。
中西医学都对脓毒症休克进行了深入的研究,以寻找最佳的治疗方法。
本文将详细介绍脓毒症休克的中西医学观点,包括病因、临床表现、诊断和治疗等方面。
首先,让我们来了解一下中医对脓毒症休克的认识。
中医认为,脓毒症休克是由外邪入侵引起的一种寒邪疾病,其病因主要是受寒、湿气侵袭,导致体内寒湿凝滞,从而影响气血运行。
中医将脓毒症休克分为三个阶段,即初期、中期和晚期。
初期症状包括寒战、发热、头疼等;中期症状包括发热不退、体温升高、烦躁不安;晚期则出现心悸、面色苍白、血压下降等严重情况。
中医治疗脓毒症休克主要依靠辨证施治,通过调整体内阴阳平衡,促进气血运行,以达到疏散外邪,恢复机体功能的目的。
接下来,我们来看看西医对脓毒症休克的认识。
西医将脓毒症休克定义为感染引起的全身炎症反应综合征(SIRS),其病因主要是感染导致细菌内毒素的释放,触发机体的炎症反应。
脓毒症休克的临床表现包括发热、心动过速、低血压、呼吸困难等。
西医将脓毒症休克的诊断标准分为两类,即SIRS标准和脓毒症休克标准。
治疗方面,西医主要采用抗生素、补液、升压药物等药物治疗,以及机械通气和血液净化等支持疗法。
中医和西医对脓毒症休克的认识虽然有所差异,但在治疗上存在一些共同之处。
比如,在对症治疗中,两者都强调了液体复苏的重要性。
中医认为,饮食中的适量温热汤羹能够帮助排解寒湿,促进气血运行,有利于疾病的恢复。
西医则推崇积极的补液治疗,以维持循环血量,保持组织器官的灌注。
此外,中西医在预防脓毒症休克方面也存在一些相似的观点。
两者都认为,注意个人卫生、避免受寒受湿,加强锻炼、增加体质是预防脓毒症休克的基本方法。
此外,中医还强调调理心态、保持情绪稳定,提高机体的抵抗力。
综上所述,无论是中医还是西医,对于脓毒症休克都进行了深入的研究,都在尝试找到最佳的治疗方法。
中西医的观点在某些方面存在一定的差异,但也有相似之处。