第二节 分子的立体构型知识点
- 格式:doc
- 大小:295.50 KB
- 文档页数:4

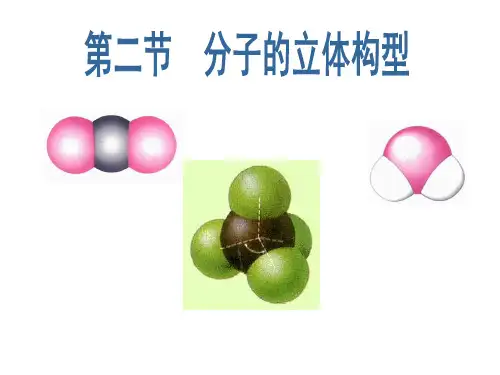




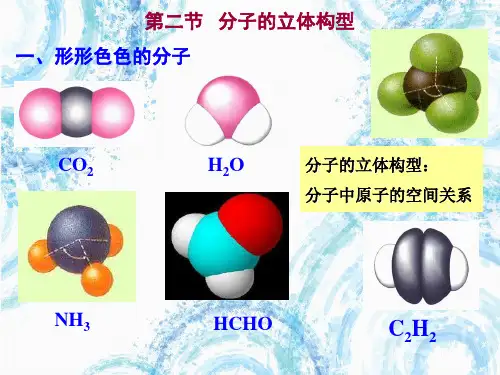



第二节分子的立体构型知识点一形形色色的分子1. 分子的立体构型(1)概念:指多原子构成的共价分子中的原子的空间关系问题。
由于多原子构成的分子中一定存在共价键,共价键的方向性使得分子中的原子按一定的空间结构排列,形成了分子的构型。
如3原子分子的构型有直线型(CO2)和V(H2O)型两种。
(2)作用:分子构型对物质的活泼性、极性、状态、颜色和生物活性等性质都起决定性作用。
特别提醒:双原子均为直线型,不存在立体构型。
2.形形色色的分子不同分子,构型不同。
常见分子立体构型如下表:知识点二价层电子对互斥模型1.价层电子对互斥理论(VSEPR模型)(1)内容:分子中的价层电子对(包括σ键电子对和中心原子上的孤对电子)由于相互排斥作用,尽可能而趋向于彼此远离以减小斥力,分子尽可能采用对称的空间构型。
电子对之间夹角越大,排斥力越小。
(2)VSEPR模型特征:用有区别的标记表示分子中的孤对电子和成对电子,如H2O、NH3的VSEPR模型特征为:2.利用价层电子对互斥理论判断分子的空间构型(1)VSEPR模型把分子分成以下两大类①中心原子上的价电子都用于成键。
在这类分子中,由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离,成键原子的几何构型总是采取电子对排斥最小的那种结构。
它们的立体结构可用中心原子周围的原子数来预测。
如:②中心原子上有孤对电子的分子或离子。
对于这类分子,首先建立四面体模型,每个键占据一个方向(多重键只占据一个方向),孤对电子也要占据中心原子周围的空间,并参与互相排斥。
(2)价层电子对数的计算①σ键电子对数的计算σ键电子对数可由分子式确定,中心原子有几个σ键,就有几对σ键电子对。
如H2O分子中σ键电子对数为,NH3分子中σ键电子对数为。
②孤电子对数的计算中心原子上的孤电子对数=1/2(a-xb)a为中心原子的价电子数;x为与中心原子结合的原子数;b为与中心原子结合的原子最多能接受的电子数。
促敦市安顿阳光实验学校第二章分子结构与性质第二节分子的立体构型第1课时分子的立体构型(1)知识归纳一、形形色色的分子单原子分子(稀有气体)、双原子分子不存在立体构型,多原子分子中,由于空间的位置关系,会有不同类型的立体异构。
1.子分子——直线形和V形化学式立体构型结构式键角比例模型球棍模型CO2直线形______H 2O V形105°2.四原子分子——平面三角形和三角锥形化学式立体构型结构式键角比例模型球棍模型CH2O 平面三角形120°NH3三角锥形107°3.子分子化学式立体构型结构式键角比例模型球棍模型CH4________ 109°28'4.其他多原子分子的立体构型多原子分子的立体构型形形色色,异彩纷呈。
如白磷(P4,正四面体)、PCl5(三角双锥)、SF6(正八面体)、P4O6、P4O10、C60(“足球”状分子,由平面正五边形和正六边形组成)、C6H12(环己烷)、C10H16(烷)、S8、B12(硼单质)的立体构型如图所示。
P4(正四面体) PCl5(三角双锥)SF6(正八面体)P4O6P4O10 C60椅式C6H12船式C6H12C10H16S8B12二、价层电子对互斥理论1.价层电子对互斥理论的含义价层电子对互斥理论认为,分子的立体构型是价层电子对_____________的结果,价层电子对是指分子中的中心原子上的电子对,包括______________和中心原子上的_____________(未形成共价键的电子对)。
分子中的价层电子对由于_________作用而趋向于尽可能远离以减小排斥力,分子尽可能采取对称的立体构型。
电子对之间的夹角越大,排斥力_______。
2.价层电子对互斥模型电子对数成键电子对数孤电子对数价层电子对立体构型分子的立体构型典例2 2 0 直线形直线形BeCl23 3 0三角形三角形BF3 2 1 V形SnBr24 4 0四面体___________ CH4 3 1 三角锥形NH3 2 2 V形H2O3.价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。
第二节 分子的立体构型第1课时一、形形色色的分子大多数分子是由两个以上原子构成的,于是就有了分子中的原子的空间关系问题,这就是所谓“分子的立体结构”。
例如,三原子分子的立体结构有直线形和V 形两种。
如C02分子呈直线形,而H 20分子呈V 形,两个H —O 键的键角为105°。
三原子分子立体结构:有直线形C02 、CS 2等,V 形如H 2O 、S02等。
大多数四原子分子采取平面三角形和三角锥形两种立体结构。
例如,甲醛(CH 20)分子呈平面三角形,键角约120°;氨分子呈三角锥形,键角107°。
四原子分子立体结构:平面三角形:如甲醛(CH 20)分子等,三角锥形:如氨分子等。
五原子分子的可能立体结构更多,最常见的是正四面体形,如甲烷分子的立体结构是正四面体形,键角为109°28。
五原子分子立体结构:正四面体形如甲烷、P 4等。
[讲] 此形形色色的分子世界分子的空间结构我们看不见,那么科学家是怎样测定的呢?科学视野—分子的立体结构是怎样测定的?肉眼不能看到分子,那么,科学家是怎样知道分子的形状的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
分子中原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,结合这些信息,可分析出分子的立体结构。
第二节分子的立体构型第二节分子的立体构型第1课时分子空间结构与价层电子对互斥理论在宏观世界中,花朵、蝴蝶、冰晶等诸多物质展现出规则与和谐的美。
科学巨匠爱因斯坦曾感叹:“在宇宙的秩序与和谐面前,人类不能不在内心里发出由衷的赞叹,激起无限的好奇。
”实际上,宏观的秩序与和谐源于微观的规则与对称。
通常,不同的分子具有不同的空间构型。
例如,甲烷分子是正四面体形的、氨分子是三角锥形的、苯是正六边形的。
那么,这些分子为什么具有不同的空间构型呢?一、形形色色的分子1.三原子分子的立体构型有__直线____形和__V____形两种。
如__平面三角______三角锥______正四面体____1.价层电子对互斥理论(VSEPR)。
对AB n型的分子或离子,中心原子A的价层电子对(包括成键__σ键电子对____和未成键的__孤电子对____)之间由于存在排斥力,将使分子的几何构型总是采取电子对__相互排斥____最小的那种构型,以使彼此之间__斥力____最小,分子或离子的体系能量__最低____,__最稳定____。
2.价层电子对的空间构型(即VSEPR模型):电子对数目:2 3 4VSEPR模型:__直线形______平面三角形______正四面体形____三、VSEPR模型应用——预测分子立体构型:1.中心原子不含孤电子对的分子。
中心原子不含孤电子对的分子,VSEPR模型与分子的立体构型一致。
__直线形______直线形______平面三角形______平面三角形______正四面体形______正四面体形____中心原子若有孤电子对,孤电子对也要占据中心原子的空间,并与成键电子对互相排斥。
则VSEPR模型与分子的立体构型不一致。
推测分子的立体模型必须略去VSEPR模型中的孤电子对。
__正四面体形______三角锥形______V形______平面三角形______V 形____(1)价电子对之间的夹角越小,排斥力越小。
请浏览后下载,资料供参考,期待您的好评与关注!选修三第二章第2节 分子的立体构型第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等;有三角锥形,如NH 3、PH 3等;也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤:(1)确定中心原子A 价层电子对数目法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数) 对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下:n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断) N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP ) VP 是价层电子对,BP 是成键电子对(BOND ),LP 是孤对电子对(LONE PAIR )VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LP请浏览后下载,资料供参考,期待您的好评与关注!Lp = 21(中心原子价电子数—配位原子未成对电子数之和) IF 5 Lp =21[7-(5×1)] = 1构型由八面体−→−四方锥 NH +4 Lp =21[(5-1)-(4×1)] = 0 正四面体 PO -34 Lp =21[(5+3)-(4×2)] = 0 正四面体 SO -24 Lp =21[(6+2)-(4×2)] = 0 正四面体 NO 2 Lp =21[5-(2×2)] = 21−→− 1 构型由三角形−→−V 形 SO -23 Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis 结构式或结构式直接写出,双键、三键都是1对电子PCl Cl Cl Cl ClP Cl Cl Cl P Cl Cl Cl Cl +Cl P Cl Cl Cl Cl Cl -Cl Cl Cl Cl +Cl P Cl Cl Cl Cl Cl -VP: 5 4 4 6 4(2)确定价层电子对的空间构型价层电子对数目 2 3 4 5 6价层电子对构型 直线形 三角形 四面体 三角双锥 八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
化学选修三第二章第二节分子的立体构型2选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数)对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP是价层电子对,BP是成键电子对(BOND ),LP是孤对电子对(LONE PAIR)VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和)IF5Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥NH+4Lp =21[(5-1)-(4×1)] = 0 正四面体PO-34Lp =21[(5+3)-(4×2)] = 0 正四面体SO-24Lp =21[(6+2)-(4×2)] = 0 正四面体NO2Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V形SO-23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis结构式或结构式直接写出,双键、三键都是1对电子PClClClClCl PCl Cl ClPClClClCl+ClPClClClClCl-ClClClCl+ClPClClClClCl-VP: 5 4 4 6 4(2)价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
第二节分子的立体构型
知识点一形形色色的分子
1. 分子的立体构型
(1)概念:指多原子构成的共价分子中的原子的空间关系问题。
由于多原子构成的分子中一定存在共价键,共价键的方向性使得分子中的原子按一定的空间结构排列,形成了分子的构型。
如3原子分子的构型有直线型(CO2)和V(H2O)型两种。
(2)作用:分子构型对物质的活泼性、极性、状态、颜色和生物活性等性质都起决定性作用。
特别提醒:双原子均为直线型,不存在立体构型。
2.形形色色的分子
不同分子,构型不同。
常见分子立体构型如下表:
知识点二价层电子对互斥模型
1.价层电子对互斥理论(VSEPR模型)
(1)内容:分子中的价层电子对(包括σ键电子对和中心原子上的孤对电子)由于相互排斥作用,尽可能而趋向于彼此远离以减小斥力,分子尽可能采用对称的空间构型。
电子对之间夹角越大,排斥力越小。
(2)VSEPR模型特征:用有区别的标记表示分子中的孤对电子和成对电子,如H2O、NH3的VSEPR 模型特征为:
2.利用价层电子对互斥理论判断分子的空间构型
(1)VSEPR模型把分子分成以下两大类
①中心原子上的价电子都用于成键。
在这类分子中,由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离,成键原子的几何构型总是采取电子对排斥最小的那种结构。
它们的立体结构可用中心原子周围的原子数来预测。
如:
②中心原子上有孤对电子的分子或离子。
对于这类分子,首先建立四面体模型,每个键占据一个方向(多重键只占据一个方向),孤对电子也要占据中心原子周围的空间,并参与互相排斥。
(2)价层电子对数的计算
①σ键电子对数的计算
σ键电子对数可由分子式确定,中心原子有几个σ键,就有几对σ键电子对。
如H2O分子中σ键电子对数为,NH3分子中σ键电子对数为。
②孤电子对数的计算
中心原子上的孤电子对数=1/2(a-xb)
a为中心原子的价电子数;
x为与中心原子结合的原子数;
b为与中心原子结合的原子最多能接受的电子数。
如:如何确定CO2-3和NH+4的中心原子的孤电子对数?
阳离子:a为中心原子的价电子数减去离子的电荷数(绝对值),故NH+4中中心原子为N,a=5-1,b=1,x=4,所以中心原子孤电子对数=1/2(a-xb)=1/2(4-4×1)=0。
阴离子:a为中心原子的价电子数加上离子的电荷数(绝对值),故CO2-3中中心原子为C:a=4+2,b=2,x=3,所以中心原子孤电子对数=1/2(a-xb)=1/2(6-3×2)=0。
③中心原子的价层电子对数=σ键电子对数+1/2(a-xb)。
例1:下列分子中心原子的价层电子对数是3的是()
A.H2O B.BF3C.CH4D.NH3
【解析】H2O中O的价层电子对数=2+1/2(6-2×1)=4
BF3中B的价层电子对数=3+1/2(3-3×1)=3
CH4中C的价层电子对数=4+1/2(4-4×1)=4
NH3中N的价层电子对数=3+1/2(5-3×1)=4。
(3)分子立体构型的确定
依据价层电子对互斥模型,判断出分子中中心原子的孤电子对数,再利用中心原子的成键电子对数,两者结合,就可以确定分子较稳定的立体构型。
举例说明如下表:
知识点三杂化轨道理论
1.杂化与杂化轨道的概念
(1)轨道的杂化:在形成多原子的分子时,原子内部能量相近的原子轨道重新组合生成与原轨道数相等的一组轨道的过程。
(2)杂化轨道:杂化后形成的新的能量相近的一组原子轨道。
特别提醒:①杂化前后轨道数目不变。
②杂化轨道只能用于形成σ键或用来容纳未参与成键的孤对电子。
(3)杂化类型:sp3、sp2、sp杂化。
2.杂化过程:以CH4为例说明sp3杂化过程,当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。
当碳原子跟4个氢原子结合时,碳原子以4个sp3杂化轨道分别与4个氢原子的ls轨道重叠,形成4个C—H σ键,因此呈正四面体的分子构型。
sp3杂化:1个s轨道和3个p轨道会发生混杂,得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道。
空间结构:正四面体或V型、三角锥型。
sp 2的(BF 3)杂化过程:
sp 2
杂化:同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp 2 杂化轨道。
sp 2
杂
化轨道间的夹角是120°。
分子的几何构型为平面正三角形。
sp
杂化:同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的
sp 杂化轨道。
sp 杂化:夹角为180°的直线形杂化轨道。
注:1.杂化类型的判断
因为杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系: 杂化轨道数=中心原子孤电子对数+中心原子结合的原子数,再由杂化轨道数判断杂化类型。
例如:
代表物
杂化轨道数 杂化轨道类型
CO 2 0+2=2 sp CH 2O 0+3=3 sp 2
CH 4 0+4=4 sp 3
SO 2 1+2=3 sp 2
NH 3
1+3=4
sp 3
H 2O
2+2=4
sp 3
2s
2p
B 的基态
2p
2s
激发态
正三角形
sp 杂化态
BF 3分子形成
B
F
F F
激发
120°。