化学选修三第二章第二节分子的立体构型
- 格式:doc
- 大小:677.50 KB
- 文档页数:13




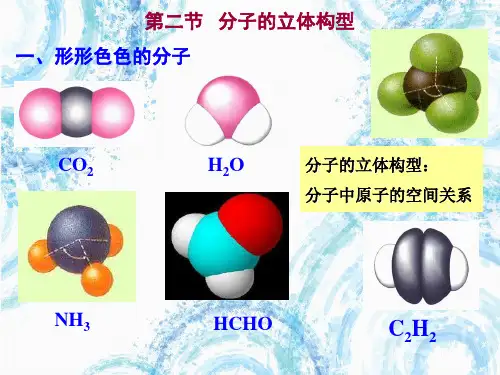




化学选修三第二章第二节分子的立体构型选修三第二章第2节分子的立体构型第2节分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl、NO、O 2、N2等。
2.三原子分子有直线形,如CO2、CS2等;还有“V”形,如H2O、H2S、SO2等。
3.四原子分子有平面三角形,如BF3、BCl3、CH2O等;有三角锥形,如NH3、PH3等;也有正四面体,如P4。
4.五原子分子有正四面体,如CH4、CCl4等,也有不规则四面体,如CH3Cl、CH2Cl2、CHCl3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory)简称VSEPR适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤:(1)确定中心原子A价层电子对数目法1.经验总结中心原子的价层电子对数=1(中心离子价电子数+配2对原子提供电子总数)对于AB m型分子(A为中心原子,B为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4价层电子对数为21[5+(4×1)-1] = 4对 正四面体PO -34价层电子对数为21[5+(0×4)+3] = 4对 正四面体NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP 是价层电子对,BP 是成键电子对(BOND ),LP 是孤对电子对(LONE PAIR )VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LP Lp =21(中心原子价电子数—配位原子未成对电子数之和)IF 5 Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥 NH +4Lp =21[(5-1)-(4×1)] = 0 正四面体PO -34Lp =21[(5+3)-(4×2)] = 0 正四面体SO -24Lp =21[(6+2)-(4×2)] = 0 正四面体NO 2 Lp =21[5-(2×2)] = 21−→− 1 构型由三角形−→−V 形 SO -23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis 结构式或结构式直接写出,双键、三键都是1对电子P ClClCl ClCl P Cl Cl ClP ClClCl Cl+Cl P Cl ClClCl Cl -Cl Cl ClCl +Cl P Cl Cl Cl Cl Cl -VP: 5 4 4 6 4(2)确定价层电子对的空间构型价层电子对数目2 3 4 5 6价层电子对构型直线形三角形四面体三角双锥八面体(3)分子空间构型确定价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
化学选修三第二章第二节分子的立体构型2选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数)对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP是价层电子对,BP是成键电子对(BOND ),LP是孤对电子对(LONE PAIR)VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和)IF5Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥NH+4Lp =21[(5-1)-(4×1)] = 0 正四面体PO-34Lp =21[(5+3)-(4×2)] = 0 正四面体SO-24Lp =21[(6+2)-(4×2)] = 0 正四面体NO2Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V形SO-23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis结构式或结构式直接写出,双键、三键都是1对电子PClClClClCl PCl Cl ClPClClClCl+ClPClClClClCl-ClClClCl+ClPClClClClCl-VP: 5 4 4 6 4(2)价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
精品教育-可编辑-选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数) 对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下:n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断) N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP ) VP 是价层电子对,BP 是成键电子对(BOND ),LP 是孤对电子对(LONE PAIR ) VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP精品教育-可编辑-=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和) IF 5 Lp =21[7-(5×1)] = 1构型由八面体−→−四方锥NH +4Lp =21[(5-1)-(4×1)] = 0 正四面体 PO -34Lp =21[(5+3)-(4×2)] = 0 正四面体 SO -24Lp =21[(6+2)-(4×2)] = 0 正四面体 NO 2 Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V 形 SO -23 Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis 结构式或结构式直接写出,双键、三键都是1对电子P ClClCl ClClP Cl Cl ClP ClClCl Cl +Cl P Cl ClClClCl-Cl Cl ClCl +Cl P Cl Cl Cl Cl Cl -VP: 5 4 4 6 4(2)价层电子对数目 2 3 4 5 6 价层电子对构型 直线形 三角形 四面体 三角双锥 八面体精品教育-可编辑-(3)分子空间构型确定价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
当中心原子无孤对电子时,两者的构型一致; 电子对数 目 中心原子杂化类型 电子对的空间构型 成键电子对数 孤电子 对 数 电子对的 排列方式 分子的空间构型实 例2 sp 直 线 2 0 直 线 BeCl 2CO 23sp 2三角形3三角形 BF 3SO 3 2 1V —形 SnBr 2 PbCl 2 4sp3四面体4四面体CH 4 CCl 4 3 1三角锥NH 3 PCl 3 2 2V —形H 2O①AD m 型分子的空间构型总是采取A 的价层电子对相互斥力最小的那种几何构型; ②分子构型与价层电子对数有关(包括成键电子对和孤电子对); ③分子中若有重键(双、叁键)均视为一个电子对; ④电子对的斥力顺序:孤电子对-孤电子对>孤电子对-键对>键对-键对由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键。
叁键与叁键>叁数与双键>双键与双键>双键与单键>单与单键。
4、价层电子对斥力作用对键角影响的定性解释由于键合电子对受到左右两端带正电原子核的吸引,而孤对电子对只受到一端原子核吸引,相比之下,孤对电子对较“胖”,占据较大的空间,而键合电子对较“瘦”,占据较小的空间。
这样就解释了斥力大小的顺序:孤电子对-孤电子对>孤电子对-键电子对>键电子对-键电子对。
如:CH 4、NH 3、H 2O 中的键角∠HAH 分别为109.5°、107.3°、104.5°。
类似地,重键较单键占据较大的空间,故有斥力大小的顺序:t-t>t-d>d-d>d-s>s-s(t-叁键,d-双键,s-单键)又如,SO 2Cl 2分子属AX 4L 0=AY 4,因S=O 键是双键,S-Cl 键是单键,据顺序有:∠OSO>109°28''''∠ClSCl<∠OSCl<109°28''''。
此外,键的极性对键角也有影响。
中心原子电负性较大,成键电子对将偏向中心原子,成键电子对之间斥力增大,键角增大,如:NH 3、PH 3、AsH 3分子中的键角(∠HAH)依次为107°、93.08°、91.8°;配位原子电负性较大,成键电子对将偏离中心原子,成键电子对之间斥力减小,键角减小,如:H 2O 、OF 2分精品教育-可编辑-子中的键角(AOA)依次为104.5°、102°。
据此,可解释下列键角变化:NO 2+、NO 2、NO 2-键角(∠ONO)依次为180°、134.3°、115.4°。
二、价层电子对互斥理论1940年 Sidgwick 提出价层电子对互斥理论, 用以判断分子的几何构型. 分子 ABn 中, A 为中心, B 为配体, B 均与A 有键联关系. 本节讨论的 AB n 型分子中, A 为主族元素的原子. 1. 理论要点AB n 型分子的几何构型取决于中心 A 的价层中电子对的排斥作用. 分子的构型总是采取电子对排斥力平衡的形式.1) 中心价层电子对总数和对数a)中心原子价层电子 总数等于中心 A 的价电子数(s + p)加上配体在成键过程中提供的电子数, 如 CCl 4 4 + 1×4 = 8 b)氧族元素的氧族做中心时: 价电子数为 6, 如 H 2O, H 2S;做配体时:提供电子数为 0, 如在 CO 2中. c)处理离子体系时, 要加减离子价d)总数除以 2 ,得电子对数: 总数为奇数时,对数进 1,例如:总数为 9,对数为 52) 电子对和电子对空间构型的关系 电子对相互排斥,在空间达到平衡取向.3) 分子的几何构型与电子对构型的关系若配体数和电子对数相一致,各电子对均为成键电对,考虑分子构型时,只考虑原子 A ,B 的位置,不考虑电子、对电子等。
以上三种情况中,孤对电子只有一种位置考虑。
孤对电子的位置若有两种或两种以上的位置可供考虑,则要选择斥力易于平衡位置,而斥力大小和两种因素有关: a)角度小,电对距离近,斥力大;b)角度相同时,孤对——孤对的斥力最大。
因为负电集中,孤对-成键斥力次之,而成键电对-成键电对之间斥力最小,因有配体原子核去分散电对的负电性。
于是,要避免的是斥力大的情况在 90°的方向上。
90 °的分布 :孤对-孤对 0 0 1 孤对-成键 6 4 3 成键-成键 0 2 2 乙种稳定,称 “T”字型精品教育-可编辑-则分子构型和电子对构型一致。
配体数不可能大于电子对数. 当配体数少于电子对数时,一部分电子对成为成键电对,另一部分电子成为孤对电子,确定出孤对电子的位置,分子构型才能确定。
电子对数 配体数 孤电对数 电对构型 分子构型例1. 利用价层电子对互斥理论判断下列分子和离子的几何构型(总数、对数、电子对构型和分子构型): AlCl 3 H 2S SO 32- NH 4+ NO 2 IF 3解题思路:根据价层电子对互斥理论, 计算单电子个数, 价层电子对数, 孤对电子对数, 进而判断分子的构型(注意:必须考虑离子的价态!)电子对构型是十分重要的结构因素,要注意!价层电子对数和配体数是否相等也是十分重要的。
2. 影响键角的因素 1) 孤对电子的影响孤对电子的负电集中,可以排斥其余成键电对,使键角变小,NH 3 4对 电对构型四面体,分子构型三角锥。
键角 HNH 为107°,这是由于孤对电子对 N -H 成键电 对的排斥,使109°28′变小, 成为107°。
2) 中心电负性的影响键角依次减小,如何解释?3. 多重键的处理某配体(非VIA 族)与中心之间有双键和三键时,价层电子对数减 1 或 2 。
如乙烯 H 2C=CH 2 以左碳为中心电子总数 4 + x + 2 = 8 , 4对, 减 1,3 对,为三配体,呈平面三角形:不提供共用电子, 是因为O, S 等可通过键, 反馈键或大键, 将提供的电子又重新得回; 另外, 端基氧或硫, 形成的双键, 要求减去一对价电子, 也得到同样结果.非端基氧或硫, 要将O或S的价电子计入其中, 如在H2CO3中, C为中心, 价电子为4(C) + 2X1(O) = 6, 价电对= 3, 电子对构型和分子构型一致, 为三面体:3) 配体电负性的影响中心相同,配体电负性大时,电对距离中心远,键角可以小些,故有:-可编辑-精品教育【练习】1.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )A.直线形;三角锥形B.V形;三角锥形C.直线形;平面三角形D.V形;平面三角形2.下列分子中的中心原子杂化轨道的类型相同的是( )A.CO2与SO2B.CH4与NH3 C.BeCl2与BF3D.C2H4与C2H23.(1)某校化学课外活动小组的同学对AB3型分子或离子的空间构型提出了两种看法,你认为是哪两种?若两个A—B键均是极性键且极性相同,它们分子的极性是怎样的?举例说明。