含硫化合物
- 格式:doc
- 大小:15.00 KB
- 文档页数:2

含硫化合物知识点总结初中一、硫的性质1. 硫的性质硫是一种非金属元素,化学性质活泼,常见的形态包括硫磺、硫化物等。
硫在自然界中广泛存在,在地壳中的含量较多。
硫的化合价常见有-2、0和+6等。
2. 硫的化合物硫化合物指的是硫和其他元素形成的化合物,常见的包括硫化氢、二氧化硫、硫酸盐等。
它们具有独特的化学性质,在工业生产和人类生活中具有广泛的应用。
二、硫化合物的性质1. 硫化氢硫化氢是一种具有刺激性气味的无色气体,易燃易爆。
它可以与氧气发生燃烧反应,生成二氧化硫和水。
硫化氢在皮肤和呼吸道接触时具有毒性,可引起中毒。
2. 二氧化硫二氧化硫是一种具有刺激性气味的无色气体,易溶于水。
它是一种重要的工业原料,用于制取硫酸和其他化工产品。
此外,二氧化硫也是大气污染的重要来源之一,它会形成酸雨,对环境造成危害。
3. 硫化物硫化物是硫和金属元素的化合物,常见的有硫化铁、硫化铜等。
它们具有独特的性质,可以用作金属提取、制备合金等。
另外,一些硫化物还具有半导体性能,被应用于电子器件中。
4. 硫酸化合物硫酸盐是含有硫酸根离子的化合物,常见的有硫酸钠、硫酸铜等。
它们具有酸性,可以与碱和金属反应,生成对应的盐和水。
硫酸盐在工业生产、农业生产和医药中都具有重要的用途。
三、硫化合物的应用1. 工业生产硫化合物在工业生产中有着广泛的应用,如制酸、制药、染料生产等。
硫酸盐是重要的化工原料,被广泛用于肥料、皮革、玻璃等行业。
2. 农业生产硫化合物在农业生产中也具有重要的作用,硫酸铵和硫酸钾是常用的化肥原料,可以提供作物生长所需的硫元素。
此外,硫磺还可以用于农药制备。
3. 矿业开采硫化物是很多金属矿石的主要成分,如硫化铁、硫化铜等,它们是金属提取的重要原料。
此外,一些硫化物还具有一定的经济价值,如黄铁矿等。
4. 环境保护硫化合物在环境保护中具有重要作用,二氧化硫是大气污染的重要来源之一,需要加强控制排放。
另外,硫酸盐还可以用于处理废水和废气,减少环境污染。



加热加热加热点燃加热 点燃 加热课题含硫化合物的性质及其应用教学过程一、硫及其重要化合物的主要性质及用途: 1.硫:(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态) 2Na+S===Na 2S (剧烈反应并发生爆炸)2Al+3S Al 2S 3(制取Al 2S 3的唯一途径)Fe+S FeS (黑色)2Cu + S Cu 2S (黑色) ②与非金属反应S+O 2 SO 2S+H 2H 2S (说明硫化氢不稳定)③与化合物的反应S+6HNO 3(浓)H 2SO 4+6NO 2↑+2H 2OS+2H 2SO 4(浓) 2SO 2↑+2H 2O3S+6NaOH 2Na 2S+Na 2SO 3+3H 2O (用热碱溶液清洗硫)(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2.硫的氢化物: ①硫化氢的制取:Fe+H 2SO 4(稀)=FeSO 4+H 2S ↑(不能用浓H 2SO 4或硝酸,因为H 2S 具有强还原性) ——H 2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质A .可燃性:当22/O S H n n ≥2/1时,2H 2S+O 22S+2H 2O (H 2S 过量)当22/O S H n n ≤2/3时,2H 2S+3O 2点燃2SO 2+2H 2O (O 2过量)当23222<<O SH n n 时,两种反应物全部反应完,而产物既有硫又有SO 2 B .强还原性:常见氧化剂Cl 2、Br 2、Fe 3+、HNO 3、KMnO 4等,甚至SO 2均可将H 2S 氧化。
加热SO2 SO2 CO2 CO2C.不稳定性:300℃以上易受热分解③H2S的水溶液叫氢硫酸,是二元弱酸。

含硫化合物的用途含硫化合物在生活和工业中有着广泛的用途。
硫化合物是指含有硫元素的化合物,其中硫的氧化态可以为-2、0、+4、+6。
首先,含硫化合物在农业中具有重要的作用。
硫是植物生长所必需的微量元素之一,能够促进植物的光合作用,提高植物的光合效率和养分吸收能力。
因此,硫化合物常被用作农药的主要成分,例如硫磺和硫胺素。
硫磺可以用于防治病虫害,如硫磺熏蒸可以杀灭农作物种子表面的病菌和虫卵,保护作物的生长。
硫胺素是维生素B1的一种硫化衍生物,可以用作动物饲料添加剂,提高动物的生长速度和健康水平。
其次,含硫化合物在化学工业中有着重要的应用。
硫酸是一种重要的含硫酸化合物,广泛应用于冶金、石油、纺织、化肥等工业生产。
硫酸被用来生产肥料,例如磷酸二氢钾肥料中的磷酸二氢铵和磷酸二氢钾,以及超磷酸钙肥料中的磷酸钙。
此外,硫酸还可以用于制备其他化学品,如硫酸亚铁、硫酸铵等。
硫酸亚铁是电池制造业中常用的电池电解液,硫酸铵则是一种常见的氮肥。
含硫化合物还在制药工业中发挥着重要作用。
硫化合物在制药中常用于合成药物原料,例如硫酸巴曲酮是一种抗抑郁药,硫酸卡巴拉汀是一种消化性溃疡治疗药物,它们都是含有硫化合物的药物。
此外,硫化合物还可以用于合成抗生素、抗肿瘤药物等重要药物。
含硫化合物还在能源领域具有重要应用。
硫化氢是一种常见的含硫气体,它可以被用作生产化学品和能源转换。
例如,硫化氢被用来制造硫醇、硫酸铵以及生产液化石油气等。
此外,硫醇化合物也被用于石油提炼和燃料添加剂的制备。
此外,含硫化合物还广泛应用于日常生活中。
有机硫化合物常被用作香料和香水的成分,例如硫化苯和硫化酚等。
硫酸氢钠是一种常见的食品添加剂,被用来调节食品的酸碱度和增加食品的酸味。
硫酸铜是一种常见的消毒剂,广泛用于水处理和游泳池消毒等领域。
另外,硫化合物还常被用作制备染料、油漆和胶水等工业产品。
总而言之,含硫化合物在农业、化学工业、制药、能源和日常生活中均具有广泛的应用。

含硫化合物的性质与反应硫是一种常见的元素,它在自然界和化学反应中都扮演着重要角色。
硫可以与其他元素形成含硫化合物,在化学研究和工业生产中具有广泛的应用。
本文将介绍含硫化合物的性质和反应,以及一些相关的应用。
一、含硫化合物的性质1. 物理性质:含硫化合物通常呈现出白色或黄色结晶固体,具有特定的熔点和沸点。
一些含硫化合物也可溶于水或有机溶剂中。
此外,它们往往具有恶臭的气味,如硫化氢(H2S)。
2. 化学性质:含硫化合物在化学反应中表现出一系列特征。
首先,它们能够与氧气反应生成硫酸,这是含硫化合物最常见的反应之一。
例如,二氧化硫(SO2)与水反应形成亚硫酸(H2SO3),进一步氧化则形成硫酸(H2SO4)。
其次,含硫化合物还可以与金属离子反应生成金属硫化物。
这种反应常被用于化学分析和沉淀反应。
最后,含硫化合物还能够参与氧化还原反应,例如硫酸铜与铁反应形成硫酸亚铁和硫。
二、含硫化合物的反应1. 氧化反应:氧化反应是含硫化合物最常见的反应之一。
例如,硫化氢与氧气反应生成二氧化硫和水。
反应方程式如下:2H2S + O2 -> 2SO2 + 2H2O此外,硫化物也可以以其他形式参与氧化反应,产生不同的硫氧化物。
2. 还原反应:含硫化合物也可以参与还原反应。
例如,金属硫化物可以与氧化剂反应,将硫还原为硫化物。
这种反应在冶金和电化学工业中常被应用。
3. 酸碱反应:含硫化合物通常表现出酸性反应。
例如,硫化氢溶于水会生成硫酸,并具有酸性溶液的性质。
与碱性物质反应时,硫化物离子会与金属离子结合形成金属硫化物沉淀。
三、含硫化合物的应用1. 工业生产:含硫化合物在许多工业领域有重要应用。
例如,二氧化硫广泛用于造纸、制药、食品和化肥工业中。
硫化氢则在石油和矿石冶炼过程中用作氧化剂和消毒剂。
2. 化学分析:含硫化合物通常用于化学分析,用于检测金属离子。
通过与金属离子反应生成可溶性或不溶性的金属硫化物沉淀,可以实现对金属离子的检测和定量。
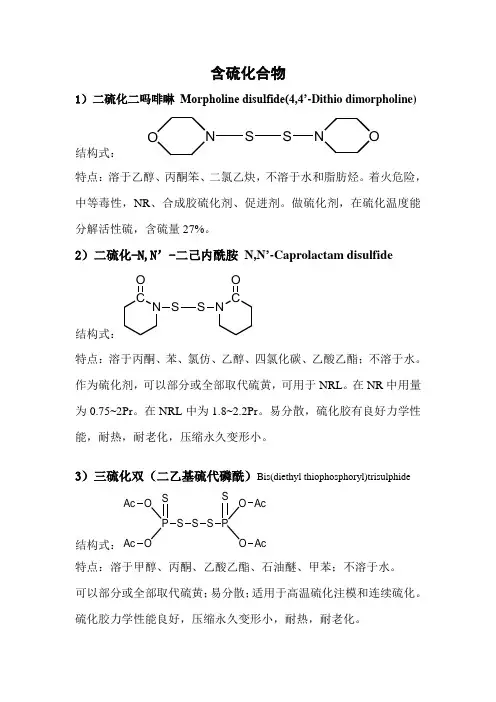
含硫化合物1)二硫化二吗啡啉Morpholine disulfide(4,4’-Dithio dimorpholine)结构式:S N OSNO特点:溶于乙醇、丙酮笨、二氯乙炔,不溶于水和脂肪烃。
着火危险,中等毒性,NR、合成胶硫化剂、促进剂。
做硫化剂,在硫化温度能分解活性硫,含硫量27%。
2)二硫化-N,N’-二己内酰胺N,N’-Caprolactam disulfide结构式:NCNC O OS S特点:溶于丙酮、苯、氯仿、乙醇、四氯化碳、乙酸乙酯;不溶于水。
作为硫化剂,可以部分或全部取代硫黄,可用于NRL。
在NR中用量为0.75~2Pr。
在NRL中为1.8~2.2Pr。
易分散,硫化胶有良好力学性能,耐热,耐老化,压缩永久变形小。
3)三硫化双(二乙基硫代磷酰)Bis(diethyl thiophosphoryl)trisulphide结构式:S S S PPS S OOOOAcAc AcAc特点:溶于甲醇、丙酮、乙酸乙酯、石油醚、甲苯;不溶于水。
可以部分或全部取代硫黄;易分散;适用于高温硫化注模和连续硫化。
硫化胶力学性能良好,压缩永久变形小,耐热,耐老化。
4)一氯化硫Sulfur monochlorideCl S S Cl结构式:特点:有毒,有刺激性。
NR、合成橡胶及胶乳用硫化剂,不适用于氯丁橡胶。
可直接加入橡胶及胶乳中,特别适用于硫化胶乳及薄片模型橡胶制品,也可以用于自硫化胶浆。
5)二氯化硫Sulfur dichlorideCl S Cl结构式:特点:有毒,有氯臭,遇水易分解。
NR、合成橡胶及胶乳用硫化剂,不适用于氯丁橡胶。
可直接加入橡胶及胶乳中,特别适用于硫化胶乳及薄片模型橡胶制品,也可以用于自硫化胶浆。
6)烷基苯酚硫化物Alkyphenoldisulfide特点:可作天然胶或合成胶制品给硫体类硫化剂。
含有活性硫,在受热状态下可对橡胶起硫化作用,与胶料相容性好,硫化胶不喷霜,拉伸强度高,并具有优良耐热性能。


含硫化合物知识点总结初中含硫化合物是化学中重要的一类化合物,它们在日常生活和工业生产中具有广泛的应用。
本文将对初中生所需了解的含硫化合物的知识点进行总结。
一、含硫化合物的基本概念含硫化合物是指化学式中含有硫原子的化合物。
硫是一种常见的非金属元素,具有特殊的化学性质。
通过与其他元素的结合,硫可以形成多种化合物。
常见的含硫化合物有硫化氢、硫酸、硫酸铜等。
二、硫化氢的性质和用途硫化氢(H2S)是一种无色、刺激性气味的气体。
它是硫化物最简单的化合物,具有剧烈的毒性。
硫化氢可用于检测金属离子的存在,也可以作为某些化学反应的催化剂。
然而,由于其毒性,使用时需格外小心。
三、硫酸的性质和用途硫酸(H2SO4)是一种无色、具有强烈腐蚀性的液体。
它是一种重要的化工原料,广泛应用于冶金、制药、电子等行业。
硫酸还可用于制备其他含硫化合物,如硫酸铜。
四、硫酸铜的性质和用途硫酸铜(CuSO4)是一种蓝色结晶固体,具有良好的溶解性。
硫酸铜可用作防腐剂、杀菌剂和催化剂。
此外,硫酸铜还可用于制备其他铜化合物,如碳酸铜。
五、硫化物的存在形式和来源硫化物可以以固体、气体或液体的形式存在。
在自然界中,含硫矿石是硫化物的重要来源。
人类通过采矿和冶炼将硫化物提取出来,并将其用于各种工业生产和科学研究中。
六、含硫化合物的环境影响含硫化合物对环境有一定的影响。
例如,硫化合物的氧化物在大气中形成硫酸和硫酸盐,其中一些会以酸雨的形式降落到地表,对生态系统和建筑物造成损害。
此外,含硫化合物的燃烧也会产生有害的气体和颗粒物。
七、安全使用含硫化合物的注意事项在使用含硫化合物时,需注意以下事项:首先,应在通风良好的环境下操作,以避免有毒气体的积聚。
其次,应佩戴个人防护装备,如手套、护目镜和防护服,以防止物质直接接触皮肤和眼睛。
最后,应遵守相关的安全操作规程,以确保自身和他人的安全。
总结:含硫化合物是化学中重要的一类化合物,初中生需要了解其基本概念、性质和用途。

水体中的含硫化合物全文共四篇示例,供读者参考第一篇示例:水体中含有硫化合物,是由于地下水中的硫化氢、硫酸盐等物质溶解导致的。
这些含硫化合物是地球上常见的无机化合物,对水质和水生生物造成了不良影响。
本文将会探讨水体中含硫化合物的来源、对水质的影响以及处理方法等方面。
水体中的含硫化合物主要来源于地下水中的硫酸盐和硫化氢。
硫酸盐是由硫酸和盐类等物质组成的盐类,其中含有一定量的硫元素。
而硫化氢是一种无色有刺激性气体,通常呈现为硫化氢的离子形式存在在水中。
这些含硫化合物通常通过地下水层的流动,溶解到水体中,造成了水体中的硫化物质浓度升高。
水体中含有过高浓度的硫化物质会对水质造成不良影响。
硫化物质会使水体呈现出一种刺鼻的恶臭味道,对人体健康和生活环境造成不良影响。
硫化物质还会影响水体中的溶解氧含量,导致水体缺氧,对水生生物的生长和繁殖造成危害。
硫化物质还会与其他有机物质产生化学反应,形成二次污染物,影响水体的整体水质。
针对水体中含硫化合物的问题,可以采取一些有效的处理方法。
可以通过生物法,即利用特定的微生物对硫化物质进行降解。
这种方法不仅能够有效地去除水体中的硫化物质,还能够提高水体中的溶解氧含量,改善水质状况。
可以采用物理法,如通过氧化还原反应或化学沉淀法等手段去除水体中的含硫化合物。
这种方法相对简便,但效果可能不如生物法明显。
水体中含硫化合物是一种常见的水质污染物,对水体和水生生物造成了不良影响。
为了保护水资源和维护生态平衡,我们应当采取有效的措施,去除水体中的含硫化合物,提高水质标准。
也需要加强对水质监测和管理,及时发现并解决水体中的含硫化物质污染问题,保护水资源的可持续利用。
【本文共计XX字】。
第二篇示例:水体是地球上最重要的资源之一,无论对于生物还是人类生活,都有着不可或缺的重要性。
在我们环境中还存在着一些不利于水质的因素,其中包括含有硫化合物的污染物。
硫化合物是一类含有硫元素的化合物,可能对水体产生不利影响。

硫醇硫醇是一类通式为R-SH的化合物,其中-SH称巯基。
低级的硫醇有强烈且令人讨厌的气味,但臭味随碳数增多而减弱,高级硫醇具有令人愉快的气味。
它们是醇的含硫对应化合物,但相比之下,硫醇的酸性和亲核性更强,更易被氧化。
在空气、碘、氧化铁、二氧化锰等弱氧化剂作用下,硫醇氧化得到二硫化物:2R-SH -[O]→ R-S-S-R + H2O 。
金属锂在液氨中,以及氢化铝锂或锌加酸都可使二硫化物还原为硫醇/硫酚。
硫醇与二硫化物互相转化的氧化还原反应是生物体内常见现象之一,半胱氨酸经氧化转化为胱氨酸即是一例。
二硫化物中含有的二硫键(-S-S-)是维持蛋白质空间结构的重要化学键之一。
强氧化剂(如高锰酸钾、硝酸、高碘酸)作用下,硫醇氧化经过中间产物次磺酸、亚磺酸,最终得到磺酸。
催化加氢条件下,硫醇失硫生成相应的烃。
工业上,因为硫会使一般的催化剂(如雷尼镍)中毒,这一步脱硫常在二硫化钼或二硫化钨等含硫催化剂的作用下进行,一个例子是由噻吩催化加氢制取四氢噻吩。
硫醇与羧酸反应成硫醇酯,与醛生成缩硫醛,与酮生成缩硫酮。
后两个反应一般用于羰基的保护,保护基缩硫醛/酮具有特殊有用的极性翻转性质。
硫醚硫醚是一类通式为R-S-R的化合物。
相比醚,硫醚中的C-S键键能较低,容易断裂,有时可以形成稳定的含硫自由基。
硫原子含有两对孤对电子,具亲核性和碱性,可与浓硫酸或卤代烷成锍盐。
锍盐经氢氧化银和水作用转化为氢氧化三烷基锍,有强碱性,加热分解为硫醚和烯烃。
硫醚也可被多种氧化剂(如过氧化氢)氧化,中间产物是亚砜,最终产物是砜。
高碘酸和间氯过氧苯甲酸可使氧化反应停留在亚砜的阶段。
此外,催化加氢也可使硫醚中的C-S键断裂,生成烷烃。
亚砜、砜亚砜和砜是通式分别为R-S(=O)-R和R-S(=O)2-R的化合物。
硫原子为sp杂化态,S=O键为强极性键,硫带部分正电荷,氧带部分负电荷,具亲核性。
α-氢具酸性。
两个烃基不同的亚砜有手性,有些可以被拆分出来。
水体中的含硫化合物
水体中的含硫化合物主要包括硫酸盐、硫化物和悬浮的含硫有机物等。
硫化物主要有H2S、HS-、S2-等三种形式存在,且它们的数量和存在形式与水体的pH值有关。
在酸性条件下,硫化物主要以H2S形式存在;当pH大于8时,则主要以HS-和S2-形式存在。
这些含硫化合物可能来自多种源头。
天然源如火山爆发、硫矿床的氧化以及动植物残体的腐败分解都可以通过雨水冲刷等作用进入水体。
此外,在人类活动过程中,工业废水和农业污水等排放的含硫污染物也是水体中硫化合物的重要来源。
工业废水中的含硫化合物主要来自化学工业、石油化工、煤炭燃烧等生产过程,而农业污水中的硫化合物则主要来源于化肥、农药的使用以及家畜粪便的排放等。
这些硫化物对水生动物,特别是甲壳类动物,具有高毒性,可能是通过鳃表面粘膜与组织中的化学离子结合形成具有强烈刺激作用的物质,抑制某些酶化反应从而产生毒害。
同时,硫化氢还可以与血液中的血红蛋白结合,降低机体的携氧能力。
因此,硫化物是水体污染的一项重要指标,对水质监控具有重要意义。
对于高密度、集约化养殖等可能导致生态系统破坏和
— — 1 —1 —
水体自净能力弱化的活动,应特别注意防止硫化物的产生和积累。
含硫化合物的性质和应用硫:物理性质:黄色或淡黄色固体(很脆)不溶于水微溶于酒精易溶于CS2(用于洗去试管壁上的硫)硫有多种同素异形体(如单斜硫、斜方硫等)。
化学性质:(1)与金属单质反应:(与变价金属反应,一般生成低价态的硫化物,汞除外)意思就是硫单质不具有强氧化性(实验室中处理洒落的汞)(2)与非金属单质反应:①(在空气中发出淡蓝色火焰,纯氧中发出明亮的蓝紫色火焰)②(无色,有臭鸡蛋气味的有毒气体,能溶于水)(3)与强氧化性酸反应:(4)与强碱溶液反应:二氧化硫:物理性质:无色有刺激性气味的气体,有毒,沸点为-10℃,易液化,易溶于水(1体积水大约能溶解40体积SO2气体),密度(2.86g/L)比空气略大,(用向上排空气法收集)。
化学性质:(1)酸性氧化物(能和碱反应生成盐和水的一类氧化物)①与水反应:②与碱性氧化物反应:③与碱反应:④与某些盐反应:(2)二氧化硫中的硫元素的化合价为+4价,位于中间价态,既具有氧化性又具有还原性。
①氧化性:②还原性:(3)二氧化硫等特性——漂白性SO2与某些有色物质(如品红)结合生成不稳定的无色化合物,加热又恢复原来的颜色。
(在工业上,二氧化硫可用于漂白纸浆以及草帽等编织物。
)小结:①+4价的S具有较强的还原性(自身被氧化,化合价升高)SO2、H2SO3及亚硫酸盐中的S都为+4价都具有较强的还原性。
(雨水放置pH变小原因是H2SO4比H2SO3稳定,电离出更多的H )(空气中放置变质)②SO2具有漂白性,Cl2也可以用于漂白,如果将等物质的量的SO2与Cl2混合其漂白性不会增强。
因为混合物可能会失去漂白作用。
③SO2可使品红溶液褪色,但遇石蕊试液只变红不褪色。
④SO2可使溴水、碘水、KMn O4溶液褪色,这是因为SO2的还原性而不是漂白性。
⑤鉴别SO2和CO2不能用澄清石灰水,因为:鉴别方法a.用品红溶液。
使品红溶液褪色的是SO2;不能使品红溶液褪色的是CO2。
含硫化合物1 硫化合物硫化合物是包含硫键的化合物,由一个硫原子和另一个原子组成,形成单原子硫键。
硫在其六个电子结构中一共具有六种氧化物形式,其中四种形式有二原子硫键,被称为二价硫化合物。
它们是:硫氧化物(SO)、硫氯化物(SCl2)、硫硝酸盐(SNO2)和硫酸盐(SO3)。
2 分子结构硫氧化物,也称硫醚、二甲基硫醚或瑞士醚,是最重要的二价硫化合物。
它的分子结构由两个硫原子和一个氧原子组成,在分子中形成四元环。
硫氯化物,也被称为正磷硫醚,它的分子结构也由两个硫原子和一个氯原子组成,形成三元环。
硫硝酸盐比硫氯化物更脆弱,它的分子结构由两个硫原子和两个氧原子组成,形成了二元环。
最后,硫酸盐的分子结构由三个硫原子和三个氧原子组成,也形成了四元环。
3 生物作用二价硫化合物几乎可以在所有生物系统和环境中找到,它们的生物学作用也不容忽视。
硫氧化物作为一种能够改善水质的抗氧化剂,可以被用来净化水体,使蓝藻去除和盐析出更有效。
硫氯化物可以有效抵抗病原体,防止感染,而且还可以促进植物的光合作用,增加养份而提高产量。
此外,硫仍是人体免疫系统的重要组成成分,人体的一些重要细胞和酶都包含了硫化合物。
4 环境影响硫化合物也可以通过工业废水排放造成环境污染,其中醋酸硫酸盐产生的废水硫挥发性最大。
废水中含有高浓度的硫化合物将可能引起水和空气污染,例如导致地表水酸化,硝酸盐污染,大气酸雨和硫化氢致病毒性事件。
此外,汽车尾气和低温时发电站放出的低温排风也排放了大量的硫化合物和硫酸盐,从而对大气造成很大的污染。
定期监测气体排放中的硫氧化物含量,减少硫化合物对环境的污染,对保护环境极为重要。
因此,硫化合物是至关重要的,既可以是生物体的重要成分,也可以在一定范围内有效地提高水质,但如果排放过多,就会造成环境污染。
2.1 硫醇
硫醇是一类通式为R-SH的化合物,其中-SH称巯基。
低级的硫醇有强烈且令人讨厌的气味,但臭味随碳数增多而减弱,高级硫醇具有令人愉快的气味。
它们是醇的含硫对应化合物,但相比之下,硫醇的酸性和亲核性更强,更易被氧化。
在空气、碘、氧化铁、二氧化锰等弱氧化剂作用下,硫醇氧化得到二硫化物:2R-SH -[O]→ R-S-S-R + H2O 。
金属锂在液氨中,以及氢化铝锂或锌加酸都可使二硫化物还原为硫醇/硫酚。
硫醇与二硫化物互相转化的氧化还原反应是生物体内常见现象之一,半胱氨酸经氧化转化为胱氨酸即是一例。
二硫化物中含有的二硫键(-S-S-)是维持蛋白质空间结构的重要化学键之一。
强氧化剂(如高锰酸钾、硝酸、高碘酸)作用下,硫醇氧化经过中间产物次磺酸、亚磺酸,最终得到磺酸。
催化加氢条件下,硫醇失硫生成相应的烃。
工业上,因为硫会使一般的催化剂(如雷尼镍)中毒,这一步脱硫常在二硫化钼或二硫化钨等含硫催化剂的作用下进行,一个例子是由噻吩催化加氢制取四氢噻吩。
硫醇与羧酸反应成硫醇酯,与醛生成缩硫醛,与酮生成缩硫酮。
后两个反应一般用于羰基的保护,保护基缩硫醛/酮具有特殊有用的极性翻转性质。
2.2 硫醚
硫醚是一类通式为R-S-R的化合物。
相比醚,硫醚中的C-S键键能较低,容易断裂,有时可以形成稳定的含硫自由基。
硫原子含有两对孤对电子,具亲核性和碱性,可与浓硫酸或卤代烷成锍盐。
锍盐经氢氧化银和水作用转化为氢氧化三烷基锍,有强碱性,加热分解为硫醚和烯烃。
硫醚也可被多种氧化剂(如过氧化氢)氧化,中间产物是亚砜,最终产物是砜。
高碘酸和间氯过氧苯甲酸可使氧化反应停留在亚砜的阶段。
此外,催化加氢也可使硫醚中的C-S键断裂,生成烷烃。
2.3 亚砜、砜
亚砜和砜是通式分别为R-S(=O)-R和R-S(=O)2-R的化合物。
硫原子为sp杂化态,S=O 键为强极性键,硫带部分正电荷,氧带部分负电荷,具亲核性。
α-氢具酸性。
两个烃基不同的亚砜有手性,有些可以被拆分出来。
亚砜很容易被氧化剂(例如过氧乙酸、四氧化二氮、高碘酸钠、间氯过氧苯甲酸等)氧化为砜,被还原则得到硫醚。
它也有弱碱性,可与强酸成盐。
2.4 磺酸、亚磺酸
磺酸和亚磺酸是通式分别为R-S(=O)2-OH和R-S(=O)-OH的化合物。
磺酸为强酸,可以和金属氢氧化物反应生成稳定的盐,烃基芳香磺酸盐常用作洗涤剂。
其衍生物包括磺酰氯、磺酸酯和磺酰胺,都是很重要的产物:磺酰氯如对甲苯磺酰氯,是有机合成中常用的试剂;磺酸酯中的磺酰氧基是很好的离去基团;磺酰胺衍生物中有很多则是重要的消炎药物,如磺胺类的磺胺嘧啶、磺胺胍等等。
亚磺酸具有中等的酸性,可被空气氧化为磺酸,被锌和盐酸还原为硫醇,与卤代烷生成砜。
它们由格氏试剂与二氧化硫反应制备。
2.5 硫叶立德
硫叶立德是一类通式为R2S-CR2的化合物,最常见的是亚甲基硫叶立德。
它们由锍盐在碱作用下失去HX而得到,属于较稳定的两性离子型化合物,碳带负电荷,有较强的亲核性。
硫叶立德是比较常用的有机合成试剂,它们与醛、酮、α,β-不饱和醛酮反应生成环氧乙烷衍生物,与双键碳原子上连有酯基、硝基、氰基等吸电子基的烯烃反应生成环丙烷的衍生物。
2.6 硫烷、高价硫烷
硫烷和高价硫烷通式为SR4及SR6,母体SH4、SH6在理论上是存在的,但极为不稳定。
1990年时制得了同族的碲的六甲基化合物(Te(Me)6),用的是二氟化氙与Te(Me)2F2反应,再用二乙基锌处理。
类似的SMe6据计算是稳定的,但尚未制得。
硫烷类型的
四价有机硫化合物稳定性不高,最常用的是二乙基氨基三氟化硫(DASF)。
它是常用的氟化试剂,可作四氟化硫的替代品,与醇、醛和酮反应时,氧原子变为氟,得到有机氟化合物。
首个不含其他杂原子的高价硫烷于2006年制得,其中的硫原子与两个联苯配体及两个顺式甲基相连。
它是由二联苯硫(IV)作原料,使其与二氟化氙/三氟化硼在乙腈中反应,而后用丁基锂在四氢呋喃中处理得到。
C-S键长在189-193pm之间,硫为变形八面体结构。
编辑本段3. 合成
有机硫化合物中的硫原子可以通过多种方法引入,常见的途径包括:①以硫氢化钠中的硫氢根离子(HS)作亲核试剂,通过双分子亲核取代反应合成硫醇。
硫醇可作其他有机硫化合物的合成原料,比如它在碱性条件下转化为硫醇负离子,与卤代烃反应,便可引入另一个烷基,得到硫醚;②劳氏试剂与羰基化合物反应,将其转化为硫羰基化合物。
用此方法,醛酮转化为硫醛/硫酮,酰胺转化为硫代酰胺,1,4-二羰基化合物环合生成噻吩环,等等;③用十硫化四磷、硫化氢或其他硫化物将原料中的氧转化为硫,依此,酰胺/腈和酮可分别被转化为硫代酰胺和硫酮。
用十硫化四磷在加温下与1,4-二羰基化合物反应,环化制得噻吩类化合物,称为帕尔-诺尔合成(Paal-Knorr合成)。
④六甲基二硅硫烷与含氧或氯的有机物反应,借助硅元素对这两种元素的亲合力,将原料转化为相应的含硫有机化合物。
六甲基二硅硫烷由硫化钠与三甲基氯硅烷反应制备;⑤通过二硫化碳引入硫原子,同时增加一个碳,例如用醇和二硫化碳制备黄原酸酯;⑥用硫氰酸钾或硫氰酸铵与RX(X为较好的离去基团)反应,制得硫氰酸酯及异硫氰酸酯。