铁铜及其重要化合物_高三一轮复习上课
- 格式:ppt
- 大小:3.28 MB
- 文档页数:71





年级高三学科化学版本苏教版内容标题高三第一轮复习:铁、铜的性质【本讲教化信息】一. 教学内容:铁、铜的性质二. 教学目标相识铁是一种较活泼的金属,了解铁的物理性质,驾驭铁的化学性质;驾驭铁的有关性质试验以及对试验现象的分析;通过演绎法去分析铜及其重要化合物的化学性质。
三. 教学重点、难点铁的性质及有关性质试验和试验现象的分析四、教学过程:(一)铁及其化合物的性质1、铁在周期表中的位置及结构铁位于第四周期第Ⅷ族,电子排布式为:1s22s22p63s23p63d64s2原子结构示意图为在化学反应中易失去两个或三个电子形成+2或+3价:Fe―2e―=Fe2+;Fe―3e―=Fe3+2、纯铁具有银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
纯铁的抗腐蚀实力很强,通常我们所见的铁中由于含有碳等物质,抗腐蚀实力较弱,易发生电化腐蚀。
在酸性介质中发生:析氢腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H++2e-=H2;在中性或碱性介质中发生:吸氧腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H2O+O2+4e-=4OH-3、化学性质:铁是较活泼的金属,易失去最外层和次外层的电子,常显+2、+3价,且Fe3+比Fe2+稳定。
(1)与非金属反应:铁与强氧化剂反应生成+3价铁的化合物,与弱氧化剂反应生成+2价铁的化合物。
如:3Fe+2O2Fe3O4;2Fe+3Cl22FeCl3;Fe+S FeS(2)与水反应:铁在加热至红热时能与水蒸气发生反应。
3Fe+4H2O(g)Fe3O4+4H2常温下,铁与水不起反应,但在水和空气里O2、CO2等共同作用下,铁易被腐蚀。
(3)与酸反应:非氧化性酸:Fe+2H+=Fe2++H2↑氧化性酸:常温下,铁遇浓硫酸、浓硝酸会钝化,加热条件下可发生氧化还原反应。
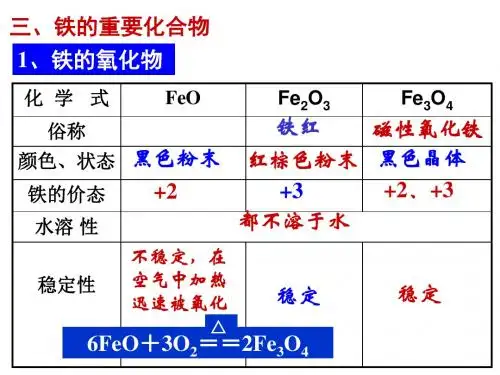
Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2OFe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O(4)与盐溶液反应:Fe+Cu2+=Fe2++Cu;Fe+2Fe3+=3Fe2+4、铁的重要化合物:名称氧化亚铁氧化铁四氧化三铁化学式FeO Fe2O3Fe3O4价态+2 +3 +2、+3俗名铁红磁性氧化铁名称氧化亚铁氧化铁四氧化三铁色态黑色粉末红棕色粉末黑色晶体①FeO+2H+==Fe2++H2O ②Fe2O3+6H+==2Fe3+ + 3H2O③Fe3O4+8H+==Fe2+ +2Fe3+ +4H2O ④3FeO+10HNO3==3Fe(NO3)3+NO↑+5H2O⑤Fe2O3+6H+==2Fe3+ + 3H2O ⑥3Fe3O4+28HNO3==9Fe(NO3)3+NO↑+14H2O⑦FeO+2H+==Fe2++H2O ⑧Fe2O3+6HI==2FeI2+I2+3H2O⑨Fe3O4+8HI==3FeI2+I2+4H2O说明:1、铁在化学反应中不仅可失去最外层的电子显+2价,还可以失去部分次外层的电子显+3价,当失去d能级中1个电子时,形成3d5的半充溢状态,比较稳定,因此,铁的+3价化合物较稳定。




