高考化学一轮复习 模块一 元素及其化合物 专题一 属及其化合物 考点三 铁及其化合物课件A
- 格式:ppt
- 大小:4.08 MB
- 文档页数:15

第8讲铁及其重要化合物复习目标1.掌握铁及其重要化合物的主要性质及其应用。
2.了解铁及其化合物的制备方法。
3.掌握铁及其化合物的转化关系及应用。
4.理解化工流程及实验室中实现铁及其化合物的转化原理和条件分析。
考点一铁的单质、氧化物、氢氧化物必备知识整理1.单质铁(1)位置与物理性质(2)化学性质铁元素性质活泼,有较强的________,主要化合价为________、________价。
①与非金属单质的反应(写化学方程式)②与水的反应(写化学方程式)常温下铁与水不反应,在高温条件下与水蒸气反应:________________________________________________________________________。
③与酸的反应(写离子方程式)④与某些盐溶液的反应(写离子方程式)微点拨(1)铁在潮湿的空气中生成的铁锈的主要成分是Fe2O3,而铁在纯氧中燃烧的产物是Fe3O4。
(2)铁遇冷的浓硝酸、浓硫酸时,表面会生成一层致密的氧化膜,阻止了内层铁的继续反应,化学上称之为钝化,属于化学变化。
(1)FeO、Fe3O4、Fe(OH)2与足量HNO3反应时,发生氧化还原反应,Fe2+被HNO3氧化生成Fe3+。
(2)Fe2O3、Fe3O4、Fe(OH)3与足量HI反应时,发生氧化还原反应,Fe3+被I-还原生成Fe2+。
[正误判断](1)Fe分别与氯气和盐酸反应所得氯化物相同()(2)Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应()(3)铁的化学性质较活泼,所以铁在自然界中全部以化合态存在()(4)根据铁与Cl2、S反应的条件及产物中铁元素的化合价可以判断氯元素和硫元素的非金属性强弱()(5)氧化铁能与酸反应,所以可用于制作红色染料()(6)Fe3O4中Fe的化合价有+2价和+3价,可表示为FeO ·Fe2O3,因而Fe3O4是FeO和Fe2O3的混合物()(7)既可通过复分解反应,又可通过化合反应制取Fe(OH)3()(8)饱和FeCl3溶液为红褐色,Fe(OH)2为灰绿色()对点题组训练题组一铁及其重要化合物1.下列物质的性质描述正确的是()A.Fe在Cl2中燃烧生成FeCl2和FeCl3B.Fe高温下与水蒸气反应,生成Fe(OH)2和H2C.除去FeCl2溶液中少量的FeCl3杂质,可以在溶液加过量的铁粉、再过滤D.硫酸铜溶液中加少量的铁粉反应的离子方程式:3Cu2++2Fe===2Fe3++3Cu2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣。







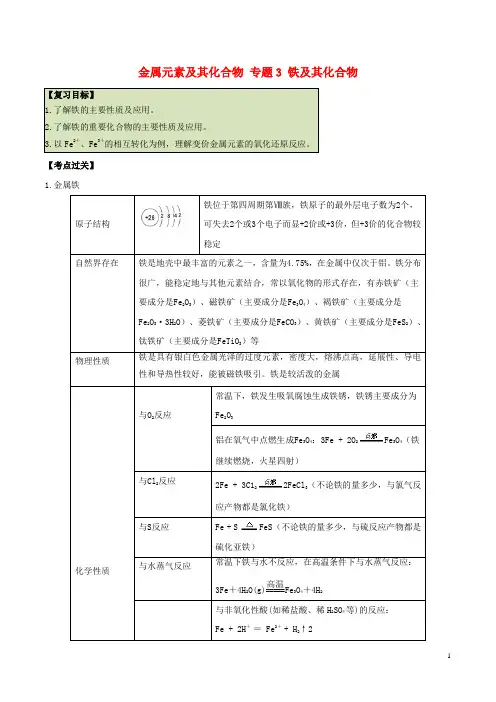
金属元素及其化合物专题3 铁及其化合物【复习目标】1.了解铁的主要性质及应用。
2.了解铁的重要化合物的主要性质及应用。
3.以Fe2+、Fe3+的相互转化为例,理解变价金属元素的氧化还原反应。
【考点过关】1.金属铁原子结构铁位于第四周期第Ⅷ族,铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定自然界存在铁是地壳中最丰富的元素之一,含量为4.75%,在金属中仅次于铝。
铁分布很广,能稳定地与其他元素结合,常以氧化物的形式存在,有赤铁矿(主要成分是Fe2O3)、磁铁矿(主要成分是Fe3O4)、褐铁矿(主要成分是Fe2O3·3H2O)、菱铁矿(主要成分是FeCO3)、黄铁矿(主要成分是FeS2)、钛铁矿(主要成分是FeTiO3)等物理性质铁是具有银白色金属光泽的过度元素,密度大,熔沸点高,延展性、导电性和导热性较好,能被磁铁吸引。
铁是较活泼的金属化学性质与O2反应常温下,铁发生吸氧腐蚀生成铁锈,铁锈主要成分为Fe2O3铝在氧气中点燃生成Fe3O4:3Fe + 2O2Fe3O4(铁继续燃烧,火星四射)与Cl2反应2Fe + 3C122FeCl3(不论铁的量多少,与氯气反应产物都是氯化铁)与S反应Fe + S FeS(不论铁的量多少,与硫反应产物都是硫化亚铁)与水蒸气反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe+4H2O(g)=====高温Fe3O4+4H2与非氧化性酸(如稀盐酸、稀H2SO4等)的反应:Fe + 2H+= Fe2++ H2↑2与酸溶液反应 常温下,遇浓硫酸、浓硝酸发生钝化,所以可用铁制容器盛装浓硫酸或浓硝酸加热时,铝与热浓硫酸、浓硝酸反应: 2Fe +6H 2SO 4(浓)Fe 2(SO 4)3+3SO 2↑+6H 2O铁与稀硝酸反应不产生H 2。
当HNO 3过量时,铁元素的存在形式为Fe 3+。
反应原理:Fe +4HNO 3===Fe(NO 3)3+NO↑+2H 2O ,当Fe 过量时,铁元素的存在形式为Fe 2+。


专题1 元素及其化合物第一单元金属及其化合物(氧化还原反应)第3讲铁及其化合物一、课程标准要求1.了解铁的物理性质和化学反应。
2.了解铁的氧化物、氢氧化物的化学性质。
3.结合真实情境中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质,了解它们在生产生活中的主要应用。
二、在高中化学教材体系中的地位“铁及其化合物”是高中化学必修教材中的核心内容,是高中一年级全体学生都应学习的重点化学内容。
铁元素不仅是典型的金属元素,还是重要的变价元素。
铁及其化合物与人体健康密切相关,在生产生活中也有着广泛的应用。
三、思维导图四、课时安排建议第1课时铁、铁的氧化物和氢氧化物(1课时)第2课时铁盐、亚铁盐的性质及其综合应用(1课时)第1课时铁、铁的氧化物和氢氧化物(1课时)一、教学流程活动一:构建知识体系问题1:铁单质有哪些物理性质、化学性质?[例题1] 1.判断正误,正确的打“√”,错误的打“×”。
(1)铁位于元素周期表中第4周期第ⅧB族。
()(2)室温下,Fe与浓H2SO4反应生成FeSO4。
()(3)将一定量的铁、铜的混合物加入100 mL 0.1 mol·L-1的FeCl3溶液中,充分反应后,溶液中有固体剩余,则剩余的固体中一定含有铜,可能含有铁。
()(4)Fe分别与氯气和盐酸反应所得氯化物相同。
()(5)氢氧化铁与HI溶液仅发生中和反应。
()[答案](1)×(2)×(3)√(4)×(5)×[归纳总结](一)铁元素及其原子结构1.铁位于周期表中第周期族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
2.原子结构(二)铁单质1.物理性质:纯铁具有金属的共性,如具有色金属光泽,具有性、性和性,具有能被吸引的特性。
2.化学性质(1)与非金属单质的反应①与氧气反应:。
②与氯气反应:。
③与硫反应:。
(2)与水蒸气的反应:。
(3)与酸、盐的反应①与氧化性酸反应(写离子方程式):铁与过量稀硝酸反应:。