2019高考一轮复习铁及其化合物
- 格式:ppt
- 大小:501.51 KB
- 文档页数:46
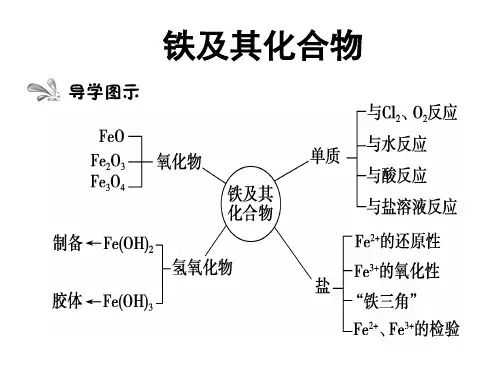

铁及其重要化合物学习任务1铁及其重要化合物一、铁元素及其原子结构1.铁位于周期表中第四周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
2.原子结构二、铁单质1.物理性质纯铁具有金属的共性,如具有银白色金属光泽,具有导电性、导热性和延展性,具有能被磁铁吸引的特征。
2.化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质反应 ①与O 2反应常温:铁在潮湿的空气中被腐蚀生成铁锈,其主要成分为Fe 2O 3·x H 2O 。
点燃(化学方程式):3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2反应(化学方程式):2Fe +3Cl 2=====△2FeCl 3。
③与S 反应(化学方程式):Fe +S=====△FeS 。
(2)与水反应常温下铁与水不反应,高温下与水蒸气反应(化学方程式):3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸反应①与非氧化性酸反应(离子方程式):Fe +2H +===Fe 2++H 2↑。
②与氧化性酸反应:遇冷的浓硫酸或浓硝酸发生钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应,但无H 2产生。
a.Fe 与过量稀HNO 3反应(离子方程式):Fe +NO -3+4H +===Fe 3++NO ↑+2H 2O ; b.Fe 与少量稀HNO 3反应(离子方程式):3Fe +8H ++2NO -3===3Fe 2++2NO ↑+4H 2O 。
(4)与盐溶液反应①与CuSO 4溶液反应(离子方程式):Fe +Cu 2+===Fe 2++Cu 。
②与FeCl3溶液反应(离子方程式):Fe+2Fe3+===3Fe2+。
三、铁的氧化物1.氧化性和还原性含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如遇Br2、Cl2、H2O2、NO-3(H+)等均表现还原性。

铁及其化合物1.铁元素是维持生命活动不可缺少的微量元素之一。
铁的元素符号是( )A.Mg B.Ca C.Fe D.Zn2.下列反应不能通过化合反应直接制得的是()A.FeCl2B.FeCl3C.Fe(OH)3D.Fe(OH)23.既有氧化性,又有还原性的微粒是( )A.Fe B.Fe2+C.Fe3+D.Cu2+4.将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是()A.硫酸B.氯水C.硫酸锌D.氯化铜5.下列关于铁及其化合物的说法中,不正确...的是( )A.金属铁可被磁铁吸引B.铁元素有可变化合价C.铁丝在氯气中燃烧生成FeCl2 D.常温下铁片遇浓硫酸会发生钝化6.某些补铁剂的成分中含有硫酸亚铁,长期放置会因氧化而变质。
检验硫酸亚铁是否变质的试剂是( )A.稀盐酸B.石蕊溶液C.KSCN溶液D.氯水7.证明溶液中是否含Fe2+,操作的正确顺序是( )①加入少量KMnO4溶液②滴入少量KSCN溶液③加入少量氯水A.先①后②B.先②后①C.先②后③D.先③后②8.明代宋应星所著《天工开物》中有记载:“黄矾,乃即炼皂矾(FeSO4·7H2O)炉侧土墙……刮取下来,名日黄矾,染家用之。
金色浅者涂炙,立成紫赤色也。
”下列有关黄矾说法错误的是( )A.黄矾的主要成分中含有Fe3+B.黄矾在医药上可以作补铁剂C.黄矾可以应用于印染工业D.黄矾经火烤,立刻生成Fe2O39.下列关于铁及其化合物说法错误的是( )A.Fe在潮湿的空气中容易生锈B.丹霞地貌的岩层因含Fe2O3而呈红色C.FeO中铁元素的化合价呈+2价D.含Fe2+盐溶液遇KSCN溶液显红色10.印刷电路板的制作原理是用足量的FeCl3溶液腐蚀覆铜板上不需要的铜箔。
下列说法正确的是( )A.用KSCN溶液可检验腐蚀后溶液中的Fe2+B.Fe3+能溶解Cu,说明金属性Cu>FeC.当有1mol电子转移时,溶液中Cu2+增加1molD.腐蚀后溶液中的金属阳离子有Fe3+、Fe2+、Cu2+11.贫血是一种常见的疾病,其中缺铁性贫血是贫血中最常见的类型,通常补铁剂会与维生素C同服。





第三讲铁及其重要化合物1.认识铁及其重要化合物的制备方法。
2.掌握铁及其重要化合物的主要性质及其应用。
铁及其重要化合物[ 知识梳理 ]1.铁的物理性质纯铁拥有金属的共性,如拥有银白色金属光彩,拥有导电性、导热性和延展性,拥有能被磁铁吸引的特点。
2.铁的化学性质(用化学方程式或离子方程式表示)铁单质性质开朗,有较强的复原性,铁元素主要化合价为+2价和+3价。
(1)与非金属单质的反响①与 O2的反响常温:铁被腐化生成铁锈,其主要成分为Fe2O3。
点燃点燃: 3Fe+ 2O 2===== Fe3O 4。
点燃②与 Cl 2的反响: 2Fe+ 3Cl2===== 2FeCl 3。
△③与 S 的反响: Fe+ S===== FeS。
(2)与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应: 3Fe +高温4H 2O(g)=====Fe3 O4+ 4H 2。
(3)与酸的反响① 与非氧化性酸反响的离子方程式:Fe+ 2H + ===Fe 2++ H2↑。
② 与氧化性酸反响:遇冷的浓硫酸或浓硝酸发生钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反响,但无 H2产生。
(4)与盐溶液的反响①与 CuSO 4溶液反响的离子方程式:Fe+ Cu2+ ===Fe 2++ Cu 。
②与 FeCl3溶液反响的离子方程式:Fe+ 2Fe3+===3Fe 2+。
3.铁的氧化物化学式FeO俗名颜色黑色粉末状态溶解性难溶于水铁元素+ 2的化合价稳固性不稳固FeO+ 2H +===Fe 2+与 H+反响的+离子方程式H2OFe2O3Fe3O 4铁红磁性氧化铁黑色晶体红棕色粉末(有磁性 )难溶于水难溶于水+3+2,+ 3稳固稳固Fe2O3+ 6H +Fe3O4+ 8H +===Fe 2 ===2Fe 3++++ 2Fe3++ 4H 2O 3H2O4.铁的氢氧化物化学式Fe(OH) 2Fe(OH) 3色态与盐酸反响受热分解制备二者的关系白色固体红褐色固体Fe(OH) 3+3H +===Fe 3++Fe(OH) 2+2H + ===Fe 2++ 2H 2O3H2O△2Fe(OH) 3===== Fe2O 3+ 3H 2 O 可溶性亚铁盐与碱溶液反响: Fe2+可溶性铁盐与碱溶液反响:Fe3 + 2OH - ===Fe(OH) 2↓++3OH-===Fe(OH)3↓在空气中, Fe(OH) 2能够特别快速地被氧气氧化成Fe(OH) 3,现象是白色絮状积淀快速变为灰绿色,最后变为红褐色,反响方程式为4Fe(OH) 2+ O2+ 2H 2 O===4Fe(OH) 35.亚铁盐和铁盐(1)亚铁盐含有 Fe2+的溶液呈浅绿色,Fe2+既有氧化性,又有复原性,Fe2+与Zn、Cl2反响的离子方程式分别为Zn+ Fe2+===Zn 2++Fe、 2Fe2++Cl2===2Fe 3++ 2Cl-。


第2课时铁及其重要化合物的性质[课型标签:知识课基础课]知识点一铁及铁的化合物一、铁的存在与性质1.铁元素的存在形式2.铁的物理性质颜色状态导电性、导热性、延展性特性地壳含量银白色固体良好被磁铁吸引占第4位3.铁的化学性质单质铁性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe+4H2O(g)Fe3O4+4H2。
(3)与酸的反应(4)与某些盐溶液反应4.铁的冶炼(1)原料:铁矿石、焦炭、空气、石灰石。
(2)设备:高炉。
(3)主要反应①还原剂的生成:C+O2CO2,CO2+C2CO;②铁的还原:Fe2O3+3CO2Fe+3CO2;③造渣反应:CaCO 3CaO+CO2↑,CaO+SiO 2CaSiO3。
二、铁的氧化物与氢氧化物1.铁的氧化物(1)物理性质化学式FeO Fe2O3Fe3O4俗称铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体溶解性难溶于水难溶于水难溶于水铁的价态+2价+3价+2价,+3价(2)化学性质FeO、Fe2O3、Fe3O4与盐酸反应的离子方程式分别为FeO+2H+Fe2++H2O,Fe2O3+6H+2Fe3++3H2O,Fe3O4+8H+2Fe3++Fe2++4H2O。
2.铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体溶解性难溶于水难溶于水与盐酸反应Fe(OH)2+2H+Fe2++2H2OFe(OH)3+3H+Fe3++3H2O受热分解2Fe(OH)3Fe2O3+3H2O制法可溶性亚铁盐与碱反应:Fe2++2OH-Fe(OH)2↓可溶性铁盐与碱反应:Fe3++3OH-Fe(OH)3↓两者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3三、重要的铁盐1.三氯化铁(FeCl3):棕黄色固体,一种常见的氧化剂,能与多种还原剂发生氧化还原反应,能回收废铜,其反应的离子方程式为2Fe3++Cu Cu2++2Fe2+。
第7讲:铁及其化合物一、单选题(共14题;共28分)1.下列关于铁与水反应的描述不正确的是()A. 铁与水蒸气反应的产物是黑色的Fe2O3B. 红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声C. 铁与水蒸气的反应是氧化还原反应D. 常温下,Fe与H2O不反应,但在空气中O2、CO2、H2O的共同作用下能发生反应2.元素X的单质及X 与Y形成的化合物能发生如图所示的转化,则X 为()A. CuB. FeC. SD. C3.检验硫酸铁溶液中是否含有硫酸亚铁,可选用的试剂是()A. NaOH 溶液B. 酸性KMnO4溶液C. KSCN 溶液D. Cu4.已知硝酸能将Fe2+氧化为Fe3+.下列物质反应后能使KSCN溶液变红的是()①过量的Fe与Cl2反应②Fe和过量稀硫酸反应③FeCl2溶液中通入少量Cl2④Fe和Fe2O3的混合物溶于盐酸中⑤向Fe(NO3)2溶液中加入过量稀硫酸.A. 只有①B. 只有①③⑤C. 只有①②③D. 全部5.下列变化不能通过一步反应直接完成的是()A. Fe→Fe3+B. Fe→Fe3O4C. Al(OH)3→Al2O3D. Al→Al(OH)36.一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2.则A、C可能是()①Fe、FeCl3②C、CO2③AlCl3、NaAlO2④NaOH、NaHCO3⑤S、SO3⑥Na2CO3、CO2.A. ②③④⑥B. ②③④⑤⑥C. ①②③④⑥D. ①②③④⑤⑥7.为了探究铁及其化合物的氧化性或还原性,某同学设计如下实验方案,其中符合实验要求且完全正确的是()选项实验操作实验现象实验结论离子反应A 向FeCl2溶液中加入Zn片浅绿色溶液变为无色Zn具有还原性Fe2++Zn═Zn2++FeB 向FeCl2溶液中滴新制氯水浅绿色溶液变为棕黄色 Fe2+具有还原性 2Fe2++Cl2═2Fe3++2Cl﹣C 向FeCl3溶液中加入铁粉棕黄色溶液变为浅绿色 Fe具有还原性Fe+Fe3+═2Fe2+D 向FeCl3溶液中加入铜粉蓝色溶液变为棕黄色Fe3+具有氧化性Fe3++Cu═Fe2++Cu2+A. AB. BC. CD. D8.一定条件下,下列各组物质能一步实现如图所示转化关系的是()选项X Y Z WA Al Al2O3 NaAlO2 Al(OH)3B Fe2O3Fe FeCl2FeCl3C H2SO4SO2S SO3D NH3N2NO NO2A. AB. BC. CD. D9.硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是()A. Na+、Fe3+、NO3﹣、Cl2都可在该物质的溶液中大量共存B. 向0.1mol·L﹣1该物质的溶液中滴加0.1mol·L﹣1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示C. 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色D. 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42﹣完全沉淀的离子方程式为:Fe2++2SO42﹣+3Ba2++2OH﹣═2BaSO4↓+Fe(OH)2↓10.常温下,将一定量的铁粉加入到50 mL10mol/L硝酸(①)中,待其充分反应后,收集到的气体换算成标准状况下的体积为4.2L(②),所得溶液能够使淀粉碘化钾溶液变蓝(③),该溶液也能使酸性高锰酸钾褪色(④)。