高考化学一轮复习铁及其重要化合物资料
- 格式:ppt
- 大小:3.40 MB
- 文档页数:13

铁及其重要化合物建议用时:40分钟满分:100分一、选择题(每题6分,共66分)1.(2024·荆州高三测试)铁是人类应用较早,当前应用量最大的金属元素。
下列有关铁及其化合物的说法中正确的是( )A .赤铁矿的主要成分是Fe 3O 4B .铁与水蒸气在高温下的反应产物为Fe 2O 3和H 2C .除去FeCl 2溶液中的FeCl 3杂质可以向溶液中加入铁粉,然后过滤D .Fe 3+与KSCN 产生红色沉淀 答案 C解析 赤铁矿的主要成分是Fe 2O 3;铁与水蒸气在高温下的反应产物为Fe 3O 4和H 2;Fe 3+遇KSCN 溶液变为红色,但没有沉淀产生,一般可以用此方法检验Fe 3+的存在。
2.下列说法正确的是( )A .中性溶液中可能大量存在Fe 3+、K +、Cl -、SO 2-4 B .氧化铁能与酸反应,因此可用于制作红色涂料C .Fe 2O 3――→盐酸FeCl 3(aq)――→蒸发无水FeCl 3能一步实现 D .铁粉作食品袋内的脱氧剂是起还原作用 答案 D解析 中性溶液中Fe 3+因水解完全不能大量存在,A 项错误;B 项,氧化铁用作红色涂料是利用了其颜色呈红棕色,与其能与酸反应的性质无关,错误;C 项,氯化铁溶液蒸发最终得到的产物是氢氧化铁,因为铁离子在加热时水解程度不断加大;D 项,铁粉作食品袋内的脱氧剂,防止食品被氧化,起还原作用。
3.向某溶液中加入含Fe 2+的溶液后,无明显改变。
再滴入几滴新制氯水,混合溶液变成红色,则下列结论错误的是( )A .该溶液中确定含有SCN -B .氧化性:Fe 3+>Cl 2C .Fe 2+与SCN -不能形成红色物质 D .Fe 2+被氧化为Fe 3+答案 B解析 溶液中的Fe 2+与加入的新制氯水发生反应:2Fe 2++Cl 2===2Fe 3++2Cl -,氧化性:Fe 3+<Cl 2。
能使含Fe 3+的溶液变为红色,说明原溶液中确定含有SCN -。



考点16 铁及其重要化合物一、铁的性质1.铁的物理性质纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。
2.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应: ①与O 2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3。
点燃时:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S=====△FeS 。
(2)与水的反应:常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应:①与非氧化性酸反应的离子方程式:Fe +2H +===Fe 2++H 2↑。
②与氧化性酸:遇冷的浓硫酸或浓硝酸钝化,与稀硝酸或在加热条件下与浓硫酸、浓硝酸反应无H 2产生。
Fe 过量 3Fe+8H ++23NO -3Fe 2++2NO↑+4H 2O Fe 不足Fe+4H ++3NO -Fe 3++NO↑+2H 2O(4)与某些盐溶液的反应:①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
②与FeCl 3溶液反应的离子方程式:2Fe 3++Fe===3Fe 2+。
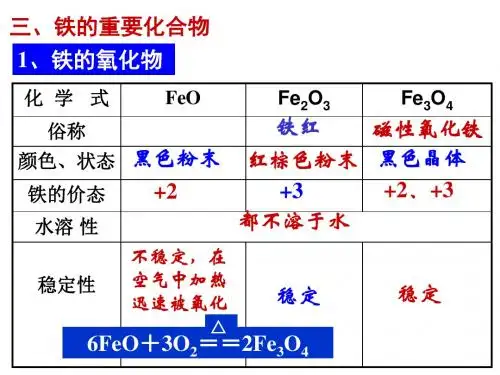
二、铁的氧化物和氢氧化物 1.铁的氧化物的比较铁的氧化物 FeO Fe 2O 3 Fe 3O 4 俗称 无 铁红 磁性氧化铁 色、态 黑色粉末 红棕色粉末黑色晶体 铁的价态 +2+3 +2、+3水溶性 难溶于水 稳定性不稳定性 6FeO+O 22Fe 3O 4 稳定稳定 与非氧化性酸的反应 FeO+2H +Fe 2++H 2OFe 2O 3+6H +2Fe 3++3H 2OFe 3O 4+8H +2Fe 3++ Fe 2++4H 2O与CO 的反应Fe x O y +y COx Fe+y CO 2制取高温熔融,过量的铁与氧气反应 2Fe+O 22FeOFe(OH)3的分解 2Fe(OH)3Fe 2O 3+3H 2O铁在氧气中燃烧3Fe+2O 2Fe 3O 4提醒:(1)Fe 3O 4的组成可用氧化物的形式表示为FeO·Fe 2O 3,即有13的铁显+2价,23的铁显+3价; (2)Fe 3O 4与一般酸反应生成两种盐,Fe 3O 4与稀硝酸反应生成一种盐[Fe(NO 3)3]。

第2讲 铁及其重要化合物[课程标准]1.结合真实情境中的应用实例或通过实验探究,了解铁及其重要化合物的主要性质,了解这些物质在生产、生活中的应用。
2.结合实例认识铁及其化合物的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。
考点一 铁的单质、氧化物和氢氧化物1.铁的单质(1)原子结构铁位于元素周期表第四周期第Ⅷ族,原子结构示意图为,化学反应中易失去2个或3个电子而表现为+2价或+3价。
铁在地壳中的含量居第四位。
(2)物理性质纯铁具有银白色的金属光泽和良好的延展性,是电和热的良导体,具有能被磁体吸引的特性;纯铁有很强的抗腐蚀能力。
(3)化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
①Fe 与Cl 2、S 反应的化学方程式:2Fe +3Cl 2=====△2FeCl 3;Fe +S=====△FeS 。
②Fe 与水蒸气反应的化学方程式:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
③Fe 与氧化性酸(如HNO 3)的反应(写离子方程式,下同)Fe 与过量稀HNO 3的反应:Fe +NO -3+4H +===Fe 3++NO↑+2H 2O ;F e 与少量稀HNO 3的反应:3Fe +2NO -3+8H +===3Fe 2++2NO↑+4H 2O 。
④Fe 与FeCl 3溶液的反应:Fe +2Fe 3+===3Fe 2+。
[点拨] ①铁分别与氯气和盐酸反应所得的产物中铁元素的价态不同,Fe 与Cl 2反应无论用量多少都生成FeCl 3,而Fe 与盐酸反应生成FeCl 2。
②铁在潮湿的空气中生成的铁锈的主要成分是Fe 2O 3,而铁在纯氧中燃烧的产物是Fe 3O 4。
2.铁的氧化物(1)物理性质 化学式 FeO Fe 2O 3 Fe 3O 4 俗称— 铁红 磁性氧化铁 色、态黑色粉末 红棕色粉末 黑色晶体 铁的价态+2价 +3价 +2价、+3价 (2)化学性质①FeO、Fe 2O 3、Fe 3O 4分别与盐酸反应的离子方程式:FeO +2H +===Fe 2++H 2O ;Fe 2O 3+6H +===2Fe 3++3H 2O ;Fe 3O 4+8H +===2Fe 3++Fe 2++4H 2O 。

知识清单06 铁及其重要化合物知识点01 单质铁的结构和性质1.铁的原子结构(1)周期表中位置:第 周期第 族(2)微粒结构示意图(3)电子排布式: (4)价层电子排布式: (5)电子运动状态: (6)空间运动状态:①最高能级电子数 ②最高能层电子数 ③未成对电子数 ④稳定性:Fe 2+Fe 3+2.铁元素的存在游离态存在于中黄铁矿 赤铁矿磁铁矿褐铁矿自然界菱铁矿铁单质铁锅的主要成分盐补铁保健品三氧化二铁粉剔红墙的 化合态社会生活四氧化三铁激光打印机的3.铁的物理性质(1)颜色:纯铁呈色,常见的铁呈色(2)熔、沸点高,抗腐蚀性 ,具有金属的通性。
(3)特性:能够被吸引,可用于分离提纯4.铁的化学性质(1)与弱氧化剂反应:Fe ---------------------→S 、I 2、H +、Cu 2+Fe 2+①Fe+S②Fe+I 2③Fe+H + = ④Fe+Cu 2+=(2)与强氧化剂反应:Fe -----------------------------------------→Cl 2、Br 2、浓硫(硝)酸、稀硝酸Fe 3+①Fe ---------→Cl 2点燃 ,生成 烟②Fe ----------→浓硫酸 常温 ;Fe ----------→浓硫酸加热 或③Fe ----------→浓硝酸 常温 ;Fe ----------→浓硝酸加热 或④Fe -----------→稀硝酸过量 ;Fe -----------→稀硝酸少量 (3)生成Fe 3O 4的反应①O 2:②水蒸气:5.铁单质的制备方法①工业上利用铁矿石在高炉中炼铁,以赤铁矿为例写出该反应的化学方程式_ ②利用铝热反应焊接无缝钢轨,写出以氧化铁和铝粉为铝热剂反应的化学方程式_铁的易错知识点(1)Fe 与O 2(点燃)、H 2O (g )(高温)反应的固体产物都是 而不是Fe 2O 3。
(2)常温下,Fe 、Al 在冷的浓硫酸和浓硝酸中发生 ,但加热后能继续反应。

2014 高三化学第一轮复习学案---铁、铜及其化合物学习目标:1.了解过渡金属铁、铜的原子结构及其在周期表中的位置。
2.掌握过渡元素铁和铜及其重要化合物的主要性质、相互转化及其应用。
3.掌握铁的氢氧化物的制备。
4•掌握F0、Fe3+的有关计算、除杂、鉴别、分离等方面的应用。
1、掌握铁及其重要化合物的性质;【知识点一】铁单质1、铁的存在及原子结构存在:在地壳中含量仅次于氧、硅、铝,居第四位,为常见的活泼金属,因而自然界中除了陨石中能找到单质铁外,铁都以化合态形式存在。
周期表中位置:铁元素位于周期、族;原子结构:。
思考题:决定元素化学性质的主要因素一定是最外层电子吗?2、铁的物理性质:银白色,有金属光泽,质软、具有良好的延展性、是电和热的良导体; 特性:能被磁体吸引.3、铁的化学性质书写铁与下列物质反应方程式,思考铁的价态表现并发现其反应规律;⑴与非金属反应:氯气、氧气、硫单质、碘单质;小结反应规律:⑵铁与酸反应:盐酸、稀硫酸、稀硝酸、浓硫酸(冷、热)、浓硝酸(冷、热)(适时考虑铁少量、与过量的反应情况)小结反应规律:(3)与盐溶液、与水的反应4、铁的冶炼:【知识点二】铁的氧化物、氢氧化物氧化物方法一:Fe2+;Fe3+方法二:Fe2+;Fe3+【巩固练习】1将铁粉溶于足量稀H2SO4后,所得溶液分装在A B、C三支试管中。
(1)在A试管中滴中双氧水,然后滴入KSCN溶液,溶液呈红色,反应的离子方程式是_____________________________________________________________ ;(2)___________________________________________________________________________________ 在B试管中滴入KMnO4溶夜,溶液紫色褪去,反应的离子方程式是 _______________________________ (3)在C试管中滴入KSCN溶液,然后在空气中放置片刻,溶液呈红色,反应的离子方程式是________________________ 。


铁及其重要化合物【考情分析】本讲内容为高考的高频考点,从分值来看,铁所占的比重最大,除铁是重要的金属元素外,还取决于铁元素与生产生活的紧密联系,Fe、Fe2+、Fe3+之间的转化,以及所承载的氧化还原反应等重要知识点。
考查内容主要集中在“铁三角”,Fe与酸的反应,铁的变价、Fe(OH)2和Fe(OH)3的性质等。
考查内容能在多种题型中出现,选择、简答、实验、推断、计算都有。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
【网络构建】【知识梳理】知能点一铁1.位置:铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
2.结构3.铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
4.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应 ①与O 2的反应:常温:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3。
点燃:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S FeS 。
④与I 2的反应:Fe +I 2FeI 2(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应(4)与某些盐溶液反应①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
②与FeCl 3溶液反应的离子方程式:2Fe 3++Fe===3Fe 2+。