高三一轮复习-铁及其化合物
- 格式:docx
- 大小:589.61 KB
- 文档页数:18

铁及其重要化合物建议用时:40分钟满分:100分一、选择题(每题6分,共66分)1.(2024·荆州高三测试)铁是人类应用较早,当前应用量最大的金属元素。
下列有关铁及其化合物的说法中正确的是( )A .赤铁矿的主要成分是Fe 3O 4B .铁与水蒸气在高温下的反应产物为Fe 2O 3和H 2C .除去FeCl 2溶液中的FeCl 3杂质可以向溶液中加入铁粉,然后过滤D .Fe 3+与KSCN 产生红色沉淀 答案 C解析 赤铁矿的主要成分是Fe 2O 3;铁与水蒸气在高温下的反应产物为Fe 3O 4和H 2;Fe 3+遇KSCN 溶液变为红色,但没有沉淀产生,一般可以用此方法检验Fe 3+的存在。
2.下列说法正确的是( )A .中性溶液中可能大量存在Fe 3+、K +、Cl -、SO 2-4 B .氧化铁能与酸反应,因此可用于制作红色涂料C .Fe 2O 3――→盐酸FeCl 3(aq)――→蒸发无水FeCl 3能一步实现 D .铁粉作食品袋内的脱氧剂是起还原作用 答案 D解析 中性溶液中Fe 3+因水解完全不能大量存在,A 项错误;B 项,氧化铁用作红色涂料是利用了其颜色呈红棕色,与其能与酸反应的性质无关,错误;C 项,氯化铁溶液蒸发最终得到的产物是氢氧化铁,因为铁离子在加热时水解程度不断加大;D 项,铁粉作食品袋内的脱氧剂,防止食品被氧化,起还原作用。
3.向某溶液中加入含Fe 2+的溶液后,无明显改变。
再滴入几滴新制氯水,混合溶液变成红色,则下列结论错误的是( )A .该溶液中确定含有SCN -B .氧化性:Fe 3+>Cl 2C .Fe 2+与SCN -不能形成红色物质 D .Fe 2+被氧化为Fe 3+答案 B解析 溶液中的Fe 2+与加入的新制氯水发生反应:2Fe 2++Cl 2===2Fe 3++2Cl -,氧化性:Fe 3+<Cl 2。
能使含Fe 3+的溶液变为红色,说明原溶液中确定含有SCN -。





第10讲铁及其重要化合物(模拟精练+真题演练)完卷时间:50分钟可能用到的相对原子质量:O16Fe56一、选择题(每小题只有一个正确选项,共12×5分)1.(2023·上海奉贤·统考二模)要除去3FeCl 溶液中少量的2FeCl ,可行的方法是A .滴入KSCN 溶液B .通入氯气C .加入适量铜粉并过滤D .加入适量铁粉并过滤【答案】B【解析】A .KSCN 与氯化铁溶液发生反应,不与氯化亚铁反应,A 错误;B .氯气能将氯化亚铁氧化为氯化铁,B 正确;C .铜粉能与氯化铁反应生成氯化亚铁,C 错误;D .铁粉能与氯化铁反应生成氯化亚铁,D 错误;故选B 。
2.(2023·黑龙江大庆·统考一模)含铁物质与其相应化合价的关系如图所示。
下列推断合理的是A .可用苯酚溶液鉴别đ和eB .a 与水反应可直接生成cC .e 的水溶液常用于净水D .存在e-d-f-g 的循环转化关系【答案】A 【分析】由图中铁元素的化合价及所属类别,可确定a 为Fe 、b 为FeO 、c 为Fe 2O 3、d 为含Fe 3+的盐、e 为含Fe 2+的盐、f 为Fe(OH)3、g 为Fe(OH)2。
【解析】A .d 为含Fe 3+的盐、e 为含Fe 2+的盐,Fe 3+能与苯酚发生显色反应,而Fe 2+与苯酚不能发生显色反应,所以可用苯酚溶液鉴别Fe 3+和Fe 2+,A 正确;B .a 为Fe 、c 为Fe 2O 3,Fe 与水在常温下不反应,在高温下反应生成Fe 3O 4等,不可直接生成Fe 2O 3,B 错误;C .e 为含Fe 2+的盐,Fe 3+的水溶液常用于净水,但Fe 2+氧化后才能用于净水,C 错误;D .Fe 2+能一步转化为Fe 3+,Fe 3+能一步转化为Fe(OH)3,但Fe(OH)3不能一步转化为Fe(OH)2,D 错误;故选A 。
3.(2023·河北邢台·校联考模拟预测)用绿矾(42FeSO 7H O ⋅)制备电池电极材料4LiFePO的流程如下:下列说法正确的是A .反应2中氧化剂与还原剂的物质的量之比为1:2B .洗涤沉淀时可用玻璃棒搅拌C .可用酸性4KMnO 溶液检验反应1中2Fe +是否完全反应D .溶解过程中34H PO 可抑制2Fe +的水解【答案】D【解析】A .反应1中H 2C 2O 4将FePO 4还原为4LiFePO ,Fe 元素由+3价下降到+2价,C 元素由+3价上升到+4价,FePO 4为氧化剂,H 2C 2O 4为还原剂,根据得失电子守恒可知氧化剂与还原剂的物质的量之比为2:1,A 错误;B .洗涤沉淀时用玻璃棒搅拌容易把滤渣捣破,B 错误;C .反应1中NaClO 将Fe 2+氧化为Fe 3+,NaClO 转化为NaCl ,Cl -也能使酸性4KMnO 溶液褪色,不能用酸性4KMnO 溶液检验反应1中2Fe +是否完全反应,故C 错误;D .2Fe +在水溶液中会发生水解,溶解过程中34H PO 可以出氢离子,抑制2Fe +的水解,故D 正确;故选D 。
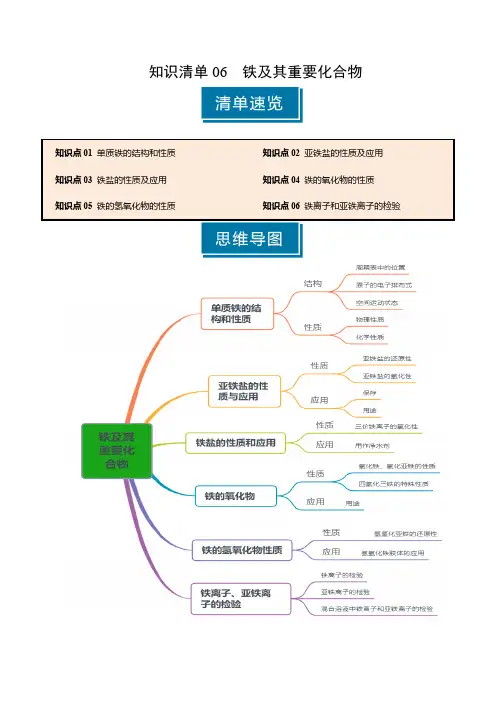
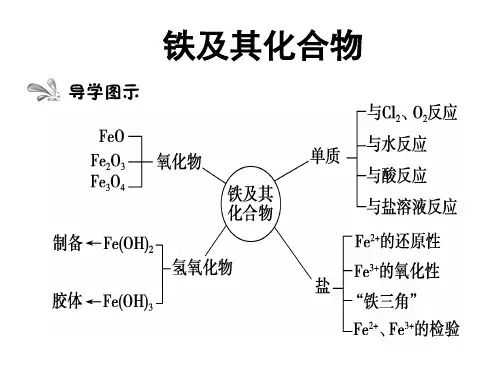
知识清单06 铁及其重要化合物知识点01 单质铁的结构和性质1.铁的原子结构(1)周期表中位置:第4周期第Ⅷ族(2)微粒结构示意图(3)电子排布式:1s 22s 22p 63s 23p 63d 64s 2(4)价层电子排布式:3d 64s 2(5)电子运动状态:26(6)空间运动状态:12①最高能级电子数6②最高能层电子数2③未成对电子数4④稳定性:Fe 2+<Fe 3+2.铁元素的存在游离态存在于陨铁中黄铁矿FeS 2赤铁矿Fe 2O3磁铁矿Fe 3O 4褐铁矿_2Fe 2O 3·3H 2O_自然界菱铁矿_FeCO 3铁单质铁锅的主要成分亚铁盐补铁保健品三氧化二铁粉剔红墙的涂料化合态社会生活四氧化三铁激光打印机的墨粉3.铁的物理性质(1)颜色:纯铁呈银白色,常见的铁呈灰黑色(2)熔、沸点高,抗腐蚀性强,具有金属的通性。
(3)特性:能够被磁铁吸引,可用于分离提纯4.铁的化学性质(1)与弱氧化剂反应:Fe ---------------------→S 、I 2、H +、Cu 2+Fe 2+①Fe+S FeS②Fe+I 2FeI 2③Fe+H + = Fe 2++H 2↑④Fe+Cu 2+= Fe 2++Cu(2)与强氧化剂反应:Fe -----------------------------------------→Cl 2、Br 2、浓硫(硝)酸、稀硝酸Fe 3+①Fe ---------→Cl 2点燃FeCl 3,生成棕红色烟②Fe ----------→浓硫酸常温钝化;Fe ----------→浓硫酸加热Fe 3+或Fe 2+③Fe ----------→浓硝酸常温钝化;Fe ----------→浓硝酸加热Fe 3+或Fe 2+④Fe -----------→稀硝酸过量Fe 2+;Fe -----------→稀硝酸少量Fe 3+(3)生成Fe 3O 4的反应①O 2:3Fe+2O 2Fe 3O 4②水蒸气:3Fe+4H 2O (g )Fe 3O 4+4H 25.铁单质的制备方法①工业上利用铁矿石在高炉中炼铁,以赤铁矿为例写出该反应的化学方程式_Fe 2O 3+3CO =====高温2Fe +3CO 2__。



铁及其重要化合物【考情分析】本讲内容为高考的高频考点,从分值来看,铁所占的比重最大,除铁是重要的金属元素外,还取决于铁元素与生产生活的紧密联系,Fe、Fe2+、Fe3+之间的转化,以及所承载的氧化还原反应等重要知识点。
考查内容主要集中在“铁三角”,Fe与酸的反应,铁的变价、Fe(OH)2和Fe(OH)3的性质等。
考查内容能在多种题型中出现,选择、简答、实验、推断、计算都有。
【核心素养分析】1.宏观辨识与微观探析:认识铁及其化合物的性质及应用,能以“铁三角”转化关系理解变价元素的转化条件。
2.科学态度与社会责任:利用铁及其化合物的性质,科学认识铁及其化合物的提纯和制备工艺流程,形成严谨求实的科学态度和崇尚真理的意识。
3.科学探究与创新意识:能提出有价值的氢氧化亚铁及其他铁的化合物的制备方案,并进行实验探究。
【网络构建】【知识梳理】知能点一铁1.位置:铁位于元素周期表中第4周期Ⅷ族,是一种应用最广泛的过渡金属元素;铁元素是一种典型的变价金属元素。
2.结构3.铁的物理性质银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。
4.铁的化学性质铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应 ①与O 2的反应:常温:铁被腐蚀生成铁锈,其主要成分为Fe 2O 3。
点燃:3Fe +2O 2=====点燃Fe 3O 4。
②与Cl 2的反应:2Fe +3Cl 2=====点燃2FeCl 3。
③与S 的反应:Fe +S FeS 。
④与I 2的反应:Fe +I 2FeI 2(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
(3)与酸的反应(4)与某些盐溶液反应①与CuSO 4溶液反应的离子方程式:Fe +Cu 2+===Fe 2++Cu 。
②与FeCl 3溶液反应的离子方程式:2Fe 3++Fe===3Fe 2+。
课型学科课时备课时间教师姓名课题铁及其化合物教学目标1、了解铁及其重要化合物的制备方法;2、掌握铁及其化合物的主要性质及其应用重难点:教师活动个性修改【教学过程】考点一铁及其重要化合物一、铁的存在与性质1.铁元素的存在形式[注意]Fe3O4有磁性,能被磁铁吸引,又称磁性氧化铁。
2.铁的物理性质颜色状态导电、导热性、延展性特性地壳含量银白色固体良好被磁铁吸引占第4位3.铁的化学性质铁元素性质活泼,单质有较强的还原性,主要化合价为+2价和+3价。
(1)与非金属单质的反应①与O2的反应:常温下:铁被腐蚀生成铁锈,其主要成分为Fe2O3。
点燃时:3Fe+2O2点燃,Fe3O4。
②与Cl2的反应:2Fe+3Cl2点燃,2FeCl3。
③与S的反应:Fe+S△,FeS。
(2)与水的反应常温下铁与水不反应,在高温条件下与水蒸气反应:制法可溶性亚铁盐与碱反应: Fe 2++2OH -===Fe(OH)2↓ 可溶性铁盐与碱反应: Fe 3++3OH -=== Fe(OH)3↓二者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3[注意] (1)Fe 3O 4的组成可用氧化物的形式表示为FeO·Fe 2O 3,即有1/3的铁显+2价,2/3的铁显+3价。
(2)Fe(NO 3)2溶液酸化后,H +、NO -3具有强氧化性,会将Fe 2+氧化成Fe 3+。
考点二 铁盐和亚铁盐一、掌握亚铁盐、铁盐的化学性质 1.亚铁盐含有Fe 2+的溶液呈浅绿色,既有氧化性,又有还原性。
(1)氧化性:Fe 2+与Zn 反应的离子方程式:Zn +Fe 2+===Fe +Zn 2+。
(2)还原性①向FeCl 2溶液中滴入几滴KSCN 溶液,再加入氯水(或通入Cl 2),若溶液变红色,证明Fe 2+具有还原性。
反应原理:2Fe 2++Cl 2===2Fe 3++2Cl -。
②向少量酸性KMnO 4溶液中加入FeCl 2溶液,若溶液紫红色褪去,证明Fe 2+具有还原性。
反应原理:MnO -4+5Fe 2++8H +===5Fe 3++Mn 2++4H 2O 。
2.铁盐(1)氧化性:含Fe 3+的溶液呈黄色,Fe 3+具有较强的氧化性。
①向FeCl 3溶液中滴入几滴KSCN 溶液,再加入过量活泼金属(如Fe),若溶液红色褪去,证明Fe 3+具有氧化性。
反应原理:2Fe 3++Fe===3Fe 2+。
②向FeCl 3溶液中加入淀粉KI 溶液,若溶液变成蓝色,证明Fe 3+具有氧化性。
反应原理:2Fe 3++2I -===I 2+2Fe 2+。
③向FeCl 3溶液中通入H 2S 气体,若出现黄色浑浊,证明Fe 3+具有氧化性。
反应原理:2Fe 3++H 2S===2Fe 2++S ↓+2H +。
(2)特性:含有Fe 3+的盐溶液遇到 KSCN 时变成红色。
(3)FeCl 3易水解:将其饱和溶液滴入沸水中制备胶体的化学方程式为 FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
3.Fe 2+、Fe 3+的相互转化 Fe 2+强氧化剂如①Br 2还原剂如②Fe Fe 3+上述转化中标号反应的离子方程式为①2Fe 2++Br 2===2Fe 3++2Br -;②2Fe 3++Fe===3Fe 2+。
二、明晰Fe 2+、Fe 3+的检验方法1.Fe 2+的检验(1)样品溶液――→滴加KSCN 溶液无现象――→滴加氯水或双氧水溶液变红色,证明含有Fe 2+(2)样品溶液――→加入氢氧化钠溶液产生白色絮状沉淀,迅速变成灰绿色,最终变为红褐色,证明有Fe 2+(3)样品溶液――→加入K 3[Fe (CN )6]溶液生成蓝色沉淀,证明有Fe 2+2.Fe 3+的检验(1)样品溶液――→滴加KSCN 溶液溶液变红色,证明含有Fe 3+(2)样品溶液――→加入氢氧化钠溶液产生红褐色沉淀,证明有Fe 3+存在3.混合溶液中Fe 3+、Fe 2+的检验(1)Fe 3+的检验①混合溶液――→滴加KSCN 溶液溶液变红色,说明含有Fe 3+②混合溶液――→淀粉/KI 试纸试纸变蓝色,说明含有Fe 3+(2)Fe 2+的检验①混合溶液――→滴加酸性KMnO 4溶液酸性KMnO 4溶液紫红色褪去,说明含有Fe 2+②混合溶液――→滴加溴水溴水褪色,说明含有Fe 2+③混合溶液――→滴加K 3[Fe (CN )6]溶液生成蓝色沉淀,说明含有Fe 2+三、“铁三角”的转化1.“铁三角”转化关系2.具体应用(1)判断离子能否共存 Fe 2+不共存 NO -3(H +)、ClO -、MnO -4(H +)。
Fe 3+不共存S 2-、I -、SO 2-3。
Fe 2+、Fe 3+不共存HCO -3、CO 2-3等水解相互促进的离子。
(2)盐溶液的配制与保存(3)物质的制备考点一铁及其重要化合物一、铁的存在与性质1.判断正误(正确的打“√”,错误的打“×”)。
(1)铁具有导电、导热、延展性及被磁体吸引的特性(√)(2)纯铁与O2反应在表面生成Fe3O4薄膜,对内部金属起保护作用(√)(3)用铁制容器可以运输浓硝酸和浓硫酸(√)(4)Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应(×)(5)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2(×)(6)根据Cl2、S与铁的反应可以判断氯元素和硫元素的非金属性强弱(√)二、铁的氧化物与氢氧化物2.将下列物质的颜色和用途或性质用短线连接起来。
①Fe2O3a.红褐色A.具有较强的还原性②Fe(OH)2 b.红棕色B.易被氧化成灰绿色最终变成红褐色③Fe(OH)3c.白色C.红色油漆、涂料④Fe2+d.棕黄色D.受热分解成红棕色粉末⑤Fe3+e.浅绿色E.具有较强的氧化性答案:①—b—C;②—c—B;③—a—D;④—e—A;⑤—d—E考点二铁盐和亚铁盐一、掌握亚铁盐、铁盐的化学性质3.除去括号中的杂质,并写出反应的离子方程式。
(1)FeCl2(Fe3+)除去方法:____________,离子方程式:___________________________。
(2)FeCl3(FeCl2)除去方法:______________离子方程式:__________________________。
(3)Fe2(SO4)3(FeSO4)除去方法:____________,离子方程式:_________________________。
(4)FeCl2(Cu2+)除去方法:______________,离子方程式:_____________________________。
答案:(1)加入过量铁粉,过滤2Fe3++Fe===3Fe2+(2)加入氯水或通入Cl22Fe2++Cl2===2Fe3++2Cl-(3)滴加H2O22Fe2++H2O2+2H+===2Fe3++2H2O(4)加入过量铁粉,过滤Fe+Cu2+===Cu+Fe2+二、明晰Fe2+、Fe3+的检验方法4.判断正误(正确的打“√”,错误的打“×”)。
(1)检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN 溶液,观察实验现象()(2)向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色,则溶液中一定含有Fe2+()(3)检验Fe(NO3)2晶体是否氧化变质的方法是将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN 溶液,观察溶液是否变红()(4)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+()解析:检验Fe2+时,先加入氯水,会将溶液中的Fe2+氧化成Fe3+而无法用KSCN溶液检验,应先加入KSCN 溶液,再加入氯水,(1)、(2)错误,(4)正确;(3)中由于Fe(NO 3)2溶液中含有NO -3,加入稀H 2SO 4后,NO -3(H +)会将Fe 2+氧化成Fe 3+。
故不能用KSCN 溶液检验Fe 3+而判断Fe(NO 3)2是否变质。
答案:(1)× (2)× (3)× (4)√ 题型(一) 铁及其化合物的性质【诊断1】判断正误(正确的打“√”,错误的打“×”)。
(1)(2016·全国乙卷)1 mol Fe 溶于过量硝酸,电子转移数为2N A (×)(2)(2016·四川高考)常温下,将铁片浸入足量浓硫酸中,铁片不溶解,说明常温下,铁与浓硫酸不发生化学反应(×)(3)(2016·海南高考)将铁屑放入稀HNO 3中,证明Fe 比H 2活泼(×)(4)(2016·上海高考)用NaOH 溶液可以除去氧化铁中混有的二氧化硅(√)(5)(2016·上海高考)Fe 与Cl 2反应生成FeCl 3,推测Fe 与I 2反应生成FeI 3(×)(6)(2015·全国卷Ⅱ)下列过程没有发生化学反应:用含硅胶、铁粉的透气小袋与食品一起密封包装(×)(7)(2015·江苏高考)如下所示的物质间转化能一步实现:Fe 2O 3――→盐酸FeCl 3(aq)――→蒸发无水FeCl 3(×)(8)(2015·广东高考)3 mol 单质Fe 完全转化为Fe 3O 4,失去8N A 个电子(√)(9)(2014·北京高考)铁表面自然形成的氧化层能保护内层不被空气氧化(×) (10)(2015·重庆高考)使用如图所示装置观察Fe(OH)2的生成(√) 题型(二) 氢氧化亚铁的制备【诊断2】(1)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是________。
(2)用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe 3+的FeSO 4溶液与用不含O 2的蒸馏水配制的NaOH 溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO 4溶液时还需加入________。
②除去蒸馏水中溶解的O 2常采用________的方法。
③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O 2的NaOH 溶液,插入FeSO 4溶液液面下,再挤出NaOH 溶液。
这样操作的理由是________________________________。
解析:(1)因为Fe(OH)2在空气中容易被氧化为红褐色的Fe(OH)3,因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。