实验二 细胞核与线粒体的分离与观察
- 格式:doc
- 大小:38.50 KB
- 文档页数:5


细胞生物学实验指导编者梁亦龙张继承生物信息学院2004年9月前言细胞是一切生物(包括人类)最基本的结构和功能单位。
生命科学中的各个学科领域,甚至非生命科学的许多学科领域中的学者们,越来越多地投入到对细胞生命现象的研究。
细胞是生命的载体,不理解细胞就不理解生命。
在现代生命科学教学中,不设置细胞生物学课,所培养出来的学生就称不上是完全的生命科学家。
在细胞生物学放学中,实验课不可或缺。
实验课的基本任务是,让学生学习细胞生物学基本技术,使他们具有一定的实验操作技能,并培养他们树立独立设计实验的思考观念和进行科研的基本素质。
我们借鉴兄弟院校的经验编写了这本《细胞生物学实验指导》•,供我院开设的各专业选用。
由于我们主客观条件所限,而且编写时间仓促,肯定会有不少缺点和错误,请提出批评意见,帮助我们不断改进教学。
编者梁亦龙2004年9月目录实验是规则与操作要求 (1)实验一细胞形态及大小的观测 (2)实验二相差和暗视野显微镜的原理、使用及标本观察 (5)实验三荧光显微镜原理及应用 (9)实验四电镜参观 (12)实验五植物细胞骨架的显示及光镜观察 (14)实验六人淋巴细胞染色体标本制作 (15)实验七人淋巴细胞姐妹染色体区分染色 (17)实验八碱性磷酸酶的显示 (19)实验九叶绿体的制备及其对染料的还原 (22)实验十人体细胞核型图的制作 (24)实验十一线粒体的分离及活性测定 (27)实验十二联会复合体的染色与观察 (32)实验十三细胞融合 (33)实验十四死、活细胞鉴别 (39)实验十五细胞固定染色法 (41)实验十六早熟染色体凝集(PCC) (43)实验十七细胞同步化 (46)实验十八动物染色体分带技术 (48)实验十九线粒体的显示 (50)实验二十植物愈伤组织培养以及再分化 (52)实验二十一肿瘤细胞培养实验步骤 (57)实验二十二细胞器的分离 (62)实验二十三石蜡切片的制作 (66)实验室规则与操作要求为获得较好的实验结果,避免发生差错与意外事故,特制定以下规则与要求,希望实验者能严格遵守。


实验二细胞核,叶绿体,线粒体的分级分离与观察一、实验目的:1、了解细胞器分离的一般原理和方法;2、掌握分级分离的原理和注意事项;3、观察叶绿体的自发荧光和次生荧光.4、线粒体的分离方法以及詹纳斯绿B超活染色的方法.二、实验原理:将组织匀浆后悬浮在等渗介质中进行差速离心,是分离细胞器的常用方法.细胞组分的分离在等渗溶液〔0.35mol/L Nacl或0.4mol/L蔗糖溶液〕中进行.●将匀浆液在1000r/min的条件下离心2 min以全除组织残渣和未破碎的细胞.●在3000r/min的条件下离心5 min,即可获得沉淀的叶绿体〔混有部分细胞核〕.●上清液在高速冷冻条件下10000rpm/min分离10分钟,所得沉淀即为线粒体,可反复离心一次.三、实验步骤:第一部分细胞核与叶绿体的分离与观察1、选取新鲜的菠菜叶,洗净搽干后去除叶梗和粗脉,称30g于150ml0.35mol/L Nacl溶液中,放入组织捣碎机<间歇>;低速匀浆1min;间歇匀浆.2、将匀浆用6层纱布过滤于烧杯中.3、每小组取滤液4 ml在1000r/min的条件下离心2 min;4、取上清液在3000r/min的条件下离心5 min;沉淀即为叶绿体〔混有部分细胞核〕;上清夜转入干净的离心管中用于线粒体分离.5、叶绿体观察:➢将沉淀用0.35mol/L Nacl悬浮.〔浓度不要太高,不利于观察〕➢取叶绿体悬液一滴于载玻片上,加盖玻片即可在普通光学显微镜和荧光显微镜下观察;➢取叶绿体悬液一滴于载玻片上,再滴加一滴0.01%吖啶橙染料,加盖玻片即可在荧光显微镜下观察.第二部分线粒体的分级分离以及超活染色观察6 第4步获得的上清液在高速冷冻条件下10000rpm/min分离10分钟,所得沉淀即为线粒体,可反复离心一次.收集沉淀涂片,用1%詹纳斯绿B染色5-10分钟,线粒体为蓝绿色圆形颗粒.实验过程最好在0-4o C的条件下进行;如果在室温下,要迅速分离和观察.〔教师演示示X〕第三部分人口腔黏膜上皮细胞线粒体的超活染色与观察一、实验目的:观察活细胞内线粒体的形态、数量与分布.二、实验原理:线粒体是细胞进行呼吸作用的场所,其形态和数量随不同物种、不同组织器官和不同生理状态而发生改变.詹纳斯绿B是一种毒性较小的碱性染料,可专一性的对线粒体进行超活染色,这是由于线粒体内的细胞色素氧化酶系的作用,使染料始终保持氧化状态〔即有色状态〕,呈蓝绿色;而线粒体周围的细胞质中,这些染料被还原为无色的色基〔即无色状态〕.三、实验步骤:1、取清洁载玻片,滴2滴1/5000詹纳斯绿B染液;2、用牙签宽头在口腔颊黏膜处稍用力刮取上皮细胞,将刮下的黏液状物放入载玻片的染液中,染色10-15 min;〔作用,染液不可干燥,必要时加滴染液〕;3、盖上盖玻片,置显微镜下观察.四、实验结果:在低倍镜下,选择平展的口腔上皮细胞,换高倍镜观察,可见扁平状上皮细胞内,核周围的胞质中,分布着一些被染成蓝绿色的颗粒状或短棒状的结构,即为线粒体.实验作业:3 绘口腔上皮细胞示线粒体形态与分布.。



实验一叶绿体的分离与荧光观察1.实验目的了解叶绿体分离的一般原理和方法,并熟悉应用荧光显微镜方法观察叶绿体荧光现象。
2.实验原理叶绿体是植物细胞中较大的一种细胞器,能发生特有的能量转换。
利用低速离心机可以分离叶绿体,其分离在等渗溶液(0.35mol/L氯化钠或0.4mol/L蔗糖溶液)中进行,目的是为了防止渗透压的改变引起叶绿体的损伤。
将匀浆液在1000r/min离心,去除其中的组织残渣和一些未被破碎的完整细胞,然后,3000r/min 离心,可获得沉淀的叶绿体(混有部分细胞核)。
在室温下进行分离要迅速。
某些物质在一定短波长的光(如紫外光)的照射下吸收光能进入激发态,从激发态回到基态时,就能在极短的时间内放射出比照射光波长更长的光(如可见光),这种光就称为荧光。
若停止供能,荧光现象立即停止。
有些生物体内的物质受激发光照射后,可直接发出荧光(称为自发荧光),如叶绿素的火红色荧光。
有的生物材料本身不发荧光,但它吸收荧光染料后同样也能发出荧光(称为间接荧光),如叶绿体吸附吖啶橙后可发橘红色荧光本实验利用荧光显微镜对发荧光的叶绿体进行观察。
3.实验材料、用品⑴实验材料:菠菜叶片⑵实验药品:蒸馏水,0.35mol/L氯化钠溶液,0.01%吖啶橙。
⑶实验仪器:普通离心机,组织捣碎机,天平,荧光显微镜,显微镜,载玻片,盖玻片,镊子,接种针,目镜测微尺,物镜测微尺,恒温箱,培养皿,滤纸,试管,试管架,移液管,滴管,烧杯,无荧光载片,盖玻片,离心管。
4.实验步骤⑴选取新鲜的菠菜嫩叶,洗擦干后去除叶梗及粗脉,称3g于0.35mol/L氯化钠溶液15ml中置组织捣碎机或研钵中。
⑵利用组织捣碎机低速(5000r/min)匀浆,3~5min,或研磨成匀浆。
⑶用6层纱布过滤,滤液盛于烧杯中。
⑷取滤液4ml在1000r/min下离心2min,弃去沉淀。
⑸将上清液在3000r/min下离心5min,弃去上清液,沉淀即为叶绿体(混有部分细胞核)。

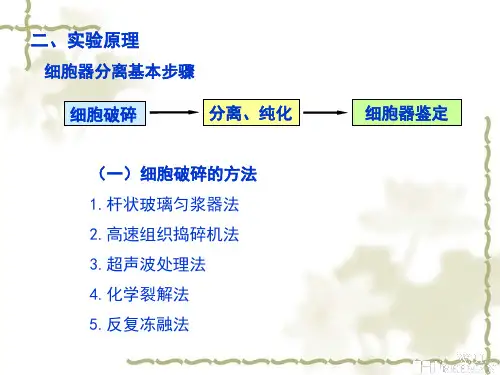


细胞生物学实验教案实验一细胞核与线粒体的分级分离一、实验目的了解差速离心法分离细胞器的原理,以及练习使用差速离心法分离哺乳动物的细胞核与线粒体。
二、实验原理细胞内不同结构的比重和大小都不相同,在同一离心场内的沉降速度也不相同,根据这一原理,常用不同转速的离心法,将细胞内各种组分分级分离出来。
分离细胞器最常用的方法是将组织制成匀浆,在均匀的悬浮介质中用差速离心法进行分离,其过程包括组织细胞匀浆、分级分离和分析三步,这种方法已成为研究亚细胞成分的化学组成、理化特性及其功能的主要手段。
匀浆(Homogenization)低温条件下,将组织放在匀浆器中,加入等渗匀浆介质(即0.25mol/L蔗糖一0.003mol/L氯化钙)进行破碎细胞使之成为各种细胞器及其包含物的匀浆。
分级分离(Fractionation)由低速到高速离心逐渐沉降。
先用低速使较大的颗粒沉淀,再用较高的转速,将浮在上清液中的颗粒沉淀下来,从而使各种细胞结构,如细胞核、线粒体等得以分离。
由于样品中各种大小和密度不同的颗粒在离心开始时均匀分布在整个离心管中,所以每级离心得到的第一次沈淀必然不是纯的最重的颗粒,须经反复悬浮和离心加以纯化。
分析分级分离得到的组分,可用细胞化学和生化方法进行形态和功能鉴定。
三、细胞核的分离提取(一)操作步骤1.用颈椎脱位的方法处死小白鼠后,迅速剖开腹部取出肝脏,剪成小块(去除结缔组织)尽快置于盛有0.9%NaCl的烧杯中,反复洗涤,尽量除去血污,用滤纸吸去表面的液体。
2.将湿重约1g的肝组织放在小平皿中,用量筒量取8ml预冷的0.25mol/L蔗糖一0.003mol/L氯化钙溶液,先加少量该溶液于平皿中,尽量剪碎肝组织后,再全部加入。
3.剪碎的肝组织倒入匀浆管中,使匀浆器下端浸入盛有冰块的器皿中,左手持之,右手将匀浆捣杆垂直插入管中,上下转动研磨3~5次,用3层纱布过滤匀浆液于离心管中,然后制备一张涂片①,做好标记,自然干燥。
细胞组分分级分离实验目的分级分离细胞核和线粒体实验原理1.相关概念细胞组分分级分离:依据细胞内各种结构的比重和大小不同,在同一离心场内的沉降速度也不同的原理,采用差速离心法或密度梯度离心法,将细胞各种组分分离出来。
常用分离方法:差速离⼼法——不同转速;密度梯度离⼼法——不同浓度的介质2.分离方法(1)差速离⼼法特点:介质密度均⼀;离⼼⼒由低向⾼;逐级离⼼(差速)。
⽤途:初步分离;分离⼤⼩相差悬殊的细胞组分。
细胞器沉降顺序:细胞核→线粒体→溶酶体、过氧化物酶体→内质网、⾼尔基体→核糖体(2)密度梯度离⼼法特点:介质密度不均⼀;呈现密度梯度;离心力相同(等速,超速)⽤途:纯化分离细胞器等颗粒组分待分离颗粒沉降顺序:各待分离颗粒的沉降与其密度相等或相近的梯度柱范围常⽤介质及要求:蔗糖、⽢油、氯化銫;能产⽣密度梯度,且密度⾼时,粘度不⾼;PH中性或易调为中性;浓度⼤时渗透压不⼤;对细胞⽆毒3.染色方法甲基绿-哌罗宁染色:核酸呈酸性,与碱性染料甲基绿-哌罗宁染液具有亲和力,这两种碱性染料有选择的特异性染色,甲基绿把DNA染成绿色,哌罗宁把RNA染成红色。
詹纳斯绿B染色:詹纳斯绿B可专一性地对线粒体进行超活染(体外活染),这是由于线粒体内的细胞色素氧化酶系的作用,使詹纳斯绿B染料始终保持氧化状态(即有色状态)呈蓝绿色;而线粒体周围的细胞质中詹纳斯绿B则被还原成无色的化合物。
实验设计思路实验结果分散相的线粒体被染成浅蓝色,呈圆形或椭圆形颗粒。
如果线粒体聚集成堆则被染成深蓝色,难以辨认。
注意事项1.过滤前要先将纱布湿润2.匀浆缓冲液预冷(0℃—4℃)3.冰浴上研磨,匀浆搗杆垂直插入匀浆管中,上下转动研磨3-5次,尽可能充分破碎细胞(适度研磨),缩短匀浆时间。
4.离心机温度应设为4℃5.整个分离过程不宜过长,要尽快。
6.得到的沉淀物须加预冷蔗糖缓冲液将其悬浮后再涂片,制线粒体滴片时,悬浮液只需一小滴,量太多线粒体易聚集成堆,不便观察。
实验二线粒体差速离心法分离技术细胞内不同结构的比重和大小都不相同,在同一离心场内的沉降速度也不相同,根据这一原理,常用不同转速的离心方法,可将细胞内各种组分分级分离出来。
分离细胞器最常用的方法是将组织制成匀浆,在均匀的悬浮介质中用差速离心法进行分离,其过程包括组织细胞匀浆、分级分离和分析三步,这种方法已成为研究亚细胞成分的化学组成、理化特性及其功能的主要手段。
匀浆(Homogenization)是在低温条件下,将组织放在匀浆器中,加入等渗匀浆介质(即0.25mol/L蔗糖-0.003mol/L氯化钙)进行破碎细胞使之成为各种细胞器及其包含物的匀浆。
线粒体是细胞中重要的细胞器,存在于绝大多数生活细胞中,它的主要功能是提供细胞内各种物质代谢所需要的能量。
正由于这样,对线粒体膜,呼吸链酶及线粒体DNA等成分的结构,功能以及物理化学性质的研究已经成为细胞生物学研究中的重要课题,所以提取线粒体的技术已经成为线粒体研究中必不可少的手段,线粒体大量存在于代谢旺盛的细胞中,如动物的心肌,肝,肾等器官和组织的细胞中,大量置备线粒体就是从这些器官组织中提取。
[实验要求]1.了解并掌握差速离心法分离技术及原理。
2.熟悉线粒体的Janus green B染色方法,并做出分析。
[实验原理]差速分离由低速到高速离心使细胞内各种组分逐渐沉降。
先用低速离心使较大的颗粒沉淀,再用较高的转速将浮在上清液中的颗粒沉淀下来,从而使各种细胞结构,如细胞核、线粒体等得以分离。
由于样品中各种大小和密度不同的颗粒在离心开始时均匀分布在整个离心管中,所以每级离心得到的第一次沉淀必然不是纯的最重的颗粒,须经反复悬浮和离心才能不断纯化。
詹纳斯绿(Janus green B)是对线粒体专一的活细胞染料,具有脂溶性,能跨过细胞膜。
詹纳斯绿解离后带有染色能力的基团带正电,结合在负电性的线粒体内膜上。
内膜的细胞色素氧化酶使染料保持氧化状态,呈现蓝绿色。
詹纳斯绿B也可对活细胞进行染色,在显微镜下可观察到细胞内的线粒体因具有细胞色素氧化酶系统,它可使染料始终处于氧化状态呈蓝绿色,而在细胞质中的染料被还原呈无色。
实验3 细胞核的制备、鉴定原理为研究细胞核及其组成成分,如:染色质、DNA及核内小分子RNA等,需分离制备细胞核。
对于所分离的细胞核,要求保持形态上的完整性,核内成分不渗漏,不污染细胞质等其他细胞器,并且能有较高的得率。
根据实验的需要可以选择不同的分离细胞核的方法,通常用来分离细胞核的方法主要有二大类:第一大类有机溶剂的方法,经Allfrey改进的方法,主要包括如下操作过程:(1)将组织冷冻干燥;(2)研碎细胞;(3)利用不同比重有机溶剂使细胞核与细胞质其他成分分开。
这类方法可以防止细胞核内水溶性的成分丢失,同时也能阻止细胞质的某些成分渗入细胞核内。
虽然有这些优点,但这种方法不能保持细胞核的正常形态,某些酶活力可能因变性而丧失。
所以一般采用非水溶剂分离细胞核,常用于定量分析细胞核的生化成分及其他一些特殊的研究目的。
第二大类,1956年由Chauveau等人提出,用高密度介质来分离细胞核。
由于细胞核的比重较大,在高密度介质中,在高速离心条件下被沉降下来,从而达到细胞核与细胞质其他成分分开的目的。
Chauveau的方法是将动物肝脏直接在2.2mol/L蔗糖溶液中匀浆,然后高速离心40 000g 1小时,细胞核沉淀在底部,线粒体和完整细胞,包括红血球漂浮在液面,通过一步操作好可分离得到细胞核。
其后又有不少研究工作者对此方法作了改进,例如加进氯化钙、氯化镁、氯化钾等,改变分离介质的渗透压;选择介质的pH以及不同的高密度蔗糖溶液离心方法等。
这样减少了细胞核的脆性,防止聚集,维持恒定的pH,就能保持细胞核的精细结构。
虽然这一方法比较简单,能得到较高纯度的细胞核,也已被广泛采用,但是实验需要高速离心机,这在一般实验室不能进行,另外此方法要用高浓度的蔗糖,如果要分离大量的细胞核,也很不经济。
目前在一般实验室中更多的是用柠檬酸分离细胞核,在柠檬酸介质中分离细胞核可以显蓍地除去附着在细胞核膜上的细胞质成分。
由于柠檬酸降低了溶液pH,这样可以减少细胞核的破碎率,并能分离得到较高分子量的核酸,可能是由于核糖核酸酶(一种酸溶性蛋白)被柠檬酸除去,以及二价阳离子被柠檬酸络合所致。
实验二细胞核与线粒体的分离与观察
一、实验目的
1.了解差速离心法分离细胞核与线粒体的原理。
2.掌握差速离心法分离动物与植物细胞的细胞核与线粒体的方法。
二、实验原理
细胞核(nucleus)是细胞中重要的细胞器,细胞的控制中心,在细胞的代谢、生长、分化中起着重要作用,是遗传物质的主要存在部位。
线粒体(mitochondria)是真核细胞特有的能量转换的重要细胞器,是细胞进行有氧呼吸的主要场所。
细胞中的能源物质—脂肪、糖、部分氨基酸在此进行最终的氧化,并通过偶联磷酸化生成ATP,供给细胞生理活动需要。
对细胞核和线粒体结构与功能的研究通常是在离体进行的,因而分离细胞核和线粒体是必须的。
差速离心主要是采取逐渐提高离心速度的方法分离不同大小的细胞器。
采用组织匀浆在悬浮介质中进行差速离心分离细胞核和线粒体。
在确定的离心场中,球形颗粒的沉降速度取决于它的密度、半径和悬浮介质的黏度。
在一均匀悬浮介质中离心一定时间内,组织匀浆中的各种细胞器及其它内含物由于沉降速度不同将停留在高低不同的位置。
依次增加离心力和离心时间,就能够使这些颗粒按其大小、轻重分批沉降在离心管底部,从而分批收集。
细胞器中最先沉淀的是细胞核,其次是线粒体,其它更轻的细胞器和大分子可依次再分离。
缓冲的蔗糖溶液是常用的悬浮介质,它属于等渗溶液,比较接近细胞质的分散相,在一定程度上能保持细胞器的结构和酶的活性,在pH7.2的条件下,亚细胞组分不容易重新聚集,有利于分离。
整个操作过程应注意使样品保持4℃,避免酶失活。
线粒体的鉴定用詹纳斯绿B(Janus green B)活染法,对线粒体专一的活细胞染料,毒性很小,线粒体的细胞色素氧化酶使该染料保持在氧化状态呈现蓝绿色从而使线粒体显色,而胞质中染料被还原成无色。
从植物细胞分离线粒体除了作线粒体功能测定外,在植物细胞遗传工程中,常用于分离核外基因——线粒体DNA等目的。
分离线粒体的方法仍采用均匀介质中的差速离心。
介质中0.25mol/L蔗糖也可以用0.3mol/L甘露醇代替。
EDTA螯合二价阳离子,Ca2+除去后细胞间粘着解体,促使组织分散成单个细胞。
牛血清白蛋白(BSA)能包在细胞外面,并作为
竞争性底物削弱蛋白酶的作用。
三、实验仪器、材料和试剂
1.材料
大白鼠肝脏、玉米黄化幼苗(水稻、高粱等幼苗均可)。
2.试剂
动物细胞
(1)0.9 % 生理盐水
(2)0.02 % 詹纳斯绿B染液(用生理盐水配制)
(3)0.25 mol/L 蔗糖+0.01 mol/L Tris-盐酸缓冲液(pH7.4):0.1 mol/L 三羟甲基氨甲烷10 ml,0.1 mol/L 盐酸8.4 ml,加双蒸水到100 ml,加蔗糖到0.25 mol/L。
蔗糖为密度梯度离心用D(+)蔗糖
(4)0.34 mol/L 蔗糖+0.01 mol/L Tris-盐酸缓冲液(pH7.4)
(5)固定液:甲醇︰冰醋酸(9︰1)
(6)姬姆萨染液:Giemsa 粉0.5 g,甘油33 ml,纯甲醇33 ml。
先往Giemsa 粉中加入少量甘油在研钵内研磨至无颗粒,再将剩余甘油倒入混匀,56℃左右保温2 h 令其充分溶解,最后加甲醇混匀,成为姬姆萨原液,保存于棕色瓶。
用时吸出秒量用0.067 mol/L 磷酸盐缓冲液作10~20倍稀释。
0.067 mol/L 磷酸盐缓冲液(pH6.8):
0.067 mol/L KH2PO450ml
0.067 mol/L Na2HPO450ml
(7)1 % 甲苯胺蓝溶液
植物细胞
(1)分离介质:0.25mol/L蔗糖、50mmol/L的Tris-盐酸缓冲液(pH 7.4),3mmol/LEDTA,0.75mg/ml牛血清白蛋白(BSA)。
50mmol/L的Tris-Hcl缓冲液(pH7.4)配法:50ml0.1mol/L三羟甲基氨基甲烷(Tris)溶液与42ml0.1mol/L盐酸混匀后,加水稀释至100ml。
(2)保存液:0.3mol/L甘露醇(pH 7.4)
(3)20%次氯酸钠(NaClO)溶液。
(4)1%詹纳斯绿B染液,用生理盐水配制。
3.器材。