七年级科学物质的构成
- 格式:ppt
- 大小:2.87 MB
- 文档页数:5

第六章物质的结构【概念和规律】一、物质由微粒构成1、无论生物还是非生物,都是由分子、原子或离子构成。
2、对于由分子构成的物质来说,分子是保持物质的化学性质的最小微粒。
3、不同分子构成不同的物质。
4、在化学反应中,分子可以分解成原子。
5、有的分子由一个原子构成(稀有气体),有的分子由多个相同或不同的原子构成。
6、金属直接由原子构成。
7、1803年英国化学家道尔顿提出了原子论,1811年意大利化学家阿伏伽德罗提出了分子假说,1897年英国物理学家汤姆生发现了电子。
8、在一定条件下,原子可以失去或得到电子,成为带电荷的离子。
9、有的物质由离子构成,如氯化钠。
10、卢瑟福根据α粒子散射实验提出的原子有核模型认为:原子由带正电的原子核和带负电的核外电子构成。
11、现代研究表明:原子核由带正电的质子和不带电的中子构成。
而且它们由更小的微粒夸克构成。
12、原子核中的质子数和核外的电子数相等,所以整个原子不带电。
13、实验表明:构成物质的微粒之间存在着空隙和相互作用,并处在永不停息的运动之中,而且微粒之间存在着相互作用的引力和斥力。
二、元素1、把物质中的同一种原子统称为元素。
元素:具有相同核电荷数(即质子数)的一类原子的总称。
2、自然界中的所有物质都是由元素组成。
3、每种元素都有一个名称和符号,符号通常用拉丁文名称的第一个大写字母表示,若有重复,增加第二个小写字母。
4、目前人类发现的元素有112种,其中94种为天然元素,18种为人工合成元素。
5、元素的分布不均匀①宇宙中氢元素最丰富,其次是氦元素;②地壳中的元素含量依次为:氧元素、硅元素、铝元素;③地核中的元素含量依次为:铁元素、镍元素;④空气中的元素含量依次为:氮元素、氧元素。
678、在非金属元素中He、Ne、Ar、Kr、Xe、Rn称为稀有气体元素。
539、由不同种元素组成的纯净物叫做化合物。
10、单质和化合物都有确定的组成,并可以用元素符号表示。
11、由同种单质或同种化合物组成的物质叫做纯净物。


七年级上册科学第一单元科学第一单元:物质的组成与分类一、引言物质是构成宇宙的基本要素,它的组成和分类是科学研究的重要内容。
本文将从物质的基本概念出发,介绍物质的组成和分类,并探讨其在日常生活和科学研究中的应用。
二、物质的基本概念物质是世界的基本构成要素,包括固体、液体和气体。
固体是指具有一定形状和体积的物质,如铁、石头等;液体是指具有一定体积但没有固定形状的物质,如水、酒精等;气体是指没有固定形状和体积的物质,如空气、氧气等。
三、物质的组成物质由原子和分子组成。
原子是物质的最小单位,具有质量和电荷;分子是原子的结合体,是具有化学性质的物质基本单位。
1. 原子的结构原子由原子核和电子构成。
原子核由质子和中子组成,质子带正电荷,中子无电荷。
电子绕着原子核运动,带负电荷。
2. 原子的元素符号和原子序数每个元素都有一个唯一的符号,用于表示化学元素。
符号的第一个字母必须大写,第二个字母必须小写。
例如,氢元素的符号为H,氧元素的符号为O。
原子序数是指元素中原子的数量,也称为元素的序数。
元素表中的元素按照原子序数从小到大排列。
3. 分子的结构分子是由两个或多个原子结合而成。
化学式用来表示分子的成分和数量。
例如,水分子的化学式为H2O,其中H表示氢原子,O表示氧原子。
氧气分子的化学式为O2,表示两个氧原子结合而成的分子。
四、物质的分类物质可以根据其组成和性质进行分类。
常见的分类方式有元素和化合物、混合物等。
1. 元素和化合物元素是由同种原子组成的物质,如金属铁、非金属氧等。
化合物是由两个或多个不同种类的原子结合而成的物质,如水、氨等。
2. 混合物混合物是由两种或多种物质混合而成的物质,每种物质保持自身的性质,如空气、土壤等。
混合物可以分为均相混合物和异相混合物。
均相混合物指组成物质均匀分散,如盐水、糖水等;异相混合物指组成物质不均匀分散,如沙水、油水等。
五、物质的应用物质的组成和分类对我们的日常生活和科学研究具有重要影响。


浙教版七年级上科学《物质构成》优秀精品教案一、教学内容本节课,我们将在浙教版七年级上科学第三章《物质构成》中,深入学习物质基本粒子——分子、原子和离子。
详细内容涉及3.1节“分子和原子”,3.2节“物质组成和分类”。
二、教学目标1. 知识与技能:使学生理解分子、原子、离子概念,掌握物质组成和分类。
2. 过程与方法:培养学生运用观察、实验、推理等科学方法,探索物质构成规律。
3. 情感态度价值观:激发学生对科学知识探究兴趣,提高学生科学素养。
三、教学难点与重点1. 教学难点:分子、原子、离子概念区分与理解。
2. 教学重点:物质组成和分类。
四、教具与学具准备1. 教具:分子模型、原子模型、离子模型、实验器材等。
2. 学具:学生分组实验材料,包括酒精、水、食盐等。
五、教学过程1. 实践情景引入:通过展示生活中常见物质变化,如冰融化、酒精挥发等,引发学生对物质构成思考。
步骤1:提问学生:“同学们,你们知道这些现象背后原因?”步骤2:引导学生观察分子模型,理解分子在物质变化中作用。
2. 例题讲解:以水为例,讲解分子、原子、离子概念及其相互关系。
步骤1:讲解水分子构成,引导学生理解分子是由原子组成。
步骤2:讲解水分子在电解过程中氢离子和氧离子过程,使学生理解离子是由原子或分子失去或获得电子形成。
3. 随堂练习:让学生分组实验,观察酒精与水混合、食盐在水中溶解等现象,分析分子、原子、离子作用。
步骤1:学生分组实验,观察现象。
步骤2:学生汇报实验结果,教师点评并讲解。
六、板书设计1. 物质构成分子原子离子2. 物质组成和分类物质由分子、原子、离子组成物质分类:纯净物、混合物七、作业设计1. 作业题目:(1)简述分子、原子、离子概念。
(2)举例说明物质组成和分类。
(3)结合生活实际,说明分子、原子、离子在物质变化中作用。
2. 答案:(2)物质由分子、原子、离子组成。
纯净物是由同种分子、原子或离子组成物质,混合物是由不同种分子、原子或离子组成物质。

浙教版七年级上科学《物质的构成》优秀教案一、教学内容本节课选自浙教版七年级上科学教材第三章第一节《物质的构成》。
教学内容主要包括:物质由微观粒子组成,分子、原子、离子的基本概念,以及它们在物质性质和变化中的作用。
二、教学目标1. 知识与技能:使学生了解物质的基本微观粒子,掌握分子、原子、离子的概念及其相互关系。
2. 过程与方法:培养学生通过观察、实验、分析等方法,探索物质微观结构的能力。
3. 情感态度与价值观:激发学生对科学研究的兴趣,培养学生尊重事实、严谨求实的科学态度。
三、教学难点与重点重点:物质的基本微观粒子,分子、原子、离子的概念及其相互关系。
难点:理解分子、原子、离子之间的区别和联系,以及它们在物质性质和变化中的作用。
四、教具与学具准备1. 教具:多媒体课件、实验器材(如酒精、水、食盐等)。
2. 学具:笔记本、铅笔、实验报告单。
五、教学过程1. 导入:通过展示日常生活中的物质变化现象,引发学生对物质构成的思考。
2. 新课导入:介绍分子、原子、离子的概念,并用多媒体课件展示相应的微观结构。
3. 实践情景引入:进行酒精与水的混合实验,引导学生观察实验现象,探讨分子之间的相互作用。
4. 例题讲解:讲解典型例题,分析物质微观结构对物质性质和变化的影响。
5. 随堂练习:设计相关习题,巩固学生对分子、原子、离子概念的理解。
6. 小组讨论:分组讨论分子、原子、离子在生活中的应用,培养学生的合作意识和表达能力。
六、板书设计1. 物质的构成分子原子离子2. 分子、原子、离子的相互关系3. 物质性质与微观结构的关系七、作业设计1. 作业题目:(1)列举生活中的三种物质,分析它们的微观结构。
(2)解释为什么酒精与水混合后总体积减小。
2. 答案:(1)略(2)酒精与水混合时,分子之间发生相互作用,使得总体积减小。
八、课后反思及拓展延伸1. 反思:本节课学生对分子、原子、离子的概念掌握情况,以及对实践情景引入和例题讲解的反馈。
体质量大小与物体所含物质的多少有关,物体所含物质越多,物体的质量就越大。
如一桶 10 升的煤油的质量比一桶量是物体本身的一种属性,与物体的形状、状态、温度和所处空间位置的变化等无关。
1、电子天平、磅秤等。
9平的使用步骤可归纳为"一放、二拨、三调、四测、五读、六收”于测微小物体(物体规格相同)的质量。
测量一枚大头针的质量时,可先测出多枚大头针的总质量,即得一枚大头针的质量。
用于测较大物体(规格一致)的质量。
测已知长度的铜线的质量,若铜线质量太大而无法直接用天平测量时,再根据总长度之比算出铜线的总质量密度还有一个常用单位——克每立方厘米度是物质的一种特性,它表示 “ 同种物质的质量和体积的比值是一定的 ” 这一特性每种物质的密度是确定不变的,它并不随物体的质量、体积的变化而变化。
比如:一滴水和一杯水的密度是一样的。
不同物质的密度一般不同,但密度相同的物质不一定是同种物质。
物质的密度受物态变化和温度的影响。
当物质在固态、液态和气态之间转换时,质量不变,体积会发生改变,从而引起密度的变化。
当温度变化时,虽然质量不受影响,但体积要发生变化(如热胀冷缩),从而引起密度的变化。
量固体的密度(以铁块为例)用天平测出铁块的质量,然后用细线栓好铁块将量筒内倒入适量水,读出此时水的体积将拴好的铁块慢慢放入盛有水的量筒,使铁块全部浸入水中,读出此时量筒中水和铁块的体积,减去原本量筒中水的体积,就可计算出铁块的体积根据公式计算铁块的密度量液体的密度(以盐水为例)用天平测出烧杯和盐水的总质量,然后倒入量筒中一部分用天平测出烧杯和剩余盐水的质量算出量筒中盐水的质量读出量筒中盐水的体积利用公式计算出盐水的密度体熔化条件温度达到熔点;同时不断从外界吸热。
两个条件缺一不可体凝固条件温度达到凝固点;同时不断向外界放热。
两个条件缺一不可气体液化的两种方式降低温度压缩体积所有气体,在温度降低到足够低的时候都可以液化有的气体单靠压缩体积不能使它液化,必须同时使它降低到一定温度,例如氮气。

2024年浙教版七年级上科学《物质的构成》优秀教案一、教学内容本节课选自2024年浙教版七年级上科学教材第四章《物质的构成》,内容包括:物质的微观结构,分子、原子、离子的概念,以及物质的性质与微观结构的关系。
二、教学目标1. 了解物质的微观结构,掌握分子、原子、离子的基本概念。
2. 理解物质的性质与微观结构之间的关系,能运用所学知识解释生活中的现象。
3. 培养学生的观察能力、动手能力和科学思维能力。
三、教学难点与重点教学难点:物质的微观结构及其性质关系。
教学重点:分子、原子、离子的概念及其应用。
四、教具与学具准备教具:显微镜、实物模型、PPT课件。
学具:笔记本、笔、实验器材。
五、教学过程1. 导入:通过展示一组宏观和微观的图片,引导学生思考物质内部的构成。
2. 新课导入:讲解分子、原子、离子的概念,让学生了解物质的微观结构。
3. 实践活动:分组进行实验,观察不同物质的微观结构,培养学生的观察能力。
4. 例题讲解:分析生活中常见的物质性质变化,解释其微观原理。
5. 随堂练习:布置相关练习题,巩固所学知识。
六、板书设计1. 物质的构成分子原子离子2. 物质性质与微观结构的关系七、作业设计1. 作业题目:(1)列举生活中常见的物质,描述其微观结构。
(2)解释下列现象的微观原理:水烧开时为什么会有气泡产生?(3)简述分子、原子、离子的区别与联系。
2. 答案:(1)略(2)水分子在加热过程中,运动速度加快,间隔变大,形成气泡。
(3)分子、原子、离子是构成物质的基本粒子,它们之间的区别在于粒子的大小、电荷和组合方式。
八、课后反思及拓展延伸1. 反思:本节课学生对物质的微观结构有了更深入的了解,但在解释生活现象时,部分学生还存在困难。
2. 拓展延伸:引导学生关注科学研究的新进展,了解更多关于物质微观结构的知识。
同时,鼓励学生进行家庭实验,观察生活中的物质变化,提高实践能力。
重点和难点解析1. 教学难点:物质的微观结构及其性质关系。

浙教版七年级上科学《物质的构成》优秀教案一、教学内容本节课选自浙教版七年级上科学教材第二章第一节《物质的构成》,内容包括:物质的基本粒子——分子、原子和离子;物质的组成和分类;常见物质的构成特点。
二、教学目标1. 知识与技能:使学生理解物质的基本粒子,掌握物质的组成和分类,了解常见物质的构成特点。
2. 过程与方法:培养学生通过观察、实验、分析等方法,探究物质的构成,提高科学思维能力。
3. 情感态度与价值观:激发学生对物质世界的好奇心,培养学生热爱科学、探索未知的情感。
三、教学难点与重点教学重点:物质的基本粒子、物质的组成和分类。
教学难点:理解分子、原子、离子之间的关系,掌握常见物质的构成特点。
四、教具与学具准备1. 教具:多媒体课件、实验器材(如酒精、食盐、糖等)。
2. 学具:实验报告单、学习笔记。
五、教学过程1. 导入:通过展示宏观世界和微观世界的图片,引发学生对物质构成的思考。
2. 新课导入:讲解分子、原子、离子的概念,阐述它们之间的关系。
3. 实践情景引入:进行酒精、食盐、糖等物质的溶解实验,引导学生观察实验现象,探讨物质构成的奥秘。
4. 例题讲解:讲解常见物质的构成特点,如水、二氧化碳、氧气等。
5. 随堂练习:让学生完成实验报告单,巩固所学知识。
六、板书设计1. 物质的基本粒子:分子、原子、离子2. 物质的组成和分类3. 常见物质的构成特点七、作业设计1. 作业题目:请简述分子、原子、离子之间的关系,并举例说明。
答案:分子是由两个或多个原子通过共价键连接在一起的粒子,原子是构成物质的基本粒子,离子是带电的原子或分子。
如水分子(H2O)由两个氢原子和一个氧原子组成,食盐(NaCl)是由钠离子和氯离子组成的。
2. 作业题目:列举三种常见物质的构成特点。
答案:①水:由水分子(H2O)组成,是一种液态物质。
②二氧化碳:由二氧化碳分子(CO2)组成,是一种气态物质。
③铁:由铁原子(Fe)组成,是一种固态金属。


浙教版七年级上科学《物质的构成》优秀优质教案一、教学内容本节课选自浙教版七年级上科学教材第四章《物质的构成》。
详细内容包括:物质由分子、原子和离子构成,分子、原子、离子的基本性质,以及它们在物质性质和变化中的作用。
二、教学目标1. 让学生理解物质由微观粒子构成的概念,掌握分子、原子、离子的基本性质。
2. 培养学生运用微观粒子观点解释宏观现象的能力。
3. 培养学生的观察能力、动手能力和合作精神。
三、教学难点与重点教学难点:分子、原子、离子的基本性质及其在物质性质和变化中的作用。
教学重点:物质由微观粒子构成的概念,以及分子、原子、离子之间的区别与联系。
四、教具与学具准备1. 教具:PPT、分子模型、原子结构模型、离子模型。
2. 学具:显微镜、实验器材(酒精、碘酒、糖水等)。
五、教学过程1. 引入:通过展示日常生活中的物质变化现象,引发学生对物质构成的思考。
2. 新课导入:介绍分子、原子、离子的概念,展示相关模型,让学生直观了解微观粒子的形态。
3. 知识讲解:a. 分子的基本性质,如分子的组成、分子的运动等。
b. 原子的基本性质,如原子的结构、原子核与电子的关系等。
c. 离子的基本性质,如离子的形成、离子间的相互作用等。
4. 例题讲解:通过讲解典型例题,让学生掌握如何运用微观粒子观点解释宏观现象。
5. 随堂练习:设计相关练习题,巩固所学知识,提高学生的应用能力。
6. 实践活动:分组进行实验,观察物质变化现象,分析微观粒子间的相互作用。
六、板书设计1. 物质的构成:分子、原子、离子2. 分子、原子、离子的基本性质3. 微观粒子与宏观现象的关系七、作业设计1. 作业题目:a. 解释下列现象中微观粒子间的相互作用:酒精与碘酒混合、糖水蒸发。
b. 分别用分子、原子、离子观点解释水的三态变化。
2. 答案:a. 酒精与碘酒混合时,分子间发生扩散现象,说明分子具有运动性。
糖水蒸发时,水分子从液态变为气态,说明分子间存在相互作用力。
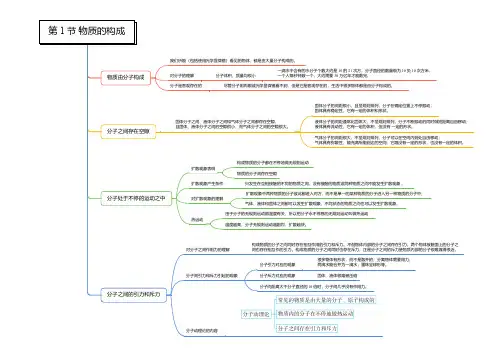
浙教版七年级上科学《物质的构成》优秀教案一、目标导航[知识与技能]1.让学生了解分子是构成物质的一种微粒;2.让学生确认分子比细胞小得多;3.确认不同物质有不同的分子大小。
[科学思考]通过小组合作、自主探究学习,使学生知道分子之间存在空隙,并能列举说明分子之间有空隙的现象。
[解决问题]通过学习,知道气体分子之间的空隙比固体和液体之间的空隙大得多。
了解扩散现象。
[情感与态度]让学生在探究中自主发现知识,在做中学,培养学生科学探究能力和探究精神;确认固体、液体、气体都能发生扩散,能列举反映固体、液体、气体扩散的现象和事实,能用分子的运动解释扩散现象。
理解扩散的快慢与温度的关系,能叙述分子运动的剧烈程度与温度的关系。
二、要点扫描[课标解读]《物质的构成》这一节课比较抽象,讲的是物质构成的微观领域,比如分子是构成物质的一种微粒;分子之间有空隙;分子处于不停地运动之中以及物态变化的微观解释。
要讲好这一节课,关键是要化抽象为具体,做好各种演示实验。
让学生在探究中自主发现知识,在做中学,培养学生科学探究能力和探究精神。
[内容分析]《物质的构成》是初中科学7年级第4章第1节的内容,讲的是物质构成的微观领域,比如分子是构成物质的一种微粒;分子之间有空隙;分子处于不停地运动之中以及物态变化的微观解释。
要讲好这一节课,关键是要化抽象为具体,做好各种演示实验。
在讲“分子是构成物质的一种微粒”时,要从观察方型蔗糖、观察碾碎的蔗糖到观察糖水,来引出蔗糖分子,并且强调分子只是构成物质的一种微粒。
分子很小,要通过比喻的方法告诉学生。
“分子之间有空隙”,要做好主实验和辅助实验。
酒精和水的混合实验要用有刻度的小试管,比如50毫升水和50毫升红色酒精混合后的体积会明显小于水和酒精的体积之和。
黄豆和芝麻的辅助实验很明显,要用黑芝麻。
同样道理,“分子处于不停地运动之中和物态变化的微观解释”,也要做好演示实验。
因为这一节课的重点是分子、分子的运动、物质的扩散现象。
《物质的构成》教案一、教学目标1.了解分子是构成物质的一种微粒。
确认分子比细胞小得多。
2.理解分子之间存在空隙,能列举反映分子之间空隙的现象。
能用事实说明气体分子之间的空隙比固体和液体分子之间的空隙大得多。
3.了解扩散现象,确认固体、液体、气体都能发生扩散,能列举反映固体、液体、气体扩散的现象,能用分子运动的观点解释扩散现象。
理解扩散的快慢与温度的关系,能叙述分子运动的剧烈程度与温度的关系。
二、教学重点及难点重点:1.分子之间存在空隙2.扩散现象难点:.分子之间存在空隙三、教学过程引入:同学们喜不喜欢听故事啊?既然如此,上课之前老师先给大家讲一个故事吧。
这个故事的题目呢,叫做一个小和尚的故事。
从前绍兴城里有一座山,山上有一座庙,庙里住着一个小和尚,小和尚每天的工作只是劈柴,他要把一捆很大的木柴不断劈小,劈小,再劈小。
劈得时间长了,小和尚就胡思乱想起来:如果我再把这小的木柴再劈小,那劈到最小会是什么呢?小和尚想了很久,就是想不出来。
同学们你们能帮小和尚解决疑问吗?你们认为这个木柴劈到最小会是什么呢?预设:小木屑(小木屑真的是最小的吗)细胞(大家都知道细胞,那么以植物细胞为例,细胞可以再分解吗)分子(这个同学很厉害哦,竟然知道分子,那你知道什么是分子吗?)课题引入:那劈到最后到底会是什么呢?让我们来学习今天的知识-----物质的构成,一起来揭开这个谜底吧。
板书:物质的构成(一)观察蔗糖:今天老师给同学们带来了一种东西,那就是方糖。
方糖就是一种糖,什么味道啊?(甜的)今天咱们的探究目的是:研究出构成方糖的最小颗粒是什么?以四人研究小组为单位,跟着老师的步骤一步一步进行探究。
师:用放大镜观察这一块方形的蔗糖的表面结构,你发现了什么?预设:看到蔗糖的小颗粒师:这小颗粒可以再分吗?(可以)师:怎么分?生:讨论:1,磨碎变成粉末2,溶于水中师:为了节省时间和节约实验材料,我们不要把整块方糖拿来研磨或者溶解,可以取一小部分把这一小部分的蔗糖变得更小?学生实验:先进行研磨方糖,把蔗糖颗粒变成粉末师:这下的蔗糖比原来更小了,那它还是糖吗?为什么?学生实验:再进行溶解,为了加快溶解,我们可以用玻璃棒来搅拌一下。