2020年高考化学二轮专题复习:盐类水解及其应用
- 格式:docx
- 大小:174.98 KB
- 文档页数:8
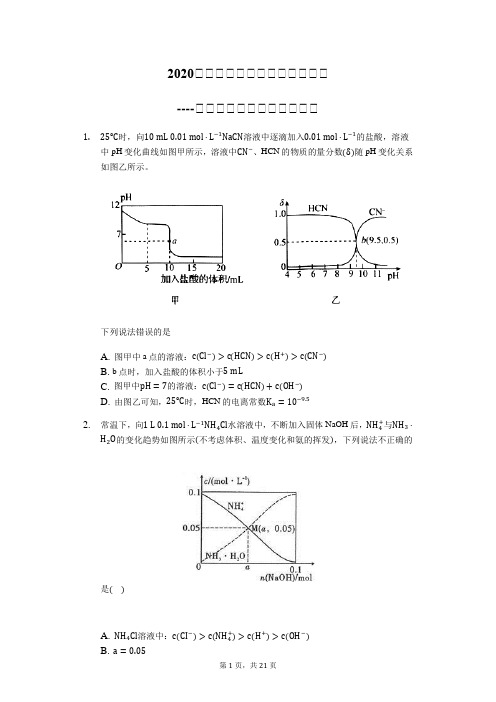
2020届届届届届届届届届届届届届----届届届届届届届届届届届届1.25℃时,向10mL0.01mol·L−1NaCN溶液中逐滴加入0.01mol·L−1的盐酸,溶液中pH变化曲线如图甲所示,溶液中CN−、HCN的物质的量分数(δ)随pH变化关系如图乙所示。
下列说法错误的是A. 图甲中a点的溶液:c(Cl−)>c(HCN)>c(H+)>c(CN−)B. b点时,加入盐酸的体积小于5mLC. 图甲中pH=7的溶液:c(Cl−)=c(HCN)+c(OH−)D. 由图乙可知,25℃时,HCN的电离常数K a=10−9.52.常温下,向1L0.1mol·L−1NH4Cl水溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑体积、温度变化和氨的挥发),下列说法不正确的是()A. NH4Cl溶液中:c(CI−)>c(NH4+)>c(H+)>c(OH−)B. a=0.05C. 随着NaOH的加入,c(H+)不断减小c(NH4+)D. 当n(NaOH)=0.1mol时,c(Na+)=c(NH4+)+c(NH3⋅H2O)3.关于常温下pH=2的草酸(H2C2O4)溶液,下列说法正确的是A. 1L溶液中含H+为0.02molB. c(H+)=2c(C2O42−)+c(HC2O4−)+c(OH−)C. 加水稀释,草酸的电离度增大,溶液pH减小D. 加入等体积pH=2的盐酸,溶液酸性减小4.常温时,在(NH4)2SO4溶液中滴加Ba(OH)2溶液,下列有关选项正确的是A. 滴加前:c(NH4+)+c(H+)=c(OH−)+c(SO42−)B. 滴加前:c(NH4+)+c(NH3·H2O)=c(SO42−)C. 滴加至完全沉淀:c(OH−)﹥c(NH4+)﹥c(H+)D. 滴加至中性:c(SO42−)=2c(NH4+)﹥c(H+)=c(OH−)5.常温下,用0.10mol·L−1NaOH溶液滴定20mL0.10mol·L−1HA溶液,混合溶液的pH与离子浓度变化的关系如图所示,下列叙述错误的是A. K a(HA)的数量级为10−4B. b点时消耗NaOH溶液的体积小于20mLC. b点溶液中离子浓度:c(Na+)=c(A−)>10−7mol·L−1D. 混合溶液的导电能力:a>b6.室温下,向20mL0.1mol⋅L−1Na2RO3溶液中逐滴加入0.1mol⋅L−1盐酸,溶液含R微粒的物质的量分数与pH关系如图所示(H2RO3不稳定,易转化为RO2气体逸出溶液,气体逸出未画出,忽略因气体逸出引起的溶液体积变化).下列说法错误的是()A. 0.1mol⋅L−1Na2RO3溶液中:c(Na+)>2c(RO32−)+c(HRO3−)B. 当溶液pH=7时,溶液总体积大于40mLC. A点对应pH约为10.8,RO32−的水解常数K h1数量级为10−4D. 在B点对应的溶液中,离子浓度最大的是HRO3−7.常温下,用0.1mol/L NaOH溶液滴定20mL0.1mol/L H2XO3,溶液的滴定曲线如图所示(已知:25℃时,H2XO3的K a1=10−1.85,K a2=10−7.19),下列说法不正确的是()A. A点所得溶液中:c(HXO3−)<c(H2XO3)B. B点所得溶液中:c(H2XO3)+c(H+)=c(XO32−)+c(OH−)C. C点所得溶液中:c(Na+)>3c(HXO3−)D. D点所得溶液中水解平衡常数K h1=10−6.818.下列实验现象及结论正确的是()A. 向AgNO3溶液中加入几滴NaCl溶液生成白色沉淀,再向试管内加入KI溶液若生成黄色沉淀,则证明K sp(AgCl)>K sp(AgI)B. 等物质的量浓度、等体积的CH3COONa和NaClO阴离子的总数前者小于后者C. Na2CO3溶液滴入足量硼酸溶液中,无气泡生成,说明K a:H2CO3>H3BO3D. 若弱酸的酸性H2A>H2B>HA−>HB−,则等物质的量浓度等体积的Na2A、Na2B溶液中,离子数目前者等于后者9.剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。





高中化学知识点盐类的水解及应用-高中化学知识点:盐类的水解及应用!-掌门1对1同学们,在线一对一小编给大家分享一些干货,快来看看吧。
一、水解的原理、规律及应用1.原理:在水溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
通式为:盐+水酸+碱如:醋酸钠溶液中总的化学方程式:CH3COONa+H2OCH3COOH+NaOH;总的离子方程式:CH3COO-+H2OCH3COOH+OH-。
2.规律:(1)盐类水解反应可以看成是酸碱中和反应的逆反应,通式为:盐+水酸+碱。
由于中和反应进行程度较大,因而水解反应进行程度较小,为可逆反应。
中和反应为放热反应,因而盐类水解反应为吸热反应。
(2)盐类水解规律有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。
(3)强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
例题:相同条件下,测得①NaHCO3 ②CH3COONa ③NaAlO2三种溶液的pH值相同。
那实验么它们的物质的量浓度由大到小的顺序是_____________。
3.水解平衡的移动(1)温度对平衡的影响:由于水解为吸热变化,升温可使水解平衡向右移动,从而增大水解的程度。
如:把FeCl3饱和溶液滴入沸水中制取胶体,就是利用升温增大水解程度的实例。
(温度对水解平衡的影响是通过改变水解常数Kh实现的)(2)浓度对平衡的影响:越稀越水解指的是溶液浓度越小,弱离子的水解程度越大,并不是水解常数越大。
如下以醋酸钠水解具体分析:a、向一定浓度的醋酸钠溶液中加水时,水解平衡____移,C (OH-)______,水解程度______,C(OH-)/C(CH3COO-)_____。
+ + 2 3 3 3 4 3 盐类的水解及其应用一、选择题(每小题只有一个正确选项,共 10*6 分) 1.(2020 浙江高考 7 月选考真题)水溶液呈酸性的是( )A .NaClB .NaHSO 4C .HCOONaD .NaHCO 3【答案】B【解析】A .NaCl 是强酸强碱盐,其不能水解,故其水溶液呈中性,A 不符合题意;B .NaHSO 4 是强酸的酸式盐,其属于强电解质,其在水溶液中的电离方程式为 NaHSO 4=Na +H ,故其水溶液呈酸性,B 符合题意;C .HCOONa 属于强碱弱酸盐,其在水溶液中可以完全电离,其电离产生的 HCOO -可以发生水解,其水解的离 子方程式为 HCOO -+H O ⇌ HCOOH +OH -,故其水溶液呈碱性,C 不符合题意;D .NaHCO 是强碱弱酸盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D 不符合题意。
综上所述,本题答案为 B 。
2.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反 应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。
根据上述观点,说法不正确的是 A .BaO 2 的水解产物是 Ba(OH)2 和 H 2O 2B .PCl 3 的水解产物是 HClO 和 H 3PO 3C .A14C 3 的水解产物是 Al(OH)3 和 CH 4D .CH 3COCl 的水解产物是两种酸【答案】B【解析】A. BaO 2 中氧元素是-1 价,则水解产物是Ba(OH)2 和H 2O 2,A 正确;B. PCl 3 中P 和 Cl 的化合价分别是+3 价和-1 价,所以分别结合水电离出的 OH -和氢离子,产物是 H PO 和 HCl ,B 错误;C. A1 C 中碳元素是-4 价,则水解产物是 Al(OH)3 和 CH 4,C 正确;D. CH 3COCl 的水解产物是两种酸,分别是乙酸和盐酸,D 正确;答案选B 。
2020年高考化学二轮专题复习:盐类水解及其应用一、选择题1.下列反应不属于水解反应或水解方程式不正确的是( ) ①HCl +H 2OH 3O ++Cl -②AlCl 3+3H 2O===Al(OH)3+3HCl ③Na 2CO 3+2H 2OH 2CO 3+2NaOH ④碳酸氢钠溶液:HCO -3+H 2O CO 2-3+H 3O +⑤NH 4Cl 溶于D 2O 中:NH +4+D 2ONH 3·D 2O +H +A .①②③④B .①②③C .②③⑤D .全部答案 D解析 ①④是电离方程式;②是水解反应方程式,但应用“”;③的水解方程式错误,应分步进行;⑤应为NH +4+D 2ONH 3·HDO +D +。
2.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别离解成两部分,然后两两重新组合成新的物质。
根据上述观点,下列说法不正确的是( )A .BaO 2的水解产物是Ba(OH)2和H 2O 2B .PCl 3的水解产物是HClO 和H 3PO 4C .Al 4C 3的水解产物是Al(OH)3和CH 4D .CH 3COCl 的水解产物是两种酸 答案 B解析 BaO 2的水解产物是Ba(OH)2和H 2O 2,该反应中没有元素化合价升降,符合水解原理,故A 项正确;该反应中Cl 元素的化合价由-1变为+1,有电子转移,不符合水解原理,故B 项错误;Al 4C 3水解得到氢氧化铝和甲烷,符合水解原理,故C 项正确;CH 3COCl 的水解产物是两种酸,为CH 3COOH 和HCl ,符合水解原理,故D 项正确。
3.25 ℃时,将浓度为0.1 mol·L -1 的Na 2S 溶液加水不断稀释,下列各量始终减小的是( ) A .c (OH -) B .n (Na +) C.n ()H +n ()S 2- D.c ()Na +c ()S 2-答案 A解析 Na 2S 溶液加水稀释时水解平衡正向移动,OH -的数目不断增多,但溶液体积增大的程度大,故整体看c (OH -)减小;Na +不水解,其物质的量不变;加水稀释,Na 2S 的水解程度增大,c (S 2-)减小,因c (OH -)减小,故c (H +)增大,即c ()H +c ()S 2-增大,故n ()H +n ()S 2-增大;加水稀释,水解平衡正向移动,S 2-不断被消耗,故c (S 2-)减小的程度比c (Na +)大,故c ()Na +c ()S 2-增大。
故选A。
4.25 ℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是() A.均存在电离平衡和水解平衡B.存在的粒子种类相同C.c(OH-)前者大于后者D.分别加入NaOH固体,恢复到原温度,c(CO2-3)均增大答案C解析两种溶液中均存在着水的电离平衡,NaHCO3溶液中还存在:HCO-3H++CO2-3及HCO-3+H2O H2CO3+OH-的水解平衡,Na2CO3溶液中还存在:CO2-3+H2O HCO-3+OH-的水解平衡,A项正确;两种溶液中均存在Na+、CO2-3、HCO-3、H2CO3、OH-、H+、H2O,B项正确;浓度相同时,CO2-3水解程度大于HCO-3水解程度,故Na2CO3溶液中c(OH-)更大,C项错误;NaHCO3溶液中加入NaOH固体:HCO-3+OH-H2O+CO2-3,c(CO2-3)增大,Na2CO3溶液中加入NaOH,导致CO2-3的水解平衡向左移动,c(CO2-3)增大,D正确。
5.下面提到的问题中,与盐的水解有关的是()①明矾和FeCl3可作净水剂②为保存FeCl3溶液,要在溶液中加少量盐酸③实验室配制AlCl3溶液时,应先把它溶在盐酸中,而后加水稀释④NH4Cl与ZnCl2溶液可作焊接中的除锈剂⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂⑦在NH4Cl或AlCl3溶液中加入金属镁会产生氢气⑧长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用⑨比较NH4Cl和Na2S等溶液中离子浓度的大小或某些盐溶液的酸碱性A.①④⑦B.②⑤⑧C.③⑥⑨D.全部答案D解析①Al3+和Fe3+水解产生Al(OH)3胶体和Fe(OH)3胶体,吸附水中的悬浮杂质;②加盐酸可抑制FeCl3水解;③AlCl3溶解在盐酸中可抑制Al3+的水解;④NH+4和Zn2+水解产生的H +与锈反应;⑤Na2CO3、Na2SiO3溶液水解显碱性,可腐蚀玻璃;⑥Al3+与HCO-3发生相互促进水解反应,产生大量泡沫;⑦NH+4和Al3+能水解产生H+能与Mg反应;⑧NH+4水解显酸性,草木灰水解显碱性,二者相互促进会使NH3逸出,降低肥效;⑨比较溶液中离子浓度大小或盐溶液的酸碱性,都要考虑盐溶液是否水解。
6.下列根据反应原理设计的应用,不正确的是()A.CO2-3+H2O HCO-3+OH-用热的纯碱溶液清洗油污B.Al3++3H2O Al(OH)3(胶体)+3H+明矾净水C.TiCl4+(x+2)H2O(过量)TiO2·x H2O↓+4HCl制备TiO2纳米粉D.SnCl2+H2O Sn(OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠答案D解析配制SnCl2溶液时应加入稀盐酸抑制SnCl2水解,加入NaOH会促进SnCl2的水解,而发生变质。
7.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是()A.酸性:HCN>HClOB.pH:HClO>HCNC.酸根离子浓度:c(CN-)<c(ClO-)D.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN答案C解析等浓度的两盐溶液中NaCN溶液pH较大,说明酸性:HClO>HCN ,故A项错误;HClO电离程度大,其水溶液的pH:HClO<HCN,故B项错误;酸根离子的物质的量浓度c(ClO-)>c(CN-),故C项正确;等物质的量的一元酸(无论酸性强弱)必中和等物质的量的NaOH,故D项错误。
8.25 ℃时,浓度均为0.1 mol·L-1的溶液,其pH如下表所示。
下列有关说法正确的是()A.酸性强弱:23B.①和②中溶质均未水解C.离子的总浓度:①>③D.④中:c(HCO-3)+2c(CO2-3)+c(H2CO3)=0.1 mol·L-1答案C解析相同浓度时,pH:NaHCO3>NaF,则水解程度:HCO-3>F-,根据“越弱越水解”知,酸性:H2CO3<HF,A项错误;①中溶质NaCl为强酸强碱盐,不水解,②中溶质CH3COONH4为弱酸弱碱盐,发生相互促进的水解反应,B项错误;根据电荷守恒知,①、③溶液中离子的总浓度均为2[c(Na+)+c(H+)],NaCl对水的电离无影响,而NaF促进水的电离,①显中性,③显碱性,故①中c(H+)大于③中c(H+),故离子的总浓度:①>③,C项正确;根据物料守恒知④中:c(HCO-3)+c(CO2-3)+c(H2CO3)=0.1 mol·L-1,D项错误。
9.室温下,将0.05 mol CH3COONa固体溶于水配成100 mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是()C 0.05 mol NH 4Cl 固体水电离程度增大D 50 mL H 2O由水电离出的c (H +)·c (OH -)减小答案 A解析 室温下,将0.05 mol CH 3COONa 固体溶于水配成100 mL 溶液,所得溶液的浓度为0.5 mol·L -1。
则再加入0.05 mol CH 3COONa 固体,c (Na +)增大为原来的2倍,而由于溶液浓度增大,CH 3COO -的水解程度变小,故c (CH 3COO -)大于原来的2倍,则c (CH 3COO -)c (Na +)比值增大,A 项错误;加入0.05 mol NaHSO 4固体,能和0.05 mol CH 3COONa 反应生成0.5 mol·L -1CH 3COOH 和0.5 mol·L-1的Na 2SO 4的混合溶液,根据物料守恒可知,c (CH 3COO -)+c (CH 3COOH)=0.5 mol·L -1,而c (Na +)=1 mol·L -1,c (SO 2-4)=0.5 mol·L -1,故有:c (CH 3COO-)+c (CH 3COOH)=c (Na +)-c (SO 2-4),B 项正确;加入0.05 mol NH 4Cl 固体后,和CH 3COONa 发生双水解,水解程度增大,故水的电离程度增大,C 项正确;加入50 mL 水后,溶液变稀,pH 变小,即溶液中c (OH -)变小,而溶液中所有的氢氧根均来自水的电离,即水电离出的c (OH -)变小,由水电离出的氢离子浓度与其电离出的氢氧根的浓度相同,故水电离出的c (H+)变小,因此由水电离出的c (H +)·c (OH -)减小,D 正确。
10.为了得到比较纯净的物质,下列使用的方法恰当的是( )A .向Na 2CO 3饱和溶液中,通入过量的CO 2后,在加压、加热的条件下,蒸发得NaHCO 3晶体B .加热蒸发AlCl 3饱和溶液得纯净的AlCl 3晶体C .向FeBr 2溶液中加入过量的氯水,加热蒸发得FeCl 3晶体D .向FeCl 3溶液里加入足量的NaOH 溶液,经过滤、洗涤沉淀,再充分灼烧得Fe 2O 3 答案 D解析 A 不正确,因为NaHCO 3加热要分解;B 、C 项也不正确,因为AlCl 3与FeCl 3在加热蒸发的情况下水解生成的HCl 易挥发,水解趋于完全,分别发生下列反应:Al 3++3H 2OAl(OH)3+3H +,2Al(OH)3=====△A l 2O 3+3H 2O ,Fe 3++3H 2OFe(OH)3+3H +,2Fe(OH)3=====△Fe 2O 3+3H 2O 。
11.某学生探究0.25 mol·L -1 Al 2(SO 4)3溶液与0.5 mol·L -1 Na 2CO 3溶液的反应,实验如下。
下列分析正确的是()A.实验1中,白色沉淀a是Al2(CO3)3B.实验2中,白色沉淀b一定是Al2(OH)2(CO3)2C.检验白色沉淀a、b是否洗涤干净,均可用盐酸酸化的BaCl2溶液D.实验1、2中,白色沉淀成分不同的原因与混合后溶液的pH无关答案C解析实验1中,沉淀溶解,无气泡,白色沉淀a是Al(OH)3,故A项错误;实验2中,沉淀溶解,少量气泡,该气体是CO2,但不能说明白色沉淀b一定是Al2(OH)2(CO3)2,故B项错误;检验白色沉淀a、b是否洗涤干净,即可检验有无SO2-4,均可用盐酸酸化的BaCl2溶液检验,故C项正确;实验1、2中,过量Al2(SO4)3溶液显酸性,过量Na2CO3溶液显碱性,不能确定白色沉淀成分不同的原因与混合后溶液的pH有无关系,故D项错误。