水体DNA提取试剂盒
- 格式:pdf
- 大小:46.98 KB
- 文档页数:4

基因组DNA 提取试剂盒使用说明书此说明书仅适用于此说明书仅适用于基因组基因组DNA 提取试剂盒提取试剂盒,,使用前请务必仔细阅读说明书有关内容使用前请务必仔细阅读说明书有关内容,,若有任何疑问若有任何疑问,,欢迎致电厦门欢迎致电厦门致致善生物科技有限公司生物科技有限公司((4006618810*************)进行咨询进行咨询,,您也可以登录我们公司的网站您也可以登录我们公司的网站(( )了解相关信息或者通过E-mail ( ****************) 与我们进行沟通与我们进行沟通。
一 产品简介基因组DNA 提取试剂盒采用本公司自行研制的磁珠,用于从抗凝全血、新鲜或冻存组织、培养细胞、石蜡包埋组织、唾液、培养细菌等一系列不同样品中分离、纯化高质量的基因组DNA。
我们根据磁珠的独特分离作用,提供了一个极其简便的操作程序:样品裂解、磁珠吸附、洗涤以及洗脱。
在最适的试剂及操作条件下,可获得高质量DNA。
该方法具有简便、快捷、高效等特点,整个提取过程无须使用苯酚、氯仿等有机溶剂。
品名规格 货号 基因组DNA 提取试剂盒100T 4hk001裂解液DL 120ml ×2 磁粒 40ml 洗涤液 50ml ×5 洗脱液 45ml 缓冲液HTL 20ml ×1 二硫苏糖醇(DTT ) 10管,0.18g/管 说明书 1份储存条件储存条件::本试剂盒所有试剂(除DTT 外)均可以室温保存,应避免阳光直射。
当室温低于15℃时,裂解液中可能有结晶析出,38℃水浴加热几分钟,恢复澄清后即可使用,提取效率不受影响。
DTT 需要于冰箱4℃保存。
本试剂盒有效期为12个月, 请于有效期内使用。
安全信息:试剂中含刺激性化合物,操作时应小心,避免沾染皮肤,眼睛和衣服,若沾染皮肤、眼睛时,要立即用大量清水或生理盐水冲洗,必要时寻求医疗咨询。
三 使用者自配试剂DTT 溶液使用浓度为1mol/L 。

细菌基因组DNA 提取试剂盒说明书货号:D1600规格:50T/100T保存:室温(15℃-25℃)干燥保存,复检期12个月,2℃-8℃保存时间更长。
试剂盒内容:D1600-50T D1600-100TRNase A1m11m1×2蛋白酶K1ml 1m1×2溶液A10ml 20ml 溶液B10ml 20ml 漂洗液15m115ml×2洗脱液10m120m1吸附柱50个100个收集管50个100个说明书1份1份产品简介:本试剂盒采用可以特异性结合DNA 的离心吸附柱和独特的缓冲液系统,提取细菌基因组DNA 。
离心吸附柱中采用的硅基质材料为本公司特有新型材料,能够高效专一吸附DNA ,可最大限度去除杂质蛋白及细胞中其他有机化合物。
提取的基因组DNA 片段大,纯度高,质量稳定可靠。
使用本试剂盒提取的基因组DNA 可用于各种常规操作,包括酶切、PCR 、文库构建、Southern 杂交等实验。
操作步骤:使用前请先在漂洗液中加入无水乙醇,加入体积请参照瓶体上的标签。
所有离心步骤均为使用台式离心机在室温下离心。
1、取细菌培养液1ml ,12000rpm 离心1min.,尽量吸除上清。
2、向菌体中加入200ul 溶液A ,振荡或用移液器吹打使菌体充分悬浮向悬浮液中加入20ul 的RNase A (10mg/ml),充分颠倒混匀,室温放置15-30min 。
注意:如果是革兰氏阳性菌:可在第2步操作前用200ul 终浓度为20mg/ml 的溶菌酶,37℃处理30min 以上。
(溶菌酶的缓冲液用:20mM Tris,pH 8.0;2mM Na2-EDTA ;1.2%Triton X-100)3、向管中加入20ul 的蛋白酶K(10mg/ml),充分混匀,55℃消化30-60min ,消化期间可颠倒离心管混匀数次,直至样品消化完全为止,此时可见菌液呈清亮粘稠状。
4、向管中加入200ul 溶液B ,充分颠倒混匀,如出现白色沉淀,可于75℃放置15-30min ,沉淀即会消失,不影响后续实验。

DNA提取所需试剂及配制方法1. TE(pH8.0)buffer(灭菌)10×TE Buffer 组份浓度100 mM Tris-HCl,10 mM EDTA(pH 7.4,7.6,8.0)配制量1L配制方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
1M Tris-HCl buffer 组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)配制量1L配制方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2. 10% (w/v)SDS溶液(灭菌)10%(W/V)SDS 组份浓度10%(W/V)SDS配制量100mL配制方法1.称量10g高纯度的SDS置于100~200mL烧杯中,加入约80mL的去离子水,68℃加热溶解。
2. 滴加数滴浓盐酸调节pH值至7.2。
3. 将溶液定容至100mL后,室温保存。
3. Tris-饱和酚(pH8.0)溶液Tris- HCl平衡苯酚1. 使用原料:大多数市售液化苯酚是清亮无色的,无需重蒸馏便可用于分子生物学实验。
但有些液化苯酚呈粉红色或黄色,应避免使用。
同时也应避免使用结晶苯酚,结晶苯酚必须在160℃对其进行重蒸馏除去诸如醌等氧化产物,这些氧化产物可引起磷酸二酯键的断裂或导致RNA和DNA的交联等。

一种水环境eDNA提取方法的建立水环境DNA(environmental DNA,简称eDNA)提取方法是指从水样中提取出的DNA物质,通过分析这些DNA物质可以了解水体中的生物多样性、物种分布等信息。
由于水环境DNA提取方法的建立具有重要的科学研究和环境监测应用价值,下面将介绍一种水环境eDNA提取方法的建立。
我们需要收集水样。
在进行水环境eDNA提取前,需要选择合适的水样收集地点和时间。
一般来说,选择有生物多样性的水域作为样品收集点,例如湖泊、河流等。
还需要考虑到水样收集器具的清洁与干净,避免外来污染对样品的影响。
进行水样预处理。
在eDNA提取前,需要对水样进行预处理,以去除水样中的杂质和有机物。
常见的预处理方法包括过滤法和离心法。
过滤法是指将水样通过0.22微米或0.45微米的滤膜进行过滤,将水样中的悬浮微粒去除,保留DNA物质。
离心法是指将水样进行离心,去除颗粒物等杂质,保留上清液用于后续的DNA提取。
接下来,进行DNA提取。
针对水环境eDNA提取,可以采用多种方法,如化学提取法、磁珠法等。
化学提取法是最常用的一种方法。
其具体步骤如下:1. 取适量的水样上清液,加入DNA提取试剂盒中的提取液,混合均匀。
2. 经过一系列洗涤、酶解和沉淀等步骤,将DNA从水样中提取出来。
3. 通过离心或磁珠分离等方法,将提取的DNA分离出来。
4. 将提取到的DNA进行判读和保存,用于后续的分析和测序。
进行提取效果验证。
为了验证所建立的eDNA提取方法是否可靠和有效,需要进行提取效果的验证。
可以通过PCR扩增和测序等方法,检验所提取到的DNA是否具有目标基因序列,或者利用实时荧光定量PCR等方法,测定DNA的浓度和纯度。
建立一种水环境eDNA提取方法包括水样收集、预处理、DNA提取和提取效果验证等步骤。
依据此方法提取出的eDNA样本可以用于水体生物多样性、物种分布等方面的研究和监测,对于保护水环境和生物资源具有重要的意义。

dna提取试剂盒原理
DNA提取试剂盒的原理是利用化学方法和物理方法将细胞膜破坏、细胞蛋白质降解、DNA与其他细胞组分分离,从而获得纯净的DNA样品。
具体步骤如下:
1. 细胞破碎:将待提取DNA的样品加入溶解缓冲液中,通过机械破碎、超声处理或酶解等方法使细胞膜完全破裂,释放细胞内的DNA。
2. 蛋白质降解:加入蛋白酶K等蛋白酶,将细胞内的蛋白质降解为小分子物质,以便后续去除。
3. DNA与蛋白质的分离:加入乙酸酚-氯仿等有机试剂,通过离心将DNA和蛋白质、碎细胞残渣等分为两相,DNA富集于上层而蛋白质和细胞残渣富集于下层。
4. DNA析出:将上层液体转移至新离心管中,加入同等体积的冷乙醇或异丙醇,DNA会在其中沉淀出来。
5. DNA洗涤:用70%的乙醇洗涤DNA沉淀,以去除残留的盐类和杂质。
6. DNA溶解:用脱离蛋白质结构的缓冲液溶解DNA沉淀,得到所需的DNA提取物。
DNA提取试剂盒通过上述原理,能够高效、快速地提取出高
质量的DNA样品,适用于分子生物学、基因组学、遗传学、犯罪学等领域的研究和应用。

一、试剂盒打开后需要准备的工作1、ProteinaseK(蛋白酶K)的溶解①取4.5ml双蒸水加入蛋白酶K粉中使其充分溶解②将溶解好的蛋白酶K溶液分装进小离心管,每管100u l〜200ul③将分装好的ProteinaseK放入-20°C冰箱中保存,使用期限为12个月2、组织抑制剂(InhibitorRemovalbfer)的调配加入20ml无水乙醇(absoluteethanol)颠倒混匀并在空白方框处打钩3、洗液(washbuffer)的调配加入80ml无水乙醇(absoluteethanol)颠倒混匀并在空白方框处打钩二、组织DNA提取(试剂盒)1、组织样品处理与消化①将采集来的样品剪碎(WO.lcm)洗净保存液。
②加入组织破解液Tissue-lysis200ul蛋白酶K40ul然后放入55C水浴锅内3个小时使其充分消化。
2、DNA提取①在消化好的组织样品中加入结合液bindingbuffer200ul然后放入70°水浴锅中10分钟。
②再加异丙醇lOOul混合均匀吸取上清液放入柱体中,然后离心8000g—分钟。
③倒掉底液,加500ul组织抑制剂InhibitorRemoval然后离心倒掉底液④加洗液washingbuffer500ul离心(洗液加两次)⑤在70C预热ElutionBuffer,然后将洗好的柱体下部分丢掉,换新的离心管加入ElutionBuffer200ul溶解10分钟离心保留底液放-20C保存。
三、细胞DNA的提取(试剂盒)1、组织样品处理与消化①将带有培养基的样品用PBS清洗干净8000rpm/1min离心,倒掉上清②加PBS200ul振荡摇匀使之样品成为单个细胞的悬浊液③加200ulBindingBuffer,40ul蛋白酶K混合均匀放入70C水浴锅内消化10分钟。
2、DNA提取①加异丙醇lOOul混合均匀吸取上清液放入柱体中,然后离心8000g—分钟。

dna提取试剂盒原理DNA提取试剂盒是一种用于从生物样本中提取DNA的化学试剂盒,其原理是利用试剂盒中的各种试剂和材料,通过一系列化学反应和物理处理,将DNA从细胞中分离出来,从而实现DNA的提取和纯化。
首先,DNA提取试剂盒中通常包含有裂解液,用于破坏细胞膜和核膜,释放细胞内的DNA。
裂解液中的成分通常包括离子性洗涤剂和蛋白酶,能够有效地破坏细胞膜和核膜,使DNA得以释放。
接着,试剂盒中还包含有沉淀剂,用于沉淀DNA。
沉淀剂通常是乙醇或异丙醇,能够与DNA形成复合物,使DNA沉淀到溶液底部。
此外,试剂盒中还包含有洗涤缓冲液,用于去除沉淀物和其他杂质,最终得到纯净的DNA。
在实际操作中,使用DNA提取试剂盒进行DNA提取通常需要按照以下步骤进行,首先,将待提取的生物样本加入裂解液中,使细胞裂解并释放DNA。
接着,加入沉淀剂,使DNA沉淀到溶液底部。
然后,将上清液倒出,加入洗涤缓冲液进行洗涤,最终得到纯净的DNA。
DNA提取试剂盒的原理简单而有效,能够快速、高效地从各种生物样本中提取DNA。
它广泛应用于分子生物学、遗传学、法医学等领域,为科研和临床诊断提供了便利。
同时,随着技术的不断进步,现代的DNA提取试剂盒已经具有了更高的纯度和更快的操作速度,为科研工作者和临床医生提供了更好的工具和支持。
总的来说,DNA提取试剂盒的原理是基于化学和物理的方法,通过一系列的步骤将DNA从生物样本中提取出来。
它的应用范围广泛,操作简便,是现代生物学研究和临床诊断中不可或缺的工具之一。
随着科学技术的不断发展,相信DNA提取试剂盒会在未来发挥更加重要的作用,为人类健康和科学研究做出更大的贡献。
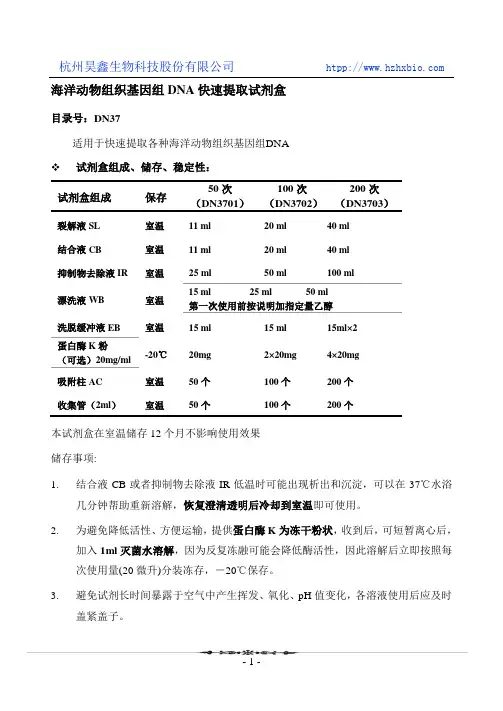
海洋动物组织基因组DNA快速提取试剂盒目录号:DN37适用于快速提取各种海洋动物组织基因组DNA 试剂盒组成、储存、稳定性:试剂盒组成保存50次(DN3701)100次(DN3702)200次(DN3703)裂解液SL 室温11 ml 20 ml 40 ml 结合液CB 室温11 ml 20 ml 40 ml 抑制物去除液IR 室温25 ml 50 ml 100 ml漂洗液WB 室温15 ml 25 ml 50 ml 第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温15 ml 15 ml 15ml×2蛋白酶K粉(可选)20mg/ml-20℃20mg 2×20mg 4×20mg吸附柱AC 室温50个100个200个收集管(2ml)室温50个100个200个本试剂盒在室温储存12个月不影响使用效果储存事项:1.结合液CB或者抑制物去除液IR低温时可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,恢复澄清透明后冷却到室温即可使用。
2.为避免降低活性、方便运输,提供蛋白酶K为冻干粉状,收到后,可短暂离心后,加入1ml灭菌水溶解,因为反复冻融可能会降低酶活性,因此溶解后立即按照每次使用量(20微升)分装冻存,-20℃保存。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
产品介绍:独特的结合液/蛋白酶K迅速裂解细胞和灭活细胞内核酸酶,然后基因组DNA在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤,抑制物去除液和漂洗液将细胞代谢物、蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净基因组DNA从硅基质膜上洗脱。
注意事项洗脱液EB不含有螯合剂EDTA,不影响下游酶切、连接等反应。
也可以使用水洗脱,但应该确保批pH大于7.5,pH过低影响洗脱效率。
用水洗脱DNA应该保存在-20℃。
DNA如果需要长期保存,可以用TE缓冲液洗脱(10mM Tris-HCl,1mM EDTA,pH 8.0),但是EDTA可能影响下游酶切反应,使用时可以适当稀释。

游离DNA提取试剂盒(磁珠法)说明书【产品名称】通用名称:核酸提取或纯化试剂商品名称:游离DNA 提取试剂盒(磁珠法)英文名称:Magbind CFDNA Kit 该试剂盒提供了一种简单、快速、高效的游离DNA (Free circulating / Cell-free DNA)提取方法,适用于从血清、血浆、淋巴液、尿液等无细胞体液中提取游离DNA 。
纯化得到的离DNA 质量稳定、可靠,可用于下游常规实验。
该试剂盒可与转移液体法的核酸提取仪配套使用,简单、快速地进行大规模提取,大大降低了实验者的工作量和实验中的人为误差。
【预期用途】 样品裂解后,在高盐存在时,DNA 结合于硅基包被的磁珠表面,漂洗后,高纯度DNA 被洗脱于洗脱缓冲液或去离子水中。
DNA 得率与样品的类型、储存条件、时间以及个体间差异有很大关系。
【检验原理】50次/盒;400次/盒【包装规格】版本号:11/2020【样本要求】1.适用标本类型:新鲜或冷冻的全血(用柠檬酸盐、EDTA 或肝素等抗凝剂处理过的血液样品)、血浆、血清、淋巴细胞、无细胞体液等样本。
2.标本处理与保存:血清及血浆样本按常规方法制备,新鲜样本应尽快处理或分装后于-70℃冻存,避免反复冻融。
3.样本运输:应采用冰壶或者泡沫箱加冰或干冰密封运输。
【检验方法】实验前准备:向蛋白酶K 中加入指定用量的蛋白酶K 保存液使其溶解,终浓度为20 mg/ml ,-20℃保存。
1.向1.5 ml 离心管中加入20 μl 蛋白酶K 溶液。
2.向上一步的离心管中加入200 μl 血清/血浆样品。
注意:冻存样品需提前在4℃冰箱中放置使其溶化。
溶化过程中反复颠倒样品储存管使其混匀。
3.向上一步的离心管中加入200 μl 裂解缓冲液,涡旋振荡5秒钟使其充分混匀后将离心管放于56℃、1300 rpm 的Thermomixer 上振荡裂解10分钟。
注意:1)如无Thermomixer ,需将离心管放于56℃水浴锅或金属浴中孵育10分钟,期间每隔2分钟涡旋振荡5秒钟。

试剂盒法提取dna原理
试剂盒法DNA提取是一种常用的方法,通过使用特定的试剂盒,能够从样品中有效提取出DNA。
其原理主要包括以下步骤:
1. 细胞破碎:首先需要将样品中的细胞壁和细胞膜破坏,使细胞释放出DNA。
这可以通过机械方法(如振荡、切割)、温
度变化以及特定的酶来实现。
2. 蛋白质沉淀:在细胞破碎的过程中,细胞内的蛋白质也会被释放出来。
为了去除这些蛋白质,可以添加蛋白酶等试剂,使蛋白质与DNA分离,并沉淀在溶液的底部。
这样就可以把上
清液从底物中分离出来。
3. DNA纯化:经过蛋白质沉淀后,可以使用特定的柱子或者
膜来吸附DNA。
这些柱子或膜上有特定的化学物质,能够选
择性地结合DNA分子,而其他杂质则会被洗脱掉。
在洗脱过
程中,可以使用一系列不同浓度的缓冲液,从而实现对DNA
的纯化。
4. 洗脱和溶解:经过柱子或膜的洗脱步骤后,DNA可被洗脱
并收集。
根据需要,可以选择使用纯水或特定的溶液来溶解DNA,以便于后续的实验操作,如PCR扩增、酶切和测序等。
总之,试剂盒法DNA提取是一种方便、快速且可靠的DNA
提取方法,通过一系列的步骤能够有效地从样品中获取到高质量的DNA。

细菌基因组DNA提取试剂盒目录号:DN12目录编号包装单位DN1201 50次DN1202 100次DN1203 200次❖适用范围:适用于快速提取各种细菌基因组DNA❖试剂盒组成、储存、稳定性:试剂盒组成保存50次100次200次细胞核裂解液室温30 ml 60 ml 120 ml蛋白沉淀液室温10 ml 20 ml 40 mlDNA溶解液室温10 ml 15ml 30 mlRNase A(10mg/ml) -20℃150μl250μl400μl本试剂盒在室温储存12个月不影响使用效果。
储存事项:1.环境温度低时细胞核裂解液中某些去污剂成份会析出出现浑浊或者沉淀,可在37℃水浴加热几分钟,轻轻旋摇,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。
2.蛋白沉淀液可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,如果不能完全溶解,也不影响使用效果,直接取用上层溶液即可。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
❖产品介绍:本试剂盒用于快速的从各种细菌中提取基因组DNA。
细菌样品加入细胞核裂解液(或者通过溶菌酶或者其它一些酶帮助裂解细胞壁后),首先在强去污剂作用下裂解细胞释放出基因组DNA,接着加入RNase A去除RNA,然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重溶解于DNA溶解液。
❖产品特点:1.不需要使用有毒的苯酚等试剂。
2.快速,简捷,单个样品操作一般可在30分钟内完成。
3.结果稳定,产量高,OD260/OD280典型的比值达1.7~1.9,长度可达50 kb -150kb,可直接用于构建文库,PCR,Southern-blot和各种酶切反应。
❖注意事项1.所有的离心步骤均在室温完成,使用转速可以达到13,000 rpm的传统台式离心机,如Eppendorf 5415C 或者类似离心机。
2.用户需自备异丙醇、70%乙醇、0.5M EDTA和Lysozyme(溶菌酶)(用于革兰氏阳性菌)、lysostaphin(用于某些难裂解的革兰氏阳性菌)、水浴箱。
dna试剂盒提取原理
DNA试剂盒是一种用于DNA提取的化学试剂盒,其提取原理主要包括细胞破解、蛋白质去除和DNA析出三个步骤。
细胞破解是DNA提取的第一步,旨在破坏细胞膜和核膜,使细胞的DNA释放出来。
常用的细胞破解方法包括物理破碎和化学破碎。
物理破碎方法可以通过高速离心、超声波或者高压力等方式破坏细胞膜和核膜,使DNA被释放到溶液中。
化学破碎方法则通过加入洗涤剂或蛋白酶K等物质破坏细胞膜和核膜。
蛋白质去除是DNA提取的第二步,旨在去除DNA溶液中的蛋白质和其他杂质。
通常使用酚/氯仿方法进行蛋白质去除。
这种方法基于酚与蛋白质和DNA分别具有不同的亲和性,通过分层,使蛋白质留在有机相中,而DNA留在水相中。
DNA析出是DNA提取的最后一步,通过加入乙醇或异丙醇等沉淀剂使DNA沉淀出来。
沉淀剂可以与DNA形成水合物,增加DNA的质量。
在加入沉淀剂后,样品中的DNA会逐渐凝聚形成白色沉淀物,然后使用离心将沉淀物分离出来。
沉淀物含有DNA,可以进行后续的PCR扩增、测序等实验。
总而言之,DNA试剂盒通过细胞破解、蛋白质去除和DNA析出等步骤,从样品中提取出DNA。
这些步骤能够高效地破坏细胞结构、去除杂质,最终得到纯度较高的DNA。
细菌基因组DNA大量提取试剂盒使用说明一、试剂盒的组成和保存1. 试剂盒通常包含以下试剂:细菌裂解液、蛋白酶K、RNase A、乙酰乙酸钠、异丙醇、异待戊酸酒精和洗涤缓冲液等。
所有试剂均应在4℃保存,并避免光照。
2.打开试剂盒后,应将所有试剂恢复至室温后再进行实验。
二、细菌样品的准备1. 选择要提取DNA的细菌菌株,并以合适的培养基进行预培养,至菌液浓度达到0.5-1.0 McFarland标准。
通常需要提取500μl菌液。
2.将细菌菌液用低速离心(1,500×g,10分钟),倒掉上清液。
3. 用无菌PBS洗涤细菌沉淀物,将其转移到1.5ml离心管中,并用PBS以适量体积使菌液悬浮。
三、DNA提取1.加入500μl裂解液到离心管中,并充分混匀,然后孵育于65℃恒温水浴中30分钟。
期间轻轻摇荡离心管。
**注意:**为了最大限度地保证DNA提取效果,裂解液应充分混合,可以通过轻轻翻转离心管或用手轻轻转动溶液达到混匀的目的。
2. 在65℃恒温水浴中孵育结束后,加入50μl蛋白酶K和5μl RNase A,轻轻颠倒离心管以混匀。
3.再次将离心管放回65℃恒温水浴中孵育60分钟。
4.取出离心管,加入300μl异酸醇,轻轻颠倒离心管以混匀,然后在冰上静置5分钟。
5.离心管离心(12,000×g,5分钟,4℃),将上清液转移到新的离心管中。
6. 加入1ml异待戊酸酒精,轻轻颠倒离心管以混匀。
7.离心管离心(12,000×g,5分钟,4℃),将上清液倒掉。
8. 加入1ml 75%乙醇洗涤缓冲液,轻轻颠倒离心管以混匀。
9.离心管离心(12,000×g,5分钟,4℃),将上清液倒掉。
10.将离心管放置在80℃干燥箱中,使DNA片段溶于无菌水中。
四、DNA质量检测和存储1.使用比色计或荧光检测仪检测提取的DNA浓度和纯度。
2.将DNA保存在-20℃冷冻保存。
**注意事项:**1.实验操作过程中请严格遵守无菌操作规范,避免污染。
细菌基因组DNA快速提取试剂盒(溶液型)GK1061 50 次GK1062 100次一、试剂盒组成Components GK1061 GK1062Digestion Solution(a)Proteinase K(b)NaCl Solution CTAB/NaCl Solution(c) Boiled RNase A (10mg/ml)TE (pH8.0)Lysozyme(d)SP Buffer 18ml3mg6ml6ml240µl18ml30mg0.5ml36ml6mg12ml12ml480µl36ml60mg1.0ml二、实验前的准备(a) Digestion Solution低温时可能出现沉淀,请于55℃适当加温溶解后使用,不会影响实验结果。
首次使用时,将Boiled RNase A全部加入到Digestion Solution中,充分混匀备用,加完Boiled RNase A的Digestion Solution,请于4℃保存。
(b) Proteinase K使用前加入300µl (GK1061) 、600µl (GK1062)灭菌双蒸水,分装-20℃冻存。
不得将ProteinaseK直接加入到Digestion Solution中,以免酶失活。
(c) CTAB/NaCl Solution使用前需要65℃预热,便于溶解和取液。
(d) Lysozyme使用前加入500µl (GK1061) 或1ml (GK1062) SP Buffer,使Lysozyme全部溶解。
分装后-20℃冻存。
三、试剂盒说明本试剂盒用于快速的从各种细菌中提取基因组DNA。
细菌样品加入细胞核裂解液(或者通过溶菌酶或者其它一些酶帮助裂解细胞壁后),首先在强去污剂作用下裂解细胞释放出基因组DNA,接着加入RNase A去除RNA,然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重新溶解于DNA溶解液中。
唾液DNA收集保存运输提取试剂盒目录号:DN39适用范围:针对唾液样本中的DNA进行收集、保存、运输、纯化。
替代或者配套Oragene 唾液收集管使用。
试剂盒组成、储存、稳定性:本试剂盒在室温储存12个月不影响使用效果。
储存事项:1. 细胞裂解液低温时可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,恢复澄清透明后冷却到室温即可使用。
2. 避免试剂长时间暴露于空气中发生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
产品介绍:传统的人类基因组DNA样品的采集往往需要抽血采集并提取全血基因组DNA 获得。
该方法有几个明显的缺点:需要一定的采血设备并需要具有医务知识的人员来完成;抽血的疼痛造成排斥拒绝采样;侵入性采集增加了感染的可能性;采集后血液样品必须低温运输保存。
本试剂盒可提供无疼痛、非侵入性的方法,患者不用忍受抽血的疼痛和感染的风险就能获得高质量、高数量的样品,受测者排斥性低,婴儿和老人都能方便取得DNA样本。
收集过程十分简单,受测者将唾液吐至保存液内混匀就完成收集过程。
混匀后常温下可运输保存长达一年不会变质。
能够节省运送、保存冷藏设备和电力费用。
收集的唾液通过几个简单步骤便可提取DNA。
抽取的DNA产量平均达110 μg / 2 mL唾液。
产品特点:1. 非侵入性采检方式免除了抽血的疼痛和降低了污染风险,并增加了取检的便利性,可由受检者自行取样。
2. 仅需2ml的唾液样本,即可取得约110μg的DNA(不同个体产量差异很大)。
3. 采样后的检体可稳定地储存于室温环境一年以上。
唾液样品收集步骤:1. 用清水漱口1~2次,然后吐掉。
2. 漱口后等候至少5分钟方可采集唾液,期间不要进食、饮用各种饮料。
3. 将唾液(不是喉咙中痰液)吐到5ml 采集管中,直至2ml 刻度位置。
(不可将痰液吐到收集管中,若唾液不足,可做口舌运动,促进分泌。
浮在唾液上层的少量泡沫不包括计算在2ml唾液采集量内,采集过程必须在30分钟内完成)4. 将等体积2ml保存液全部倒在5ml唾液采集管中,充分颠倒混匀后旋紧盖子。
水体DNA提取实验方法1.取200ml 样品经0.22μm 的微孔滤膜过滤,将滤膜及过滤物在无菌条件下剪成1-2mm 的碎屑,放入Eppendorf 管中,加STET 缓冲液至满管,离心5分钟;2.小心去上清,向沉淀中加入1mL STET 缓冲液洗涤, 10000rpm 离心2min收集沉淀;3.用200μL STET 缓冲液重悬沉淀,将4μL 50mg/mL 的溶菌酶加到悬液中,室温放置(37℃)5min,然后置94℃水浴保温2min;5. 加入SDS 至终浓度为0.5%(10μL)和蛋白酶K 至终浓度为100μg/mL(1μL、20mg/ml),混合后置37℃水浴保温1h;6. 加入NaCl 溶液(20μL、5mol/L)至终浓度为0.5mol/L,充分混匀,再加入25μL 5% CTAB(十六烷基三乙基溴化铵),混合并置65℃水浴保温10min;7. 加入等体积(260μL,具体视情况而定)的饱和酚,混匀, 12000rpm 离心5min,将上清液转入另一洁净的 1.5mL Eppendorf 管中;8. 加入等体积酚/氯仿(V/V),混匀,12000rpm 离心5min,将上清液转入另一洁净的1.5mL Eppendorf 管中;9. 加入0.6倍异丙醇混匀,在4℃或者-20℃(老师建议4℃)放置(沉淀)1h 或过夜;10. 12000rpm 离心20min,小心吸出或者倒出异丙醇;11. 用500μL 70%冷乙醇洗涤沉淀,12000rpm 离心5min 收集沉淀;12. 小心吸出或者倒出乙醇,然后在吸水纸上倒置使残余乙醇流尽,空气干燥10-15 min,以便表面乙醇挥发,注意不要使沉淀完全干燥;13. 加入30μL无菌双蒸水(ddH2O),用微量移液器吹吸,混合至DNA 充分溶解;14. 将DNA 溶液存放于-20℃,不可使用自动除霜冰箱,以避免DNA 反复冻融;药品准备1. STET 缓冲液:8%蔗糖,50mM Tris(pH 8.0),50mM EDTA,0.1% Tween-20;2. 50mg/mL 溶菌酶;蛋白酶K3. 10% SDS;5mol/L NaCl;5% CTAB(十六烷基三乙基溴化铵);。
一种水环境eDNA提取方法的建立随着环境DNA (Environmental DNA, eDNA) 技术的发展和应用,它逐渐成为水环境监测、物种调查和保护的重要工具之一。
eDNA是指生物在自然环境中释放的DNA片段,可以通过提取和分析这些DNA片段来检测环境中存在的生物物种和数量。
本文将介绍一种用于水环境的eDNA提取方法的建立。
第一步是水样的采集。
需在采集水样时避免任何污染源的接触,尽量使用消毒处理过的容器。
可以选择在水体中不同的深度和位置采集多个样本,以获得更全面的生物物种信息。
第二步是水样的预处理。
将采集的水样倒入离心管中,进行离心处理,通常离心速度为1000-5000×g,离心时间为10-15分钟。
离心后将上清液转移至新离心管中,去除水样中的悬浮颗粒物质,如植物碎屑、藻类等,可以通过滤膜或离心方法进行。
第三步是eDNA的提取。
常用的提取方法包括CTAB法、硅胶膜法和商业化试剂盒法等。
这里以商业化试剂盒法为例进行介绍。
将上清液倒入离心管中,加入试剂盒中提供的DNA提取试剂,并进行充分混匀。
然后,将混合液转移至离心柱中,离心柱用于固定DNA,并去除其中的污染物。
离心后将底部的提取液收集至新的离心管中。
第四步是质量检测。
通过检测提取的eDNA的浓度和纯度,可以判断提取的质量。
常用的检测方法包括紫外分光光度计检测和凝胶电泳检测。
紫外分光光度计检测可以快速测定eDNA的浓度和纯度,而凝胶电泳检测可以检测eDNA的大小和完整性。
最后一步是储存和保存提取的eDNA样品。
提取的eDNA样品可以在-20°C或更低的温度下长期保存,以保持DNA的稳定性和完整性。
该提取方法的建立可以为水环境中生物物种的检测和监测提供快速、准确和高通量的工具。
通过提高提取方法的灵敏度和特异性,可以实现更全面和精确的水环境监测和物种调查。
还可以结合其他分子生物学技术,如PCR和测序等,进行更深入的研究和分析。