通用基因组DNA提取试剂盒使用说明
- 格式:pdf
- 大小:106.38 KB
- 文档页数:4

基因组DNA 提取试剂盒使用说明书此说明书仅适用于此说明书仅适用于基因组基因组DNA 提取试剂盒提取试剂盒,,使用前请务必仔细阅读说明书有关内容使用前请务必仔细阅读说明书有关内容,,若有任何疑问若有任何疑问,,欢迎致电厦门欢迎致电厦门致致善生物科技有限公司生物科技有限公司((4006618810*************)进行咨询进行咨询,,您也可以登录我们公司的网站您也可以登录我们公司的网站(( )了解相关信息或者通过E-mail ( ****************) 与我们进行沟通与我们进行沟通。
一 产品简介基因组DNA 提取试剂盒采用本公司自行研制的磁珠,用于从抗凝全血、新鲜或冻存组织、培养细胞、石蜡包埋组织、唾液、培养细菌等一系列不同样品中分离、纯化高质量的基因组DNA。
我们根据磁珠的独特分离作用,提供了一个极其简便的操作程序:样品裂解、磁珠吸附、洗涤以及洗脱。
在最适的试剂及操作条件下,可获得高质量DNA。
该方法具有简便、快捷、高效等特点,整个提取过程无须使用苯酚、氯仿等有机溶剂。
品名规格 货号 基因组DNA 提取试剂盒100T 4hk001裂解液DL 120ml ×2 磁粒 40ml 洗涤液 50ml ×5 洗脱液 45ml 缓冲液HTL 20ml ×1 二硫苏糖醇(DTT ) 10管,0.18g/管 说明书 1份储存条件储存条件::本试剂盒所有试剂(除DTT 外)均可以室温保存,应避免阳光直射。
当室温低于15℃时,裂解液中可能有结晶析出,38℃水浴加热几分钟,恢复澄清后即可使用,提取效率不受影响。
DTT 需要于冰箱4℃保存。
本试剂盒有效期为12个月, 请于有效期内使用。
安全信息:试剂中含刺激性化合物,操作时应小心,避免沾染皮肤,眼睛和衣服,若沾染皮肤、眼睛时,要立即用大量清水或生理盐水冲洗,必要时寻求医疗咨询。
三 使用者自配试剂DTT 溶液使用浓度为1mol/L 。

全血基因组DNA提取试剂盒使用说明一、试剂盒组成及存储条件:1.试剂盒包括蛋白酶K、缓冲液、洗涤缓冲液、脱水溶液等。
2.试剂盒应存放在4℃以下避光干燥处,避免冻结。
二、实验前准备:1.准备所需的实验耗材和设备,如离心管、恒温振荡器、离心机等。
2.取出全血样品,可以是新鲜全血或已离心制备的全血细胞。
三、DNA提取步骤:1.取出全血样品,用洗涤液洗涤细胞沉淀并离心收集,去除红细胞。
2.加入蛋白酶K将细胞裂解,释放DNA。
3.加入缓冲液和脱水溶液,沉淀DNA并洗涤。
4.最终稀释DNA并保存在适当的条件下。
四、实验注意事项:1.操作过程中需注意无菌操作,避免污染。
2.加入蛋白酶K的量应准确控制,不要过多或过少。
3.混合溶液时需轻轻摇匀,避免气泡的产生。
4.稀释保存DNA时,需使用无核酸酶的载体溶液,如TE缓冲液。
五、质控及结果分析:1.可以通过琼脂糖凝胶电泳或比色法检测提取的DNA质量。
2.检测DNA浓度和纯度,确保提取的DNA适用于后续实验。
3.可以保存提取好的DNA样品,以备后续实验使用。
六、应用领域:1.该试剂盒适用于从全血样品中提取DNA,可用于基因分析、疾病诊断、遗传研究等领域。
2.可以用于个体基因检测、种群遗传学研究、药物反应性研究等。
总结:全血基因组DNA提取试剂盒是用于从全血样品中提取DNA的重要工具,操作简便、提取效率高。
在实验中需注意操作规范,保证提取的DNA质量和纯度。
该试剂盒广泛应用于科研领域,为基因研究和临床诊断提供了有力支持。
希望上述使用说明能够帮助用户正确、高效地使用全血基因组DNA提取试剂盒。

DNAzol 基因组DNA快速提取试剂目录号:DN26目录编号包装单位DN2601 50mlDN2602 100ml❖产品介绍:DNAzol 是一种完全的、可直接使用的基因组DNA提取试剂,简单高效,结果可靠,可快速提取基因组DNA,适用于多种大量或少量样品。
DNAzol 可在一个步骤中裂解细胞并水解RNA,经过乙醇沉淀后即可快速得到基因组DNA。
整个过程只需10-30 分钟,DNA 回收率可达70-100%,得到的DNA 不需再纯化,可直接用于Southern 杂交、斑点杂交、分子克隆、PCR 反应和其他分子生物学应用。
❖产品储存:室温保存至少一年。
❖注意事项:DNAzol 有毒害性,应避免直接接触皮肤和眼睛。
❖操作步骤:(实验前请先阅读注意事项)1.裂解,匀浆a.组织:25-50mg 组织加1ml DNAzol ,使用匀浆仪处理5-10 次。
少量(5-10mg)柔软组织,如脾或脑组织,可切成或者捣成小块使用微量取样器吹打混匀,室温放置5-10 分钟。
b.细胞:单层培养的细胞应直接裂解,倒出培养基,加入DNAzol 用取样器吹打几次混匀。
每10cm2 细胞培养板加0.75-1.0ml DNAzol。
c.细胞沉淀或悬浮液:每1-3×107细胞(体积小于0.1ml)加1ml DNAzol,反复吹打混匀。
以上均要使用大口径枪头吹打,以免过度剪切断基因组。
2.离心4 -25℃,10000g 离心10 分钟。
将得到的上清转入新管。
此步骤去除组织碎片、部分水解的RNA和多糖。
如果所提样品为含较多细胞和细胞外物质的样品,如肝、肌肉和大部分植物组织等,或要提取不含RNA 的DNA 时,可加此步骤。
其他样品可省略此步。
3.沉淀每使用1ml DNAzol 加0.5ml 100%乙醇,颠倒离心管5-8 次,混匀样品至出现DNA 沉淀,室温放置1-3分钟。
可以看见DNA 絮状沉淀,让沉淀自然沉降到管底,尽可能吸弃上清。


北京索莱宝科技有限公司通用基因组DNA提取试剂盒使用说明书货号:D2100规格:50T/100T保存:室温(15℃-25℃)干燥保存,复检期12个月,2℃-8℃保存时间更长。
开封后请将RNase A,蛋白酶K于-20℃保存。
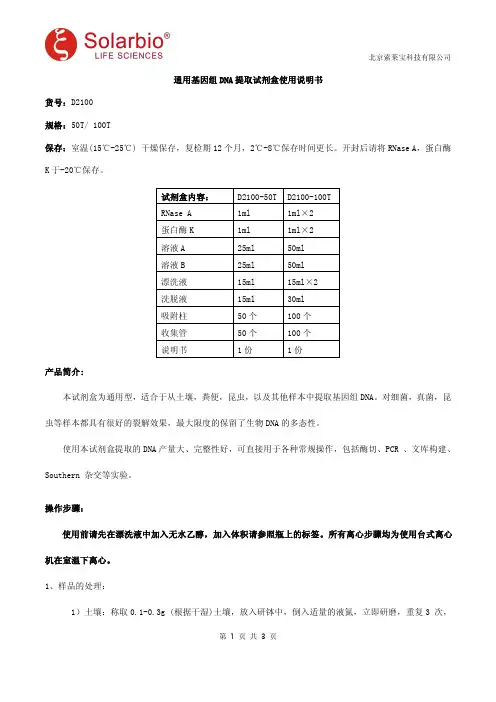
试剂盒内容:D2100-50T D2100-100TRNase A1ml1ml×2蛋白酶K1ml1ml×2溶液A25ml50ml溶液B25ml50ml漂洗液15ml15ml×2洗脱液15ml30ml吸附柱50个100个收集管50个100个说明书1份1份产品简介:本试剂盒为通用型,适合于从土壤,粪便,昆虫,以及其他样本中提取基因组DNA。
对细菌,真菌,昆虫等样本都具有很好的裂解效果,最大限度的保留了生物DNA的多态性。
使用本试剂盒提取的DNA产量大、完整性好,可直接用于各种常规操作,包括酶切、PCR、文库构建、Southern杂交等实验。
操作步骤:使用前请先在漂洗液中加入无水乙醇,加入体积请参照瓶上的标签。
所有离心步骤均为使用台式离心机在室温下离心。
1、样品的处理:1)土壤:称取0.1-0.3g(根据干湿)土壤,放入研钵中,倒入适量的液氮,立即研磨,重复3次,第1页共3页使土壤颗粒研成粉末,加500ul溶液A,振荡至彻底悬浮。
2)粪便:称取0.1-0.3g(根据干湿)粪便,加500ul溶液A,振荡至彻底悬浮。
3)昆虫:称取0.1-0.3g昆虫,倒入适量的液氮,立即研磨,重复3次,使昆虫研成粉末,加500ul 溶液A,振荡至彻底悬浮。
4)未知样品,如为细未状,可直接称取0.1-0.3g(根据干湿)加500ul溶液A,如为块状,可0.1-0.3g 用液氮研磨成粉未,再加500ul溶液A,振荡至彻底悬浮。
2、向悬浮液中加入20ul的RNase A(10mg/ml),55℃放置10min。
3、加入20ul的蛋白酶K(10mg/ml),充分混匀,55℃水浴消化,30min。
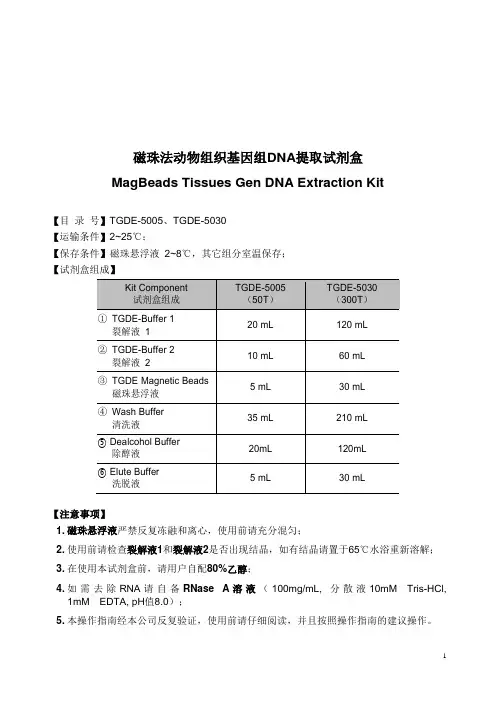
磁珠法动物组织基因组DNA提取试剂盒MagBeads Tissues Gen DNA Extraction Kit【目录号】TGDE-5005、TGDE-5030【运输条件】2~25℃;【保存条件】磁珠悬浮液2~8℃,其它组分室温保存;【试剂盒组成】【注意事项】1. 磁珠悬浮液严禁反复冻融和离心,使用前请充分混匀;2. 使用前请检查裂解液1和裂解液2是否出现结晶,如有结晶请置于65℃水浴重新溶解;3. 在使用本试剂盒前,请用户自配80%乙醇;4. 如需去除RNA请自备RNase A溶液(100mg/mL, 分散液10mM Tris-HCl,1mM EDTA, pH值8.0);5. 本操作指南经本公司反复验证,使用前请仔细阅读,并且按照操作指南的建议操作。
磁珠法·自动化:为生命科学提供自动化磁纳米捕获方案【产品简介】本产品适用于从各种动物组织以或者细胞样本中提取基因组DNA。
试剂盒采用具有独特分离作用的纳米磁珠和独特的缓冲液系统。
特殊技术包埋的纳米磁珠在特定条件下对核酸具有极强的亲和力,而当条件改变时可以释放所吸附的核酸,从而达到快速分离纯化核酸的目的。
本试剂盒提取所得基因组DNA产物得量高、纯度好,适用于各种下游分子生物学实验,如:酶切、PCR、QPCR、文库构建、Southern 杂交、芯片检测和高通量测序等。
本试剂盒可配合核自动化酸提取仪或工作站使用,实现高通量操作。
【试剂盒说明】【自备仪器、耗材及试剂】仪器自动版研钵(或组织研磨机、匀浆机)、英芮诚ETP-300型全自动核酸提取仪、核酸提取仪配套用磁棒套、水浴锅或金属浴、涡旋振荡仪、96孔方孔圆底板、80%乙醇、异丙醇、液氮。
手动版研钵(或组织研磨机、匀浆机)、水浴锅或金属浴、涡旋振荡仪、真空干燥箱、80%乙醇、异丙醇、2.0mL离心管、离心管配套用磁力架、液氮。
【仪器自动版操作步骤】本操作以英芮诚ETP-300型全自动核酸提取仪为例,同步可完成32个样本的提取。
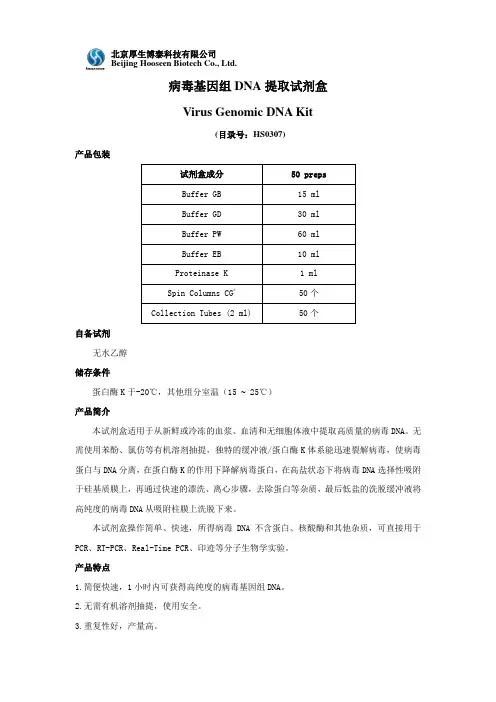
病毒基因组DNA 提取试剂盒Virus Genomic DNA Kit(目录号:HS0307)产品包装自备试剂无水乙醇储存条件蛋白酶K 于-20℃,其他组分室温(15 ~ 25℃)产品简介本试剂盒适用于从新鲜或冷冻的血浆、血清和无细胞体液中提取高质量的病毒DNA 。
无需使用苯酚、氯仿等有机溶剂抽提,独特的缓冲液/蛋白酶K 体系能迅速裂解病毒,使病毒蛋白与DNA 分离,在蛋白酶K 的作用下降解病毒蛋白,在高盐状态下将病毒DNA 选择性吸附于硅基质膜上,再通过快速的漂洗、离心步骤,去除蛋白等杂质,最后低盐的洗脱缓冲液将高纯度的病毒DNA 从吸附柱膜上洗脱下来。
本试剂盒操作简单、快速,所得病毒DNA 不含蛋白、核酸酶和其他杂质,可直接用于PCR 、RT-PCR 、Real-Time PCR 、印迹等分子生物学实验。
产品特点1.简便快速,1小时内可获得高纯度的病毒基因组DNA 。
2.无需有机溶剂抽提,使用安全。
3.重复性好,产量高。
北京厚生博泰科技有限公司 Beijing Hooseen Biotech Co., Ltd.4.所得病毒DNA纯度高,无污染物和抑制剂,方便下游应用。
注意事项1.血清或血浆避免反复冻融,否则会使蛋白变性或产生沉淀,导致提取的DNA片段小,提取量下降。
2.如缓冲液Buffer GB、Buffer GD结晶或产生沉淀,可在56℃水浴溶解。
3.所有离心步骤均为室温下操作。
操作步骤1. 取1.5 ml离心管(自备),加入20 ul的Proteinase K溶液。
2. 向离心管中加入200 ul血清或血浆,然后再加入200 ul Buffer GB,涡旋震荡15 sec。
(注意:1、样本体积不足200 ul可以加入0.9% NaCl(自备)补足。
2、为确保样本有效裂解,加入Buffer GB后,需将样本与Buffer GB充分混匀。
)3.56℃孵育15 min,短暂离心,将管壁上的溶液收集到管底。

一、试剂盒打开后需要准备的工作1、ProteinaseK(蛋白酶K)的溶解①取4.5ml双蒸水加入蛋白酶K粉中使其充分溶解②将溶解好的蛋白酶K溶液分装进小离心管,每管100u l〜200ul③将分装好的ProteinaseK放入-20°C冰箱中保存,使用期限为12个月2、组织抑制剂(InhibitorRemovalbfer)的调配加入20ml无水乙醇(absoluteethanol)颠倒混匀并在空白方框处打钩3、洗液(washbuffer)的调配加入80ml无水乙醇(absoluteethanol)颠倒混匀并在空白方框处打钩二、组织DNA提取(试剂盒)1、组织样品处理与消化①将采集来的样品剪碎(WO.lcm)洗净保存液。
②加入组织破解液Tissue-lysis200ul蛋白酶K40ul然后放入55C水浴锅内3个小时使其充分消化。
2、DNA提取①在消化好的组织样品中加入结合液bindingbuffer200ul然后放入70°水浴锅中10分钟。
②再加异丙醇lOOul混合均匀吸取上清液放入柱体中,然后离心8000g—分钟。
③倒掉底液,加500ul组织抑制剂InhibitorRemoval然后离心倒掉底液④加洗液washingbuffer500ul离心(洗液加两次)⑤在70C预热ElutionBuffer,然后将洗好的柱体下部分丢掉,换新的离心管加入ElutionBuffer200ul溶解10分钟离心保留底液放-20C保存。
三、细胞DNA的提取(试剂盒)1、组织样品处理与消化①将带有培养基的样品用PBS清洗干净8000rpm/1min离心,倒掉上清②加PBS200ul振荡摇匀使之样品成为单个细胞的悬浊液③加200ulBindingBuffer,40ul蛋白酶K混合均匀放入70C水浴锅内消化10分钟。
2、DNA提取①加异丙醇lOOul混合均匀吸取上清液放入柱体中,然后离心8000g—分钟。

全血基因组DNA提取试剂盒使用说明DNA提取是生物学、遗传学和分子生物学等领域的一项重要实验操作。
全血基因组DNA提取试剂盒是用于从全血样本中提取DNA的试剂盒,本文将详细介绍其使用说明。
一、试剂准备:1.预先将试剂盒从-20℃的冷冻器中转移到4℃的冰箱中解冻,取出所需试剂。
2.将试剂A和试剂B随机摇匀,避免沉淀的产生。
二、样本处理:1.取出需要提取DNA的全血样本,将其加入离心管中。
2.加入适量的蒸馏水和样本量相等体积的10%梳酸混匀,使血细胞溶解。
三、样本裂解:1.准备离心管和4℃的离心机。
2.加入适量的样本处理试剂(试剂A和试剂B),混匀离心管。
4.将裂解后的样本置于冰上放置10分钟。
四、DNA纯化:1.准备离心管和4℃的离心机。
2.将样本离心管中的上清转移至新的离心管中,并加入适量的试剂C,混匀并置于冰上放置5分钟。
4.弃去上清,避免悬浮细胞的干扰。
五、脱脂:1.准备脱脂离心管和4℃的离心机。
2.加入适量的试剂D,混匀离心管,置于冰上放置5分钟。
4.弃去上清,避免沉淀的干扰。
六、洗涤:1.准备洗涤离心管和4℃的离心机。
2.加入适量的试剂E和试剂F,混匀离心管,置于冰上放置5分钟。
4.弃去上清,避免沉淀的干扰。
七、DNA溶解:1.准备离心管和4℃的离心机。
2.加入适量的试剂G,混匀并置于冰上放置5分钟。
八、DNA浓缩:1.准备离心管和4℃的离心机。
2.加入适量的试剂H,混匀离心管,置于冰上放置5分钟。
4.弃去上清,避免纯化后的DNA丢失。
九、DNA溶解:1.加入适量的蒸馏水,混匀使DNA溶解。
十、质检:1.准备质检相关设备和试剂。
2.使用紫外分光光度计检测DNA纯度和浓度。
3.对提取的DNA进行PCR扩增、酶切鉴定等质检步骤。
以上就是全血基因组DNA提取试剂盒的使用说明,希望对您在实验中提取DNA有所帮助。
在操作中,请严格按照试剂盒说明书和实验室操作规范进行操作,确保实验的准确性和可重复性。

细菌基因组DNA提取试剂盒目录号:DN12目录编号包装单位DN1201 50次DN1202 100次DN1203 200次❖适用范围:适用于快速提取各种细菌基因组DNA❖试剂盒组成、储存、稳定性:试剂盒组成保存50次100次200次细胞核裂解液室温30 ml 60 ml 120 ml蛋白沉淀液室温10 ml 20 ml 40 mlDNA溶解液室温10 ml 15ml 30 mlRNase A(10mg/ml) -20℃150μl250μl400μl本试剂盒在室温储存12个月不影响使用效果。
储存事项:1.环境温度低时细胞核裂解液中某些去污剂成份会析出出现浑浊或者沉淀,可在37℃水浴加热几分钟,轻轻旋摇,即可恢复澄清,不要剧烈摇晃,以免形成过量的泡沫。
2.蛋白沉淀液可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,如果不能完全溶解,也不影响使用效果,直接取用上层溶液即可。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
❖产品介绍:本试剂盒用于快速的从各种细菌中提取基因组DNA。
细菌样品加入细胞核裂解液(或者通过溶菌酶或者其它一些酶帮助裂解细胞壁后),首先在强去污剂作用下裂解细胞释放出基因组DNA,接着加入RNase A去除RNA,然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重溶解于DNA溶解液。
❖产品特点:1.不需要使用有毒的苯酚等试剂。
2.快速,简捷,单个样品操作一般可在30分钟内完成。
3.结果稳定,产量高,OD260/OD280典型的比值达1.7~1.9,长度可达50 kb -150kb,可直接用于构建文库,PCR,Southern-blot和各种酶切反应。
❖注意事项1.所有的离心步骤均在室温完成,使用转速可以达到13,000 rpm的传统台式离心机,如Eppendorf 5415C 或者类似离心机。
2.用户需自备异丙醇、70%乙醇、0.5M EDTA和Lysozyme(溶菌酶)(用于革兰氏阳性菌)、lysostaphin(用于某些难裂解的革兰氏阳性菌)、水浴箱。
细菌基因组DNA提取试剂盒使用说明本试剂盒可用于革兰氏阴性和阳性菌的基因组DNA提取,由细菌重悬液、裂解液、蛋白沉淀液以及DNA溶解液组成。
可从1-5ml菌液中提取基因组DNA。
整个提取过程不超过45分钟。
提取过程包括:1菌液离心,重悬。
2裂解菌体,释放基因组DNA。
3盐析沉淀蛋白,分离DNA。
4异丙醇沉淀脱盐并浓缩。
5 70%乙醇清洗,晾干并用DNA溶解液溶解。
本试剂盒采用复合裂解液,其中含有抑制DNA酶的成分,在加热(65°C)状态下,可保证完整的细菌基因组DNA的充分裂解释放,本试剂盒即可提取异丙醇沉淀时,罕见浑浊的蛋白质杂质的共沉淀。
提取的基因组可用于PCR扩增、内切酶消化以及膜杂交等。
一、试剂盒组成(本试剂盒提供的组份, 至少可提取100份1-5ml菌液基因组DNA的纯化,每种组份均有足够的富余量)1.复合裂解液:30ml×1瓶。
2.蛋白沉淀液:300ml×1瓶。
3.DNA溶解液:20ml×1瓶。
4.操作说明书一份。
二、本试剂盒未提供,须用户自备的试剂为:异丙醇,70%乙醇(国产分析纯)。
三、提取操作:1.菌液离心:取革兰氏阴性菌菌液1-2ml;或者革兰氏阳性菌菌液2-5ml,1000rpm离心1分钟。
2.加入细菌重悬液100ul,震荡使菌体重悬。
3.将复合裂解液置65°C水浴加热,使结晶成分溶解,每个细菌重悬液中分别加入300ul的复合裂解液。
4.混璇器震荡混匀10秒,置65°C水浴中反应10分钟(革兰氏阴性菌),20分钟(革兰氏阳性菌)。
5.各管中加入300ul蛋白沉淀液。
上下颠倒5-6次使两者混匀。
6.13000-16000×g, 离心3-5分钟。
7.将上清液转移至新的离心管中(注意:由于有些细菌含有多糖或者脂蛋白成分,离心后会出现细胞成分上浮的情况,此时取漂浮层下的均一透明液体),加入等体积异丙醇,此时可见透明的絮状物,混匀后离心,同步骤5,吸去上清。
细菌基因组DNA大量提取试剂盒使用说明一、试剂盒的组成和保存1. 试剂盒通常包含以下试剂:细菌裂解液、蛋白酶K、RNase A、乙酰乙酸钠、异丙醇、异待戊酸酒精和洗涤缓冲液等。
所有试剂均应在4℃保存,并避免光照。
2.打开试剂盒后,应将所有试剂恢复至室温后再进行实验。
二、细菌样品的准备1. 选择要提取DNA的细菌菌株,并以合适的培养基进行预培养,至菌液浓度达到0.5-1.0 McFarland标准。
通常需要提取500μl菌液。
2.将细菌菌液用低速离心(1,500×g,10分钟),倒掉上清液。
3. 用无菌PBS洗涤细菌沉淀物,将其转移到1.5ml离心管中,并用PBS以适量体积使菌液悬浮。
三、DNA提取1.加入500μl裂解液到离心管中,并充分混匀,然后孵育于65℃恒温水浴中30分钟。
期间轻轻摇荡离心管。
**注意:**为了最大限度地保证DNA提取效果,裂解液应充分混合,可以通过轻轻翻转离心管或用手轻轻转动溶液达到混匀的目的。
2. 在65℃恒温水浴中孵育结束后,加入50μl蛋白酶K和5μl RNase A,轻轻颠倒离心管以混匀。
3.再次将离心管放回65℃恒温水浴中孵育60分钟。
4.取出离心管,加入300μl异酸醇,轻轻颠倒离心管以混匀,然后在冰上静置5分钟。
5.离心管离心(12,000×g,5分钟,4℃),将上清液转移到新的离心管中。
6. 加入1ml异待戊酸酒精,轻轻颠倒离心管以混匀。
7.离心管离心(12,000×g,5分钟,4℃),将上清液倒掉。
8. 加入1ml 75%乙醇洗涤缓冲液,轻轻颠倒离心管以混匀。
9.离心管离心(12,000×g,5分钟,4℃),将上清液倒掉。
10.将离心管放置在80℃干燥箱中,使DNA片段溶于无菌水中。
四、DNA质量检测和存储1.使用比色计或荧光检测仪检测提取的DNA浓度和纯度。
2.将DNA保存在-20℃冷冻保存。
**注意事项:**1.实验操作过程中请严格遵守无菌操作规范,避免污染。
细菌基因组DNA快速提取试剂盒DN1101 50次DN1102 100次DN1103 200次DN1111 50次(带蛋白酶K) DN1112 100次(带蛋白酶K) DN1113 200次(带蛋白酶K)❖适用范围:适用于快速提取各种细菌基因组DNA❖试剂盒组成、储存、稳定性:试剂盒组成保存50次100次200次平衡液室温 5 ml 10 ml 20 ml 缓冲液RB 室温30 ml 60ml 120 ml 结合液CB 室温11 ml 20 ml 40ml 抑制物去除液IR 室温25 ml 50 ml 100 ml漂洗液WB 室温15 ml 25 ml 2x25 ml 第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温15 ml 20 ml 40 ml 蛋白酶K粉(可选)20mg/ml-20℃20mg 2×20mg 4×20mg 吸附柱AC 室温50个100个200个收集管(2ml)室温50个100个200个本试剂盒在室温储存12个月不影响使用效果。
储存事项:1.结合液CB或者抑制物去除液IR低温时可能出现析出和沉淀,可以在37℃水浴几分钟帮助重新溶解,恢复澄清透明后冷却到室温即可使用。
2.为避免降低活性,方便运输,提供蛋白酶K为冻干粉状,收到后,可短暂离心后,加入1毫升灭菌水溶解,因为反复冻融可能会降低酶活性,因此溶解后立即按照每次使用量(20微升)分装冻存,-20℃保存。
3.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
❖产品介绍:独特的结合液/蛋白酶K迅速裂解细胞和灭活细胞内核酸酶,然后基因组DNA在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤,抑制物去除液和漂洗液将细胞代谢物,蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净基因组DNA从硅基质膜上洗脱。
❖产品特点:1.离心吸附柱内硅基质膜全部采用进口世界著名公司特制吸附膜,柱与柱之间吸附量差异极小,可重复性好。
Page 1 of gSYNC TM 基因组DNA 提取试剂盒 仅供科研使用产品编号 GS100, GS300完整说明书(英文)下载如果您是第一次使用本产品或对本产品的操作步骤不熟悉,请您经由扫描QR code 下载并详阅完整说明书1. 处理材料 A. 动物组织 取最多25 mg 动物组织或0.5 cm 老鼠尾巴(若组织含有较多数量细胞,如胰脏及肝脏,组织用量应减 少为10 mg )转移到1.5 ml 微量离心管中. 加入200 μl 缓冲液GST 及20 μl Proteinase K (使用前依据标签加入适量体积ddH 2O ,充分摇动混匀),使 用涡旋振荡器振荡混匀,放置60ºC 消化过夜或直至组织溶解完全,溶液呈现清亮. 期间颠倒混匀样 品几次或使用水浴振荡器可帮助组织溶解. 注意:在此期间,将洗脱缓冲液EB 置于60ºC 预热(200 μl /样品). 以14-16,000×g 离心2分钟去除未溶解组织,取200 μl 上清液转移到新1.5 ml 微量离心管中. 加入200 μl 缓冲液GSB ,充分摇动混匀10秒钟.B. 血液 取200 μl 血液,血浆,血清或白血球衣转移到1.5 ml 微量离心管中(不足200 μl 可加缓冲液PBS 补足), 加入20 μl Proteinase K (使用前依据标签加入适量体积ddH 2O ,充分摇动混匀),使用移液器混合均匀, 在60ºC 放置5分钟. 加入200 μl 缓冲液GSB ,充分摇动混匀,在60ºC 放置5分钟,期间每2分钟颠倒混匀样品. 注意:在此期间,将洗脱缓冲液EB 置于60ºC 预热(200 μl /样品).C. 细胞 贴壁培养的细胞应先使用0.1-0.25% Trypsin in PBS 处理为细胞悬液. 取最多1X107细胞转移到1.5 ml 微量离心管中,300 ×g 离心5分钟. 吸去上清,向留有细胞沉淀的离心管中加入200 μl 缓冲液PBS ,使用移液器彻底悬浮细胞沉淀,加入 20 μl Proteinase K (使用前依据标签加入适量体积ddH 2O ,充分摇动混匀),使用移液器混合均匀,在 60ºC 放置5分钟. 加入200 μl 缓冲液GSB ,充分摇动混匀,在60ºC 放置5分钟,期间每2分钟颠倒混匀样品. 注意:在此期间,将洗脱缓冲液EB置于60ºC 预热(200 μl /样品).可选步骤:如果需要去除RNA ,可加入5 μl RNaseA (50 mg/ml )溶液,充分摇动混匀,室温放置5分钟.2. 吸附加入200 μl 无水乙醇,充分摇动混匀,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠. 将吸附柱GS 放入2 ml 收集管中. 将所得溶液和絮状沉淀都加入吸附柱GS 中,以14 -16,000×g 离心1分钟,丢弃收集管,将吸附柱放入新的收集管中.3. 漂洗向吸附柱GS 中加入400 μl 漂洗液W1,以14-16,000×g 离心30秒,倒掉收集管中的废液,将吸附柱放入收集管中. 向吸附柱GS 中加入600 μl 漂洗液Wash (使用前请先检查是否已加入无水乙醇),以14-16,000×g 离心30秒,倒掉收集管中的废液,将吸附柱GS 放入收集管中. 以14-16,000×g 离心3分钟将吸附柱中残余的漂洗液去除.注意:漂洗液中乙醇的残留会影响后续的酶反应(酶切,PCR 等)实验.4. 洗脱将吸附柱GS 放入一个干净的离心管中,向吸附膜中间位置悬空滴加50-200 μl 预热的洗脱缓冲液EB ,室温放置3分钟后,以14-16,000×g 离心1分钟收集DNA 溶液.注意:1. 为了增加DNA 回收率,可将得到的溶液重新加入吸附柱中,室温放置2分钟,以14-16,000×g 离心1分钟,将DNA 溶液收集到离心管中.2. 如果使用ddH 2O 做洗脱液,需保证其pH 值≥8.0, pH 值低于8.0会降低洗脱效率.Instruction Manual Download。
细菌基因组DNA快速提取试剂盒(溶液型)GK1061 50 次GK1062 100次一、试剂盒组成Components GK1061 GK1062Digestion Solution(a)Proteinase K(b)NaCl Solution CTAB/NaCl Solution(c) Boiled RNase A (10mg/ml)TE (pH8.0)Lysozyme(d)SP Buffer 18ml3mg6ml6ml240µl18ml30mg0.5ml36ml6mg12ml12ml480µl36ml60mg1.0ml二、实验前的准备(a) Digestion Solution低温时可能出现沉淀,请于55℃适当加温溶解后使用,不会影响实验结果。
首次使用时,将Boiled RNase A全部加入到Digestion Solution中,充分混匀备用,加完Boiled RNase A的Digestion Solution,请于4℃保存。
(b) Proteinase K使用前加入300µl (GK1061) 、600µl (GK1062)灭菌双蒸水,分装-20℃冻存。
不得将ProteinaseK直接加入到Digestion Solution中,以免酶失活。
(c) CTAB/NaCl Solution使用前需要65℃预热,便于溶解和取液。
(d) Lysozyme使用前加入500µl (GK1061) 或1ml (GK1062) SP Buffer,使Lysozyme全部溶解。
分装后-20℃冻存。
三、试剂盒说明本试剂盒用于快速的从各种细菌中提取基因组DNA。
细菌样品加入细胞核裂解液(或者通过溶菌酶或者其它一些酶帮助裂解细胞壁后),首先在强去污剂作用下裂解细胞释放出基因组DNA,接着加入RNase A去除RNA,然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组DNA通过异丙醇沉淀并重新溶解于DNA溶解液中。
通用基因组DNA提取试剂盒使用说明
货号:D2100
规格:50T/100T
保存:室温(15℃-25℃)干燥保存,复检期12个月,2℃-8℃保存时间更长。
开封后请将RNase A,蛋白酶K于-20℃保存。
试剂盒内容:D2100-50T D2100-100T
RNase A1ml1ml×2
蛋白酶K1ml1ml×2
溶液A25ml50ml
溶液B25ml50ml
漂洗液15ml15ml×2
洗脱液15ml30ml
吸附柱50个100个
收集管50个100个
说明书1份1份
产品简介:
本试剂盒为通用型,适合于从土壤,粪便,昆虫,以及其他样本中提取基因组DNA。
对细菌,真菌,昆虫等样本都具有很好的裂解效果,最大限度的保留了生物DNA的多态性。
使用本试剂盒提取的DNA产量大、完整性好,可直接用于各种常规操作,包括酶切、PCR、文库构建、Southern杂交等实验。
操作步骤:
使用前请先在漂洗液中加入无水乙醇,加入体积请参照瓶上的标签。
所有离心步骤均为使用台式离心机在室温下离心。
1、样品的处理:
1)土壤:称取0.1-0.3g(根据干湿)土壤,放入研钵中,倒入适量的液氮,立即研磨,重复3次,使土壤颗粒研成粉末,加500ul溶液A,振荡至彻底悬浮。
2)粪便:称取0.1-0.3g(根据干湿)粪便,加500ul溶液A,振荡至彻底悬浮。
3)昆虫:称取0.1-0.3g昆虫,倒入适量的液氮,立即研磨,重复3次,使昆虫研成粉末,加500ul溶液A,振荡至彻底悬浮。
4)未知样品,如为细未状,可直接称取0.1-0.3g(根据干湿)加500ul 溶液A,如为块状,可0.1-0.3g用液氮研磨成粉未,再加500ul溶液A,振荡至彻底悬浮。
2、向悬浮液中加入20ul10mg/ml的RNase A,55℃放置10min。
3、加入20ul10mg/ml的蛋白酶K,充分混匀,55℃水浴消化,30min。
消化期间可颠倒离心管混匀数次,12000转离心10min。
将上清转移到一个新的离心管中。
如有沉淀,可再次离心。
4、加入500ul溶液B,充分混匀。
如出现白色沉淀,于55℃放置5min,沉淀即会消失,不影响后续实验。
如溶液未变清亮,说明样品消化不彻底,可能导致提取的DNA量少及不纯,还有可能导致上柱后堵柱子,请增加消化时间。
5、加入500ul无水乙醇,充分混匀,此时可能会出现絮状沉淀,不影响DNA的提取,可将溶液和絮状沉淀都加入吸附柱中,放置2min(分两次加入,每次700ul)。
6、12000rpm离心2min,弃废液,将吸附柱放入收集管中。
7、向吸附柱中加入700ul漂洗液(使用前请先检查是否已加入无水乙醇),12000rpm离心1min,弃废液,将吸附柱放入收集管中。
8、向吸附柱中加入500ul漂洗液,12000rpm离心1min,弃废液,将吸附柱放入收集管中
9、12000rpm离心2min,将吸附柱置于室温或50℃温箱放置数分钟,目的是将吸附柱中残余的漂洗液去除,否则漂洗液中的乙醇会影响后续的实验如酶切、PCR等。
10、将吸附柱放入一个干净的离心管中,向吸附膜中央悬空滴加50-200ul经65℃水浴预热的洗脱液,室温放置5min,12000rpm离心2min。
11、离心所得洗脱液再加入吸附柱中,室温放置2min,12000rpm离心2min,即可得到高质量的基因组DNA.。
注意事项:
1、由于样品不同,最终提取的DNA含量和纯度也有所不同,一般来说,如果所提取DNA用电泳的方法检测不到,PCR会有结果,样品尽可能的新鲜。
否则会导致提取的DNA片段较小且提取量也下降。
2、若试剂盒中的溶液出现沉淀,可在65℃水浴中重新溶解后再使用,不影响提取效果。
3、如果样品消化不彻底,后面的离心步骤中可能会出现堵柱子的情况,
可适当延长离心时间。
4、洗脱缓冲液的体积最好不少于50ul,体积过小会影响回收效率;洗脱液的pH值对洗脱效率也有影响,若需要用水做洗脱液应保证其pH值在8.0左右(可用NaOH将水的pH值调至此范围),pH值低于7.0会降低洗脱效率;DNA产物应保存在-20℃,以防DNA降解。
5、DNA浓度及纯度检测(浓度较高时):得到的基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。
回收得到的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。
DNA应在OD260处有显著吸收峰,OD260值为1相当于大约50μg/ml双链DNA、40μg/m l 单链DNA。
OD260/OD280比值应为 1.7-1.9,如果洗脱时不使用洗脱缓冲液,而使用去离子水,比值会偏低,因为pH值和离子存在会影响光吸收值,但并不表示纯度低。
相关试剂:
D10106×DNA Loading Buffer
T106050×TAE缓冲液
T10505×TBE缓冲液
M1060D2000DNA Ladder
M14001kb DNA Ladder
G8142GoldView II型核酸染色剂(5000×)。