物质的转化-人教版高中化学必修1讲义
- 格式:doc
- 大小:506.50 KB
- 文档页数:8

第一章物质及其变化一、物质的分类及转化1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!2.酸性氧化物与碱性氧化物的理解(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
(只有“碱金”这一组关系是一定的!)②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
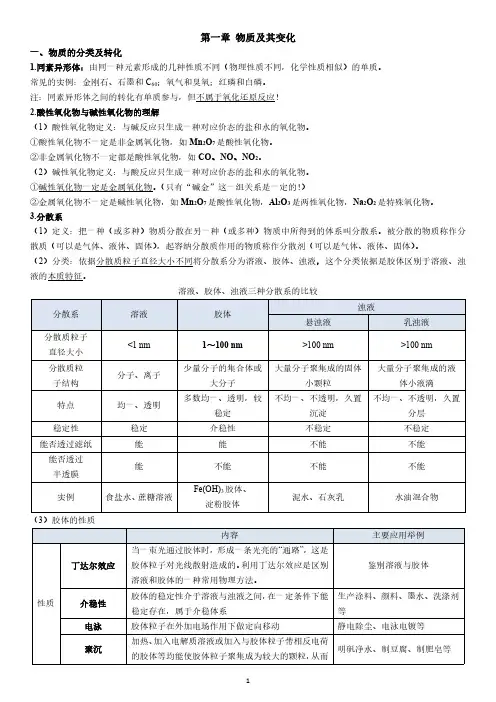
3.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较(3)胶体的性质形成沉淀从分散剂中析出提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜,用此法将胶体提纯用于分离溶液和胶体(4)胶体部分易错归纳①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
④电泳现象是由于胶体粒子吸附溶液中的离子而带电,通电后胶体粒子定向移动,所以并非所有胶体都有电泳现象(如淀粉胶体)。
(5)Fe(OH)3胶体的制备在小烧杯中,加入40mL蒸馏水,加热至沸腾,向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,立即停止加热,即可得到Fe(OH)3胶体,整个过程不能搅拌。


第02讲物质的转化知识导航知识精讲一、酸、碱、盐的性质1. 酸的通性(以盐酸为例)(1)与指示剂反应:使紫色石蕊试剂变红,不能使酚酞试剂变色(2)能与较活泼的金属发生置换反应,放出H2:6HCl + 2Al === 2AlCl3 + 3H2↑(3)能与金属氧化物反应:6HCl + Fe2O3 === 2FeCl3 + 3H2O(4)能与碱反应生成盐和水(中和反应):HCl + NaOH === NaCl + H2O(5)能与某些盐反应:2HCl + CaCO3 === CaCl2 + H2O + CO2↑2. 碱的通性(以烧碱为例)(1)与指示剂作用:紫色石蕊变蓝,无色酚酞变红(2)与非金属氧化物反应:2NaOH+ CO2 === Na2CO3 + H2O(氢氧化钠必须密封保存)(3)与酸发生中和反应:HCl + NaOH === NaCl + H2O;(4)能与某些盐反应:2NaOH + MgCl2 === Mg(OH)2↓ + 2NaCl3. 盐的通性(1)盐+ 金属→ 新金属+ 新盐:CuSO4 + Zn==== Cu + ZnSO(2)盐+ 酸→ 新盐+ 新酸:CaCO3 +2HCl ==== CaCl2 + H2O + CO2↑(3)盐+ 碱→ 新碱+ 新盐:MgCl2 + 2NaOH ==== Mg(OH)2↓ + 2NaCl(4)盐+ 盐→ 新盐+ 新盐:NaCl + AgNO3 ==== AgCl ↓+ NaNO3二、化学反应类型1. 按照生成物、反应物的种类和数目,化学反应可分为:_________________________________________2. 按照物质是否得氧或失氧,化学反应可分为:____________________________________【答案】化合反应分解反应置换反应复分解反应三、物质的转化关系物质间的转化一般可以按照下列思路进行考虑:(1)金属及其化合物的转化:金属单质→金属氧化物→碱→盐。

第一章物质及其变化第一节物质的分类及转化一、物质分类1、根据物质的组成和性质分类任何物质都是有元素组成的,根据元素组成对物质进行分类是常用的方法。
(1)同素异形体:由一种元素形成的几种性质不同的单质。
如:金刚石和石墨、白磷(P4)和红磷、氧气和臭氧【注】①同素异形体之间的转换是化学变化。
②同素异形体之间由于结构不同,物理性质有差异,但由于同种元素组成,化学性质相似或略有差异。
③由一种元素组成的物质不一定是纯净物。
如氧气和臭氧。
2、分类方法(1)树状分类:对同类事物进行再分类的方法。
单质:O2、Fe、He等纯净物有机化合物:CH4、葡萄糖、酒精(乙醇)等酸:电离出的阳离子全部是氢离子化合物碱:电离出的阴离子全部是氢氧根无机化合物物质盐:由金属阳离子或NH4+与酸根离子结合氧化物:只含两种元素,其中一种是氧元素溶液:NaCl溶液、稀硫酸等混合物胶体:Fe(OH)3胶体、淀粉胶体等浊液:泥水【注】冰水混合物、胆矾、明矾、水银等并非混合物,均为纯净物。
①酸的分类:酸可依据电离出氢离子的个数,将酸分为一元酸、二元酸、多元酸。
也可按照酸分子中是否含氧元素,将酸分为含氧酸和无氧酸。
一元酸:HCl、HNO3、CH3COOH等含氧酸:HNO3、、H2SO4等酸二元酸:H2CO3、H2SO4等酸多元酸:H3PO4无氧酸:HCl、H2S等②碱的分类:可依据电离出OH-的个数,将酸分为一元碱、二元碱、多元碱。
也可按照溶解性,将碱分为可溶性碱、难溶性碱。
一元碱:NaOH、NH3·H2O 可溶性碱:NaOH、Ba(OH)2等碱二元碱:Mg(OH)2、Cu(OH)2 碱多元碱:Fe(OH)3、Al(OH)3 难溶性碱:Mg(OH)2、Cu(OH)2 等③盐的分类正盐:既不能电离出H+,也不能电离出OH-的盐,如Na2CO3、CuSO4盐酸式盐:酸根能电离出H+的盐,如NaHCO3、NaHSO4碱式盐:能电离出OH-的盐,如Cu2(OH)2CO3④氧化物的分类:依据氧化物的性质,可将氧化物分为酸性氧化物、碱性氧化物、两性氧化物及不成盐氧化物。


第一章 物质及其变化 第一节物质的分类及转化 第2讲 物质的转化【讲】知识点1酸碱盐的性质 (1)酸的性质 ①酸:H ++酸根离子 按强弱分:常见的强酸:盐酸、硫酸、硝酸等常见的弱酸:碳酸、亚硫酸、磷酸、醋酸、亚硝酸、硫化氢等按有无氧分: 常见的含氧酸: 常见的无氧酸:按有无挥发性(沸点高低)分: 常见的挥发性酸: 常见的非挥发性酸:②酸具有相似化学性质的原因:从微观角度来看,不同的酸溶液中都含有H +。
③酸的通性酸⎩⎪⎨⎪⎧+酸碱指示剂,如使紫色石蕊溶液变红色+活泼金属―→盐+氢气(置换反应)⎭⎬⎫+碱性氧化物―→盐+水+碱―→盐+水+盐―→新酸+新盐复分解反应例如:(2)碱的性质①碱:金属阳离子+OH -及一水合氨 按强弱分类常见的强碱: 氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡等 常见的弱碱:一水合氨、氢氧化铁、氢氧化铜等按溶解性分类 常见的可溶性碱: 常见的不可溶性碱:②碱具有相似化学性质的原因:从微观角度来看,不同的碱溶液中都含有OH -。
③碱的通性碱⎩⎪⎨⎪⎧+酸碱指示剂,如使酚酞溶液变红色⎭⎬⎫+酸性氧化物―→盐+水+酸―→盐+水+盐―→新碱+新盐复分解反应(3)盐的性质①盐:金属阳离子(铵根离子)+酸根离子 可溶性盐:氯化钠、硝酸钾等 不可溶性盐:硫酸钡、氯化银等②同一类盐具有相似化学性质的原因:从微观角度来看,组成上含有相同阴离子或阳离子。
③盐的通性盐⎩⎨⎧⎭⎬⎫+酸→新盐+新酸+碱→新盐+新碱+盐→新盐+新盐复分解反应 特别提醒 盐与盐、盐与碱能反应的条件一般要求二者都可溶。
【练】1.将下列各组物质按酸、碱、盐的分类依次排列,正确的是( )A .硫酸、纯碱、石膏B .硫酸、烧碱、胆矾C .硫酸氢钠、生石灰、醋酸钠D .磷酸、熟石灰、苛性钠 答案 B解析 硫酸属于酸,纯碱是Na 2CO 3,属于盐,石膏属于盐,A 错误;硫酸属于酸,烧碱是NaOH ,属于碱,胆矾是五水硫酸铜,属于盐,B 正确;硫酸氢钠属于盐,生石灰属于氧化物,醋酸钠属于盐,C 错误;磷酸属于酸,熟石灰属于碱,苛性钠是NaOH ,属于碱,D 错误。

物质的转化1.认识同类物质具有相似的化学性质,在一定条件下各类物质可以相互转化。
2.知道通过化学反应可以探究物质的性质,实现物质的转化。
3.应用分类法建立各类物质的转化模型。
自主梳理一、酸、碱、盐的性质1.同类物质往往具有___________的性质,如硫酸、盐酸等酸,NaOH、KOH、Ca(OH)2等碱,各具有相似的性质。
2.不同的酸、碱具有相似的化学性质,是因为它们在_______________具有相似性。
从微观角度看,不同的酸溶液中都含有________,不同的碱溶液中都含有________。
3.从反应类型看,已学的酸与金属、盐与金属的反应,都属于__________________,酸与碱、盐与酸、盐与盐之间的反应,都属于____________________。
二、物质的转化根据物质的组成和性质,通过__________________可实现物质之间的转化。
在化学变化过程中,元素是________________,这时考虑如何物质之间的转化时最基本的依据。
一.1.相似组成上2.H+OH-3.置换反应复分解反应二、化学变化不会改变的预习检测1.(2022年河南省郑州市中牟县期中)下列各组内物质的转化,只通过一步反应不能完成的是A.Zn→H2B.CaO→CaCl2C.CO2→CaCO3D.Cu→Cu(OH)2【答案】D【解析】A项,锌和稀硫酸反应生成氢气,Zn+H2SO4=ZnSO4+H2↑,不符合题意;B项,氧化钙和盐酸反应生成氯化钙和水,CaO+2HCl=CaCl2+H2O,不符合题意;C项,二氧化碳和氢氧化钙反应生成碳酸钙,Ca(OH)2+CO2=CaCO3↓+H2O,不符合题意;D项,铜与水或与碱等反应,不能一步生成氢氧化铜,符合题意。
2.(2022年江苏省扬州中学期中)金刚石硬度高、耐磨性好,可广泛用于切割、磨削、钻探等工业中。
700℃C+4NaCl。
该反应属于一种人造金刚石的生产方法为:4Na+CCl4=====A.化合反应B.复分解反应C.置换反应D.分解反应【答案】C700℃C+4NaCl可知,这是一个单质与化合物反应生成新的单质和【解析】根据反应方程式4Na+CCl4=====新的化合物的反应,符合置换反应的定义,所以属于置换反应,C项符合题意。


(新教材)人教版高中化学必修一第一章第1节《物质的分类及转化》优质说课稿今天我说课的内容是部编人教版(新教材)高中化学必修1第一章第1节《物质的分类及转化》。
第一章主要讲述物质及其变化。
世界是由物质构成的,目前人类发现和合成的物质已超过1亿种。
对于这么多的物质和更为丰富的化学变化,人们是怎样认识和研究的呢?分类是认识和研究物质及其变化的一种常用的科学方法。
通过分类,可以将纷繁复杂的物质分成不同的类别,还可以从离子、电子等微观视角揭示化学反应的规律。
依据物质类别和元素价态,可以解释和预测物质的性质,设计物质间的转化途径。
通过第一章学习,从宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知、科学探究与创新意识、科学态度与社会责任5个方面培养学生化学学科核心素养。
本章共有三节,本课是第一节,主要讲述物质的分类及转化,承载着实现本章教学目标的任务。
为了更好地教学,下面我将从课程标准、教材分析、教学目标和核心素养、教学重难点、学情分析、教学准备、教学方法、教学过程等方面进行说课。
一、说课程标准。
普通高中化学课程标准(2017版2020年修订):【内容要求】“2.1 元素与物质:认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类;同类物质具有相似的性质,一定条件下各类物质可以相互转化;认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
认识胶体是一种常见的分散系。
”由此标准可以看出,本课学习主题属于“常见的无机化合物及其应用”这一部分。
二、说教材。
本课是人教版化学必修1第一章《化学物质及其变化》第一节内容,是完成初高中课程内容衔接的重要载体,其将初中所学的单一、孤立的物质及反应梳理扩展为高中阶段多样、系统的物质反应体系,渗透分类观、物质转化观等化学学科学习的基本思想方法,旨在用其发现物质及变化的规律,并预测物质的性质及可能发生的变化。
本课以图片导入,共有“物质的分类”和“物质的转化”两部分内容。

一、电解质、非电解质:电解质:在水溶液或熔融状态下能导电的化合物。
非电解质:在水溶液和熔融状态下都不能导电的化合物。
电解质非电解质定义在水溶液里或熔融状态下能导电的化合物在水溶液里和熔融状态下都不导电的化合物本质区别溶于水或熔融时,自身能电离溶于水和熔融时,自身不能电离实例酸、碱、盐、活泼金属氧化物等 非金属氧化物、大多数有机物、NH 3等33来的,而是H 2SO 4、NH 3·H 2O 电离出的,而且它们在熔融时也不导电,因此,它们都不是电解质,是非电解质。
【思考】有关定义需要注意的问题:A .金属单质是不是电解质?B .NaCl 溶液可以导电,所以NaCl 溶液是电解质?C .CO 2水溶液可以导电,CO 2是不是电解质?D .电解质一定可溶?E .电解质在水溶液和熔融状态都会导电?F .有机化合物都不是电解质吗?<答案>A 金属单质既不是电解质,也不是非电解质;电解质和非电解质是针对化合物来分类的。
BNaCl 溶液是混合物。
C 电解质必须是自身能电离出离子。
CO 2和水反应生成碳酸,是碳酸电离出了离子。
D BaSO 4、AgCl 等盐虽然不可溶,但在熔融状态下1.3 电解质和非电解质知识精讲能导电,属于电解质;E电解质在水溶液或熔融状态任一条件下导电即可。
F有机物中的一些酸和盐是电解质。
二、强电解质、弱电解质强电解质:水溶液中能完全电离的电解质。
弱电解质:水溶液中只能部分电离的电解质。
“【总结】三、电离电解质不一定导电,导电的物质不一定是电解质。
电解质导电的前提条件是——产生自由移动的离子,电解质能产生自由移动的离子,是电解质导电的内因,还必须具备一定的外因条件——溶于水或熔融态。
(1)我们把这种物质溶于水后或受热熔化时,离解成能够自由移动的离子的过程叫做电离。
(2)电离的表示——电离方程式①电离方程式书写注意事项A. 符合客观事实。
不能随意书写离子符号,离子所带电荷数必须等于该元素或原子团在该化合物中的化合价。
第二课时物质的转化[明确学习目标]熟悉单质、酸、碱、盐、氧化物等之间的转化关系。
学生自主学习酸、碱、盐的性质1.酸(以稀盐酸为例)2.碱[以Ca(OH)2为例]物质的转化 1.在化学变化过程中,元素是不会改变的,这是考虑如何实现物质之间的转化时最基本的依据2.实例写出标号的化学反应方程式:①□032Ca +O 2===2CaO②□04CaO +H 2O===Ca(OH)2③□05Ca(OH)2+CO 2===CaCO 3↓+H 2O④□06C +O 2=====点燃CO 2 ⑤□07CO 2+H 2O===H 2CO 3 ⑥□08H 2CO 3+Ca(OH)2===CaCO 3↓+2H 2O1.为什么不同的酸(或碱)具有相似的化学性质?提示:尽管酸(或碱)不同,但它们的水溶液中都含有H+(或OH-),其相似的性质实际上是H+(或OH-)的性质。
2.纯碱属于碱吗?提示:纯碱——Na2CO3不是碱,属于碳酸盐。
课堂互动探究知识点一酸、碱、盐的性质1.酸、碱的性质:酸与碱反应生成盐和水;酸与碱性氧化物、碱与酸性氧化物反应生成盐和水;酸与金属活动性顺序表中排在氢前面的金属反应生成盐和H2。
2.盐的性质:盐与酸(或碱、或盐)只有产生沉淀、气体或H2O时才能反应。
知识点二单质、氧化物、酸、碱和盐之间的转化关系说明:上图中的非金属不包括氧气和氢气。
某同学要在奥运五连环中填入物质,使相连物质间能发生反应,不相连物质间不能发生反应。
你认为“五连环”中有空缺的一环应填入的物质是()A.硫酸钠B.氧气C.二氧化碳D.氧化钙[批注点拨][答案] C[练1]下列各组物质相互混合后,不会发生反应的是()A.Na2SO4溶液和MgCl2溶液B.Na2CO3溶液和稀硫酸C.NaOH溶液和Fe2(SO4)3溶液D.Ca(OH)2溶液和盐酸答案 A解析物质在溶液中是否能够发生化学反应,可根据是否生成沉淀、气体或H2O来进行判断。
Na2SO4和MgCl2溶液混合后既没有沉淀、也没有气体和H2O 生成,故不反应。
[练2]如图中,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下通过置换反应可以转化为乙。
下面四组选项中,符合图示要求的是()答案 C解析A项,H2SO4和Na2SO4、Na2SO4和NaOH、NaOH和NaCl、NaCl 和H2SO4不反应;B项,BaCl2和KOH不反应;D项,Cu与HCl不发生置换反应生成CuCl 2。
C 项中,C +H 2O=====高温CO +H 2。
方法规律 (1)各类物质的相互转化关系图并非无所不含,有些规律未能体现。
(2)复分解反应的条件:能生成沉淀、气体或水。
(3)金属间发生置换反应的条件:金属活动性强的置换弱的。
①判断金属与酸反应时:金属必须排在H 前面;酸不可用硝酸、浓硫酸。
②判断金属与盐反应时:必须同时满足“排在前面的金属”和“可溶性盐”两个条件。
本课归纳总结单质、氧化物、酸、碱、盐之间的转化关系学习效果检测1.将下列各组物质按酸、碱、盐的分类依次排列,正确的是( )A .硫酸、纯碱、石膏B .硫酸、烧碱、胆矾C .硫酸氢钠、生石灰、醋酸钠D .磷酸、熟石灰、苛性钠答案 B解析 硫酸属于酸,纯碱是Na 2CO 3,属于盐,石膏属于盐,A 错误;硫酸属于酸,烧碱是NaOH ,属于碱,胆矾是五水硫酸铜,属于盐,B 正确;硫酸氢钠属于盐,生石灰属于氧化物,醋酸钠属于盐,C 错误;磷酸属于酸,熟石灰属于碱,苛性钠是NaOH ,属于碱,D 错误。
2.实验室中的药品常按物质的性质、类别等不同而有规律地放置。
在做“酸的性质”实验时,实验桌上部分药品的摆放如图所示。
某同学取用KOH 溶液后应把它放回的位置是( )答案 D解析KOH属于碱类物质,应与NaOH放在一起。
3.下列物质一定是由三种元素组成的是()A.氧化物B.碱C.酸D.盐答案 B解析碱一定是由H、O、金属元素(或N元素)三种元素组成的。
4.下列物质间的转化可由一步反应完成的是(提示:SiO2既不溶于水也不与水反应)()A.SiO2H2SiO3B.Cu(OH)2Fe(OH)3C.CaCO3Na2CO3D.Cu Cu(NO3)2答案 D解析A项,酸性氧化物转化为酸,应按酸性氧化物+水―→酸的反应形式直接转化,但SiO2与水不反应,故SiO2不能由一步反应变为H2SiO3;B项,碱变为其他碱,应按碱+盐―→新碱+新盐的反应形式直接转化,Cu(OH)2不溶于水,一般不能与盐反应生成其他碱,故Cu(OH)2不能由一步反应转化为Fe(OH)3;C 项,盐变为其他盐,可能的反应形式为盐+碱―→新盐+新碱、盐+酸―→新盐+新酸、盐+盐―→新盐+新盐、盐+金属―→新盐+新金属,由于CaCO3难溶于水,故它难与其他物质反应转变为易溶于水的Na2CO3;D项,金属变为盐,可能的反应形式为金属+酸―→盐+H2(强氧化性酸反应产生其他气体)、金属+盐―→新金属+新盐,铜可与AgNO3溶液反应直接产生Cu(NO3)2。
5.依据现有知识分析判断,下列反应不能发生的是()A.NaOH+KCl===NaCl+KOHB.AgNO3+HCl===AgCl↓+HNO3C.Na2CO3+Ca(OH)2===2NaOH+CaCO3↓D.BaCO3+2HNO3===Ba(NO3)2+H2O+CO2↑答案 A解析酸、碱、盐之间发生反应的条件是生成沉淀、气体或水,由此可知只有A项中的反应不能发生。
6.KOH是我国古代纺织业常用作漂洗的洗涤剂。
古代制取KOH的流程如下:上述流程中没有涉及的化学反应类型是( )A .化合反应B .分解反应C .置换反应D .复分解反应答案 C解析 该流程中发生的反应依次是:CaCO 3=====高温CaO +CO 2↑(分解反应),CaO +H 2O===Ca(OH)2(化合反应),Ca(OH)2+K 2CO 3===CaCO 3↓+2KOH(复分解反应)。
7.同一物质按照不同的分类标准可以分为很多类别,按照物质的成分对下列10种物质进行分类:①水 ②空气 ③铁 ④二氧化碳 ⑤硫酸⑥熟石灰[Ca(OH)2] ⑦胆矾(CuSO 4·5H 2O)⑧食盐水 ⑨碱式碳酸铜[Cu 2(OH)2CO 3]⑩硫酸氢钠(NaHSO 4)(1)属于混合物的是__________________________________________ ______________________________;(2)属于氧化物的是____________________________________________ ____________________________;(3)属于碱的是_____________________________________________________ ______________;(4)属于酸的是________________________________________________ ________________________;(5)属于盐的是_________________________________________________ _______________________;(6)属于铜盐的是_________________________________________________ _______________________;(7)属于钠盐的是__________________________________________________ ______________________。
答案(1)②⑧(2)①④(3)⑥(4)⑤(5)⑦⑨⑩(6)⑦⑨(7)⑩解析物质可分为纯净物、混合物。
胆矾(CuSO4·5H2O)、Cu2(OH)2CO3、NaHSO4都有固定的组成,均为纯净物。
食盐水由NaCl和水两种物质组成,属于混合物。
酸、碱、盐等都有明确的概念,可以根据物质的分类进行判断。
8.在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在如图所示关系,给①~⑤选择适当的物质,使有连线的两种物质能发生反应。
(1)请推断它们的化学式分别为:①________;②________;③________;④________;⑤________。
(2)写出下列物质之间反应的化学方程式:①和②____________________________________________________;②和④_____________________________________________________;②和⑤____________________________________________________;③和④_____________________________________________________。
答案(1)Fe H2SO4CO2CaO Na2CO3(2)Fe+H2SO4===FeSO4+H2↑CaO+H2SO4===CaSO4+H2OH2SO4+Na2CO3===Na2SO4+H2O+CO2↑CO2+CaO===CaCO3解析据单质①能和酸②发生化学反应,推知①应为活泼金属单质,即为铁;而酸只有稀H2SO4,即②为稀H2SO4,则氧化物④应为金属氧化物,即④为CaO,氧化物③为酸性氧化物,即为CO2;⑤属于盐且既能与稀H2SO4反应,又能与CaO 在水溶液中反应,则⑤应为Na2CO3。