物质在溶解过程中能量变化
- 格式:ppt
- 大小:453.00 KB
- 文档页数:20
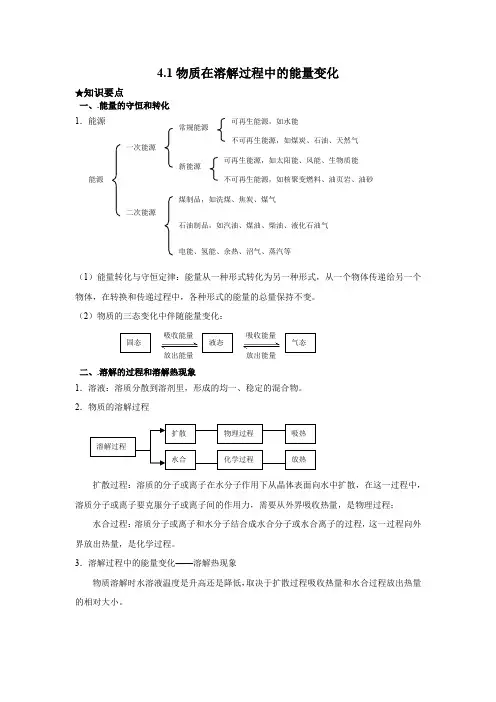
4.1物质在溶解过程中的能量变化★知识要点一、.能量的守恒和转化 1.能源(1)能量转化与守恒定律:能量从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转换和传递过程中,各种形式的能量的总量保持不变。
(2)物质的三态变化中伴随能量变化:二、.溶解的过程和溶解热现象1.溶液:溶质分散到溶剂里,形成的均一、稳定的混合物。
2.物质的溶解过程扩散过程:溶质的分子或离子在水分子作用下从晶体表面向水中扩散,在这一过程中,溶质分子或离子要克服分子或离子间的作用力,需要从外界吸收热量,是物理过程; 水合过程:溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程向外界放出热量,是化学过程。
3.溶解过程中的能量变化——溶解热现象物质溶解时水溶液温度是升高还是降低,取决于扩散过程吸收热量和水合过程放出热量的相对大小。
扩散 溶解过程 水合 物理过程 化学过程 吸热放热 能源 一次能源 二次能源 新能源 常规能源 可再生能源,如水能 不可再生能源,如煤炭、石油、天然气 可再生能源,如太阳能、风能、生物质能 不可再生能源,如核聚变燃料、油页岩、油砂 煤制品,如洗煤、焦炭、煤气石油制品,如汽油、煤油、柴油、液化石油气 电能、氢能、余热、沼气、蒸汽等 吸收能量 固态 液态 气态吸收能量 放出能量 放出能量三、溶解和结晶1.溶解:溶质分散到溶剂中的过程。
2.结晶:晶态溶质从溶液中析出的过程。
3.溶解和结晶的宏观现象和微观过程溶解和结晶作为宏观现象是不能同时观察到的。
但是,就微观粒子的运动状态而言,溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系——溶解平衡。
4.溶解平衡在一定条件下的饱和溶液中,当物质溶解速率和物质晶体析出速率相等,这个溶液体系就达到了溶解平衡状态。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率,原来的溶解平衡被破坏,并在新条件下建立新的平衡。


溶解的化学原理溶解是一种化学过程,指的是固体溶质在液体溶剂中分散和解离的过程。
溶解是许多化学反应和实验中常见的过程,也是生物体内许多生物化学反应的基础。
本文将从分子层面和能量变化的角度来解释溶解的化学原理。
1. 分子层面解释在溶解过程中,溶质分子与溶剂分子发生相互作用。
溶质分子在溶剂分子的包围下逐渐分散,并逐渐与溶剂分子形成水合或溶剂包络层。
这是由于溶质分子与溶剂分子之间的静电作用力、范德华力、氢键、疏水作用等分子间相互作用引起的。
首先,静电作用力是溶质分子与溶剂分子之间相互作用的主要力之一。
当溶质分子带有电荷时,它们与溶剂分子之间会产生电荷间的相互作用力,这种作用力有助于溶质分子在溶剂中解离。
例如,在离子化合物溶解过程中,正负相互吸引的静电作用力使得离子能够与溶剂分子发生相互作用并溶解。
其次,范德华力也是影响溶解的重要因素之一。
溶质分子与溶剂分子之间的范德华力使它们彼此靠近,并在分子间产生相互吸引的力。
这种力对于非极性有机物的溶解非常重要,通过这种相互作用力,溶质分子能够被溶剂分子包围,进而在溶剂中解离。
此外,氢键也是溶解过程中分子间相互作用的一种重要力。
当溶质分子中含有可供氢键形成的氢原子时,其能够与溶剂分子中的氧、氮或氟等带有负电荷的原子形成氢键,从而促进溶质分子的溶解。
氢键是分子间相互作用中最强的一种作用力,对于许多溶质的溶解有着重要的影响。
最后,疏水作用也是溶解过程中的一个重要因素。
当溶剂为非极性溶剂时,溶质分子中的疏水部分与溶剂分子中的疏水部分相互作用,从而促进溶质的溶解。
这种疏水作用有助于溶质分子在溶剂中形成疏水核,使其能够被溶剂分散。
2. 能量变化解释溶解过程中伴随着能量变化,这是溶解的重要特征之一。
在溶解过程中,溶质分子要克服固体内分子间的相互作用力,如范德华力、离子间相互作用力等,然后与溶剂分子相互作用,形成水合或溶剂包络层。
这些能量变化是溶解过程中能量的转化。
首先是固体内分子间相互作用能的改变。

溶解过程中能量的变化是什么?
概述
溶解是物质从固态或气态转变为液态的过程。
在溶解过程中,
存在能量的转化和变化。
本文将探讨溶解过程中能量的变化以及相
关的能量转化原理。
能量转化原理
在溶解中,主要存在以下几种能量转化:
1. 吸热过程:当溶质与溶剂之间的相互作用力破坏时,需要提
供能量,这导致了能量的吸收。
因此,溶解过程中可以发生吸热反应。
2. 放热过程:当溶质与溶剂之间的相互作用力形成时,释放出
能量,这导致了能量的放出。
因此,溶解过程中可以发生放热反应。
能量变化
溶解过程中的能量变化可以包括以下几个方面:
1. 温度变化:当溶质与溶剂发生吸热反应时,会导致溶液的温
度升高;而当溶质与溶剂发生放热反应时,会导致溶液的温度降低。
2. 热量变化:吸热反应和放热反应分别导致溶解过程中的热量
增加和减少。
吸热反应吸收了外界的热量,使溶解过程变冷;而放
热反应释放出热量,使溶解过程变热。
3. 势能变化:溶质与溶剂之间的相互作用力形成或破坏时,会
引起势能的变化。
溶解过程中会伴随着溶质与溶剂之间的相互作用
能的变化。
结论
根据上述的能量转化原理和能量变化,我们可以总结出在溶解
过程中能量的变化是多方面的,包括吸热过程、放热过程以及温度、热量和势能的变化。
深入理解溶解过程中的能量变化有助于我们更
好地理解溶解现象及其相关的物理化学原理。


物质溶于水吸热和放热的原因大家好,今天我们来聊聊一个看似复杂但其实很有趣的话题——物质溶于水时为什么会吸热或者放热。
这个问题就像是做一道神秘的化学魔法题,让人既好奇又想一探究竟。
首先,咱们得知道,物质溶于水,热量的变化取决于溶解过程中的不同因素。
那接下来,咱们就一起来拆开这层“魔法面纱”,看看这其中的奥秘吧!1. 溶解过程中的热量变化首先,我们得了解,物质溶解在水中有时候是吸热的,有时候是放热的。
就像你晚上盖的被子,有时候暖暖的,有时候凉凉的。
这个现象的出现,是因为溶解过程中的“化学战争”不同造成的。
1.1 吸热溶解说到吸热,大家可能会想到冰淇淋在夏天的融化。
没错,溶解过程中的吸热,类似于冰淇淋在炎热的天气下融化时需要吸收热量。
比如,食盐和糖溶解在水中,一般来说,吸热不明显,没什么大惊小怪的。
但有些物质,比如氯化铵(就是咱们平常用来做冰袋的那个),溶解的时候就会吸收大量的热量,水温骤降,摸上去凉飕飕的,这种现象就叫做吸热溶解。
你可以想象成是“贪吃鬼”,把热量全都吸走了。
1.2 放热溶解那么放热呢?这就像冬天喝一杯热可可,咕噜咕噜的冒热气。
放热溶解,就是物质溶解的时候把热量释放出来,水温升高。
像氢氧化钠(那种让肥皂泡泡冒出来的化学物质)溶解在水中时,水会变得热乎乎的。
这就像你把热水倒进冷杯子里,杯子也会变热。
这样的过程,水变得暖和,是因为物质在溶解的时候把热量释放到水里了。
2. 分子间的作用力了解了吸热和放热的基本概念之后,我们来看看为什么会有这些现象。
其实,这背后是分子之间的作用力在捣鬼。
2.1 溶解时的能量变化溶解过程中的能量变化,跟物质和水分子之间的“战斗”有关。
想象一下,物质分子就像是参加了一场派对的人,而水分子则是另一个派对的客人。
溶解的时候,物质分子要和水分子互动,互相交换能量。
如果这些互动非常“火热”,那么溶解的过程中就会放出热量;如果互动比较“冷淡”,则会吸收热量。
2.2 吸热与放热的原因举个例子,拿盐和糖溶解在水中的情况来比喻。

第四章剖析物质变化中的能量变化§4.1物质在溶解过程在有能量变化吗?引言:当煤、石油、天然气和食物在转化为其他物质时,给人们提供了各种形式的能量,在物质变化中,能量从一种形式转化为另一种形式。
物质存在三态:固态〔s〕、气态〔g〕液态〔l〕,物质的三态在转化过程也伴随着能量的转换。
吸收能量吸收能量固态〔体〕液体气态〔体〕放出能量放出能量在我们生活中经常利用三态变化来调整环境温度。
拓展:能源的种类:四种分类法来自太阳:生物质能,风能,煤,石油等。
①从能源的形成和来源角度来自地球部:地热能等。
来自核反响:裂变能、聚变能。
来自天体间引力:潮汐能。
②从能源利用状况角度分常规能源:石油、煤、天然气、水、生物等。
新能源:核能、地热能、海洋能。
③从能源的原有形态是否改变的角度分一次能源——自然界现存的一次能源:煤炭、石油、天然气。
二次能源——由一次能源加工转换而成的二次能源:电、氢能、汽油等。
④从能源是否能循环再生角度看可再生能源:水力、沼气等。
不可再生能源:煤、石油等。
一、物质溶解过程中的热现象Cl溶解是吸热的,NaOH溶解是放热的,而NaCl溶解放热和吸热均不明显。
NH4二、溶解的二个过程溶质溶解在水里,通常发生两个过程,一是溶质分子〔或离子〕受到水分子作用,向水中扩散的过程,在这种过程中,溶质分子或离子要克制分子或离子之间的引力,需要向外界吸收热量,这是一个物理过程〔物理变化〕。
另一个过程则是溶质分子或离子和水分子又结合成水合分子或水合离子的过程,这种过程放出热量是一个化学过程。
小结:扩散的过程水合过程溶解中的变化物理变化〔物理过程〕化学变化〔化学过程〕溶解中的能量变化吸热放热在溶解时:①当扩散过程吸收热量>水合过程放出的热量时,则总体表现为吸热。
②当扩散过程吸收热量<水合过程放出的热量时,则总体表现为放热。
③当扩散过程吸收热量≈水合过程放出的热量时,则总体表现为无显著的热量变化。
三、溶解和结晶结晶——将固体溶质的水溶液放在敞口的容器中让水慢慢地蒸发,或改变温度都可能使晶态溶质从溶液中析出,这个过程称为结晶。


溶解过程中的能量变化探究教案二:引导学生做出观察和分析:溶解是一种常见的化学现象,它涉及溶质分子与溶剂分子之间的相互作用和能量的变化。
在实际应用中,我们经常需要了解溶解过程中的能量变化,以便更好地控制化学反应和优化工艺。
本文将介绍一种教学方法,即引导学生做出观察和分析,以探究溶解过程中的能量变化。
一、实验准备1.试剂和仪器:(1)氢氧化钠固体、氯化铜固体和氯化钾固体;(2)量热器、电子天平、热敏电阻温度计、手套、试管、滴管等。
2.实验操作:(1)将约0.5 g的氢氧化钠固体加入 25 mL 的蒸馏水中,并用滴管慢慢加入氯化铜固体,直至氧化铜(Ⅱ)全部溶解;(2)同样地,将约0.5 g 的氢氧化钠固体加入 25 mL 的蒸馏水中,并用滴管慢慢加入氯化钾固体,直至氯化钾全部溶解;(3)将溶解过程中的温度变化记录下来,并计算出溶解过程中的焓变化。
二、实验结果与分析1.实验结果:(1)氧化铜(Ⅱ)和氯化铜分别在氢氧化钠溶液中溶解,溶解过程中的温度变化如图 1 所示;(2)计算溶解过程中的焓变化,结果如表 1 所示。
图 1 氧化铜(Ⅱ)和氯化铜在氢氧化钠溶液中溶解过程中的温度变化表 1 氧化铜(Ⅱ)和氯化铜在氢氧化钠溶液中溶解过程中的焓变化2.实验分析:(1)根据图 1 可以看出,氧化铜(Ⅱ)和氯化铜在氢氧化钠溶液中的溶解过程均伴随着温度的变化,其中氧化铜(Ⅱ)的溶解过程呈现出明显的吸热效应,而氯化铜的溶解过程则呈现出轻微的放热效应。
(2)计算结果表明,氧化铜(Ⅱ)的溶解过程中的焓变化为48.92 kJ·mol^-1,而氯化铜的溶解过程中的焓变化为 -2.75kJ·mol^-1。
这说明氧化铜(Ⅱ)的溶解过程是一个吸热过程,而氯化铜的溶解过程则是一个放热过程。
(3)这种现象的产生与溶质分子与溶剂分子之间的相互作用及能量的变化密切相关。
在氢氧化钠溶液中,氧化铜(Ⅱ)分子与氢氧化钠分子之间存在较强的氢键作用,因此在氧化铜(Ⅱ)的溶解过程中,部分氢键被破坏,分子间距增大,产生吸热现象。

初中溶解能量的变化教案教学目标:1. 了解物质溶解过程中能量的变化现象。
2. 掌握溶解过程中放热和吸热的原理。
3. 能够分析溶解过程中能量变化的原因。
教学重点:1. 物质溶解过程中的能量变化现象。
2. 溶解过程中放热和吸热的原理。
教学难点:1. 溶解过程中能量变化的原因。
教学准备:1. 实验室用具:烧杯、玻璃棒、温度计、电子秤等。
2. 实验试剂:硝酸钾、氢氧化钠、冷水、热水等。
教学过程:一、导入(5分钟)1. 引导学生回顾物质溶解的基本概念,让学生思考溶解过程中是否会发生能量的变化。
二、实验观察(15分钟)1. 准备实验试剂和实验室用具,进行溶解实验。
2. 将适量的硝酸钾加入冷水中,观察溶解过程中的能量变化现象。
3. 将适量的氢氧化钠加入热水中,观察溶解过程中的能量变化现象。
4. 记录实验过程中的温度变化,并进行数据分析。
三、探讨解释(15分钟)1. 引导学生讨论实验观察到的能量变化现象,让学生尝试解释原因。
2. 引导学生理解溶解过程中的放热和吸热原理。
3. 分析溶解过程中能量变化的原因,解释为什么硝酸钾溶解在冷水中会吸热,而氢氧化钠溶解在热水中会放热。
四、知识拓展(10分钟)1. 引导学生了解溶解过程中的能量变化在其他领域的应用,如食品加工、药物制备等。
2. 引导学生思考溶解过程中的能量变化对环境的影响。
五、总结与评价(5分钟)1. 让学生总结本节课所学的知识,加深对物质溶解过程中能量变化的理解。
2. 教师对学生的表现进行评价,鼓励学生的探究精神和实践能力。
教学延伸:1. 组织学生进行溶解过程中能量变化的小组讨论,让学生进一步深入研究溶解过程中的能量变化现象。
2. 安排学生进行溶解过程中能量变化的实验设计,培养学生的实验设计和操作能力。
教学反思:本节课通过实验观察和探讨解释,让学生了解物质溶解过程中的能量变化现象,掌握溶解过程中放热和吸热的原理。
在教学过程中,要注意引导学生积极参与实验观察和讨论,培养学生的观察能力、思考能力和实践能力。
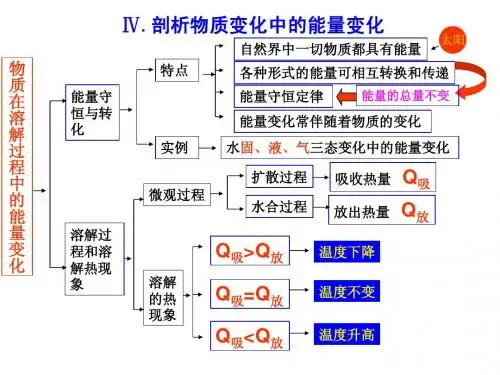
溶解过程的能量变化知识框架:1.能量间的转化关系:2.能量从高转化到低时,总有能量放出;从低转化到高时总要吸收能量。
物质的三态能量转化如下:规律:(1)同一物质,能量高低为:气态>液态>固态。
(2)物质变“稀”,就吸热。
3.溶解的过程:物质的溶解通常有两个过程:一个是溶质的分子或离子在水分子作用下向水中扩散,在这一过程中,溶质分子或离子需要克服分子或离子之间的引力,需要向外界吸收热量,是物理过程;另一个是溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程放出热量,是化学过程。
4.中学中常见的溶解时放热的物质有:氢氧化钠、浓硫酸、氧化钙等。
溶解时吸热的物质有氯化铵、硝酸钾、硝酸铵等。
溶解时热量变化不明显的物质有:氯化钠等。
5.物质溶解过程中的能量变化:物质溶解于水,当扩散过程中所吸收的热量大于水合过程中所放出的热量时,溶液的温度就下降。
当吸收热量小于放出热量时,溶液的温度就上升。
当吸收热量等于放出热量时,溶液温度将基本不变。
6.溶解:当把固体溶质加入水后,溶质表面的分子或离子由于本身的振动以及受到水分子的撞击和吸引会逐渐脱离固体表面进入水中,扩散到各个部分成为溶液,这个过程称为溶解。
7.结晶:已溶解的溶质分子或离子,在溶液中不停地运动着,当它们跟未溶解的固体表面碰撞时,又可重新被吸引到固体表面上来,这个过程称为结晶。
8.溶解和结晶的关系:溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率。
9.溶液。
10.结晶水:溶质从其水溶液里析出而形成晶体时,晶体里常常有一定数目的水分子,这样的水分子叫做结晶水。
晶体中的这种水分子,是作为晶体结构中的一种成分而存在于晶体中的。
有些盐溶于水中会形成稳定的水合离子,当这些盐从水溶液里结晶出来时,就带有一定数目的水分子。
【同步实验课】探究溶解性和溶解时能量变化【实验目的】1.探究影响物质溶解性的因素。
2.探究几种物质在溶解时的能量变化。
【实验仪器】试管、烧杯、玻璃棒、温度计【实验试剂】碘、高锰酸钾、水、汽油、氯化钠、硝酸铵、氢氧化钠【实验步骤】实验1:探究影响物质溶解性的因素在两支试管中各加入1~2小粒碘,然后分别加入5ml水或5ml汽油;另取两支试管各加入1~2小粒高锰酸钾,然后分别加入5ml水或5ml汽油。
振荡,观察现象。
实验2:探究物质溶解时的吸热或放热现象在三只烧杯中各加入20ml水,用温度计测量水的温度,读出温度计的示数并记录;分别取一药匙氯化钠固体、硝酸铵固体和氢氧化钠固体加入三只烧杯中,用玻璃棒搅拌使之溶解。
用温度计测量溶液的温度,比较溶解前后温度的变化。
【实验记录】实验1:探究影响物质溶解性的因素编号溶质溶剂现象①碘水碘几乎不溶于水②碘汽油碘溶解在汽油中,形成棕色溶液③高锰酸钾水高锰酸钾溶解在水中,形成紫红色溶液④高锰酸钾汽油高锰酸钾几乎不溶于汽油实验2:探究物质溶解时的吸热或放热现象水中加入的溶质NaCl NH4NO3NaOH 加入溶质前水的温度/℃t0t0t0溶解现象固体溶解固体溶解固体溶解溶质溶解后溶液的温度/℃t0t0t1t0+t2【实验讨论】实验1:探究影响物质溶解性的因素(1)通过实验①①或①①的对比,可以说明物质的溶解性和溶剂的性质(种类)有关;(2)通过实验①①或①①的对比,可以说明物质的溶解性和溶质的性质(种类)有关。
实验2:探究物质溶解时的吸热或放热现象01实验梳理02实验点拨03典例分析04对点训练05真题感悟A.探究溶剂种类对固体溶解性的影响B.区分硬水和软水C.验证Fe、Cu、Ag的金属活动性D.探究氢氧化钠溶于水放热【答案】A【详解】A、探究溶剂种类对固体溶解性的影响,应控制变量,保持其它因素一致,但两个实验的温度不一致,故选项实验不能达到目的;B、区分硬水和软水,可分别取等量硬水和软水,分别加入等量的肥皂水,观察现象,实验能达到目的;C、将铁放入硫酸铜溶液,铁表面会有红色固体析出,说明铁的金属活动性强于铜,将银放入硫酸铜溶液,无明显现象,说明银的金属活动性弱于铜,实验能达到目的;D、氢氧化钙的溶解度随温度升高而降低,所以若将水滴入氢氧化钠固体中,饱和澄清石灰水变浑浊,说明氢氧化钠溶于水放热,实验能达到目的;故选:A。