物质溶解过程中的能量变化
- 格式:docx
- 大小:84.13 KB
- 文档页数:4

物质的水溶液生成热以物质的水溶液生成热为题,我们将探讨水溶液中物质生成热的原因和相关概念。
我们需要了解什么是水溶液。
水溶液是指将固体、液体或气体溶解于水中形成的混合物。
在这个过程中,水被称为溶剂,而溶解在水中的物质则被称为溶质。
水溶液广泛应用于日常生活和工业生产中,例如食盐溶液、酸碱溶液等。
当物质溶解在水中时,常常会伴随着热的生成。
这是因为溶解过程是一个热力学过程,涉及到能量的转移和转化。
在水溶液中,溶质与溶剂之间会发生相互作用,这些相互作用导致了溶解过程中的能量变化。
溶解过程中生成热的原因主要有两个方面。
首先,物质溶解在水中时,会与水分子之间发生相互作用,这些相互作用会释放出能量,从而使溶液的温度上升。
其次,当溶质与溶剂之间发生相互作用时,会形成新的化学键或增强已有化学键的形成,这些化学键的形成会释放出能量,进而产生热。
溶解过程中热的生成量可以通过热化学方程式来表示。
热化学方程式是用来描述化学反应中热的变化的方程式。
例如,对于溶解过程中的盐类,可以用下面的方程式来表示:NaCl(s) + H2O(l) -> NaCl(aq) + 热其中,NaCl(s)表示固体盐类,H2O(l)表示液态水,NaCl(aq)表示盐类溶解在水中的水溶液,热表示溶解过程中释放的热量。
需要注意的是,不同物质在水中溶解时生成热的量是不同的。
这是因为不同物质之间的相互作用力不同,所以溶解过程中释放的能量也不同。
一般来说,离子键的形成会释放更多的能量,所以离子类物质在水中溶解时生成的热较多。
物质的溶解度也会影响溶解过程中生成热的量。
溶解度是指单位溶剂中能溶解的物质的最大量。
当溶质的溶解度较高时,溶解过程中生成热的量也会相应增加。
在实际应用中,溶解过程中生成的热可以被利用。
例如,可以利用盐类溶解在水中生成的热来加热水,或者利用其他物质的溶解热来进行化学反应。
总结起来,物质在水溶液中生成热是因为溶解过程中的相互作用和化学键的形成所释放的能量。


溶解过程中能量的变化是什么?
概述
溶解是物质从固态或气态转变为液态的过程。
在溶解过程中,
存在能量的转化和变化。
本文将探讨溶解过程中能量的变化以及相
关的能量转化原理。
能量转化原理
在溶解中,主要存在以下几种能量转化:
1. 吸热过程:当溶质与溶剂之间的相互作用力破坏时,需要提
供能量,这导致了能量的吸收。
因此,溶解过程中可以发生吸热反应。
2. 放热过程:当溶质与溶剂之间的相互作用力形成时,释放出
能量,这导致了能量的放出。
因此,溶解过程中可以发生放热反应。
能量变化
溶解过程中的能量变化可以包括以下几个方面:
1. 温度变化:当溶质与溶剂发生吸热反应时,会导致溶液的温
度升高;而当溶质与溶剂发生放热反应时,会导致溶液的温度降低。
2. 热量变化:吸热反应和放热反应分别导致溶解过程中的热量
增加和减少。
吸热反应吸收了外界的热量,使溶解过程变冷;而放
热反应释放出热量,使溶解过程变热。
3. 势能变化:溶质与溶剂之间的相互作用力形成或破坏时,会
引起势能的变化。
溶解过程中会伴随着溶质与溶剂之间的相互作用
能的变化。
结论
根据上述的能量转化原理和能量变化,我们可以总结出在溶解
过程中能量的变化是多方面的,包括吸热过程、放热过程以及温度、热量和势能的变化。
深入理解溶解过程中的能量变化有助于我们更
好地理解溶解现象及其相关的物理化学原理。

氢氧化钠溶于水的热量变化氢氧化钠溶于水的热量变化是一个重要的热化学过程。
在这个过程中,固体氢氧化钠与水发生反应,生成氢氧化钠溶液,并伴随着放热现象。
本文将详细介绍氢氧化钠溶于水的热量变化过程。
我们来了解一下氢氧化钠和水的性质。
氢氧化钠是一种固体物质,化学式为NaOH,常温下为白色结晶体。
它是一种强碱,能够与酸反应生成盐和水。
水是一种无色、无味、无臭的液体,是地球上最常见的物质之一。
水具有良好的溶解性,可以溶解很多物质。
当氢氧化钠溶于水时,会发生热化学反应。
这个反应是放热反应,即释放热量。
这是因为在反应过程中,氢氧化钠分子和水分子之间的键被破坏,新的键被形成,伴随着能量的释放。
这个过程可以用以下化学方程式表示:NaOH(s) + H2O(l) → Na+(aq) + OH-(aq) + 热量在这个反应中,氢氧化钠的固体形式转化为水溶液的离子形式,同时释放出热量。
这个热量的大小取决于反应的热力学性质,可以通过实验测量得到。
在实际操作中,当氢氧化钠固体溶解于水中时,会产生大量的热。
这是因为氢氧化钠和水之间的化学反应是一个放热反应,热量会迅速释放到周围环境中。
因此,在操作过程中需要特别小心,以避免热量的积累和升高。
值得注意的是,溶解氢氧化钠的过程是一个放热反应,但是溶解过程中的热量变化与溶解度有关。
溶解度是指单位溶剂中能溶解的溶质的最大量。
在溶液达到饱和时,溶解度最大。
溶解度与温度有关,一般情况下随着温度的升高,溶解度会增加。
因此,溶解氢氧化钠的过程中,热量的大小也会受到温度的影响。
除了热量变化外,溶解氢氧化钠还会产生其他影响。
例如,溶解氢氧化钠会使溶液的pH值增加,变得更加碱性。
这是因为氢氧化钠是一种强碱,其溶液中会释放出氢氧根离子(OH-)。
这些氢氧根离子与水分子结合形成氢氧化物(OH-)离子,使溶液呈现碱性。
溶解氢氧化钠的过程也会释放出氢氧化钠的热量变化,可以应用在一些实际应用中。
例如,在实验室中,可以利用氢氧化钠溶解过程中的放热现象,来测量一些化学反应的热量变化。

物质溶于水吸热和放热的原因大家好,今天我们来聊聊一个看似复杂但其实很有趣的话题——物质溶于水时为什么会吸热或者放热。
这个问题就像是做一道神秘的化学魔法题,让人既好奇又想一探究竟。
首先,咱们得知道,物质溶于水,热量的变化取决于溶解过程中的不同因素。
那接下来,咱们就一起来拆开这层“魔法面纱”,看看这其中的奥秘吧!1. 溶解过程中的热量变化首先,我们得了解,物质溶解在水中有时候是吸热的,有时候是放热的。
就像你晚上盖的被子,有时候暖暖的,有时候凉凉的。
这个现象的出现,是因为溶解过程中的“化学战争”不同造成的。
1.1 吸热溶解说到吸热,大家可能会想到冰淇淋在夏天的融化。
没错,溶解过程中的吸热,类似于冰淇淋在炎热的天气下融化时需要吸收热量。
比如,食盐和糖溶解在水中,一般来说,吸热不明显,没什么大惊小怪的。
但有些物质,比如氯化铵(就是咱们平常用来做冰袋的那个),溶解的时候就会吸收大量的热量,水温骤降,摸上去凉飕飕的,这种现象就叫做吸热溶解。
你可以想象成是“贪吃鬼”,把热量全都吸走了。
1.2 放热溶解那么放热呢?这就像冬天喝一杯热可可,咕噜咕噜的冒热气。
放热溶解,就是物质溶解的时候把热量释放出来,水温升高。
像氢氧化钠(那种让肥皂泡泡冒出来的化学物质)溶解在水中时,水会变得热乎乎的。
这就像你把热水倒进冷杯子里,杯子也会变热。
这样的过程,水变得暖和,是因为物质在溶解的时候把热量释放到水里了。
2. 分子间的作用力了解了吸热和放热的基本概念之后,我们来看看为什么会有这些现象。
其实,这背后是分子之间的作用力在捣鬼。
2.1 溶解时的能量变化溶解过程中的能量变化,跟物质和水分子之间的“战斗”有关。
想象一下,物质分子就像是参加了一场派对的人,而水分子则是另一个派对的客人。
溶解的时候,物质分子要和水分子互动,互相交换能量。
如果这些互动非常“火热”,那么溶解的过程中就会放出热量;如果互动比较“冷淡”,则会吸收热量。
2.2 吸热与放热的原因举个例子,拿盐和糖溶解在水中的情况来比喻。

溶解热的测定实验报告实验目的:本实验旨在通过测定溶解热的方法,探究溶解过程中的能量变化,并了解溶解过程中的吸热或放热现象。
实验仪器:热量计、电子天平、恒温槽、烧杯、玻璃棒等。
实验原理:溶解热是指单位物质在吸热或放热下完全溶解所需吸收或放出的热量。
根据热力学第一定律,物质溶解时需要吸收热量应与物质溶解时释放的热量之和相等。
实验中,我们可以通过热量计来测定单位物质溶解时所吸收的热量,从而得到溶解热。
实验步骤:1.首先,在恒温槽中预先调节溶液的温度,使其保持恒定。
2.称取一定质量的物质(例如NaCl)放入烧杯中,并记录其质量。
3.将烧杯放入恒温槽中,使溶液与温度恒定的介质充分接触,等待溶解过程完成。
4.测量热量计中的温度变化,并记录下来。
5.从热量计的示数中计算出所吸收或放出的热量。
实验结果:通过实验测得,以1g的物质溶解过程中吸热量为Q(J),则单位质量物质的溶解热即为ΔH = Q/m (J/g),其中m为物质的质量。
实验讨论:1.根据实验数据,我们可以推断溶解过程中的溶解热是吸热还是放热的。
如果测得的热量为正值,则说明溶解过程为吸热过程;如果热量为负值,则说明溶解过程为放热过程。
2.溶解热与物质之间的相互作用力有关,较强的相互作用力导致溶解热较大的正值,而较弱的相互作用力则导致溶解热为负值。
3.实验中,我们可以选择不同的物质进行测定,比较它们的溶解热大小,从中探究物质溶解过程中的相互作用力的差异。
4.溶解热的测定还可以应用于其他领域,如药物研发、化工工艺等。
了解和掌握物质的溶解热有助于优化工艺和提高效率。
实验结论:通过本实验的测定,我们可以得到不同物质的溶解热,从中了解物质溶解过程中的能量变化。
实验中使用的测定方法能够较准确地获得溶解热的数值,为后续研究和应用提供了基础。
研究溶解热有助于深入了解物质溶解过程中的能量变化与物质特性之间的关系,进一步推动相关领域的发展和创新。


化学反应的溶解化学反应是物质之间发生变化的过程,其中涉及到溶解现象。
溶解是指固体、液体或气体溶质在溶剂中充分分散,形成溶液的过程。
溶解过程是一种重要的化学反应类型,应用广泛,对于我们理解许多化学现象及其应用具有重要意义。
一、溶解的基本概念和特点溶解实际上是一个动态平衡的过程,涉及溶质与溶剂之间的相互作用。
在溶解中,溶质分子或离子与溶剂分子或离子之间发生相互作用,使溶质逐渐分散在溶剂中。
以下是溶解的基本特点:1. 溶质与溶剂之间发生相互作用:溶质分子(或离子)与溶剂分子(或离子)之间发生相互作用,包括氢键、离子键、范德华力等。
2. 溶质逐渐分散在溶剂中:随着相互作用的增强,溶质逐渐分散在溶剂中,并与溶剂分子形成一个稳定的溶液体系。
3. 溶解过程中伴随能量变化:溶解过程中,伴随着能量的吸收或释放。
吸热过程为吸热溶解,释热过程为放热溶解。
4. 溶解度与温度、压力等因素有关:溶解度是指在一定温度和压力下,溶质在溶剂中的最大溶解量。
溶解度受温度、压力等因素的影响。
二、溶解的应用溶解是化学反应的一种重要类型,其应用广泛。
以下是一些溶解的应用例子:1. 化学分析:溶解在适当溶剂中的化合物可以通过各种化学分析方法进行定性、定量分析。
2. 药物制剂:药物中的有效成分通常需要以溶解形式存在,以便更好地吸收和发挥药效。
3. 燃料制备:溶解是生产某些燃料的关键步骤,通过将油或气溶解在适当的溶剂中,可以获得高效的燃料。
4. 金属提取:在冶金过程中,一些金属需要通过溶解和析出的方式来提取和纯化。
5. 物质合成:某些反应需要在溶剂中进行,以提供合适的反应环境和分子相互作用。
三、溶解的影响因素溶解的程度可以受到多个因素的影响。
以下是一些常见的影响因素:1. 温度:溶解度随着温度的升高而增加,因为温度升高会加快分子的运动,增强分子间的相互作用。
2. 压力:对于固体溶解在液体中的情况,压力对溶解度的影响较小。
但对于气体溶解在液体中的情况,气体溶解度随压力的增加而增加。

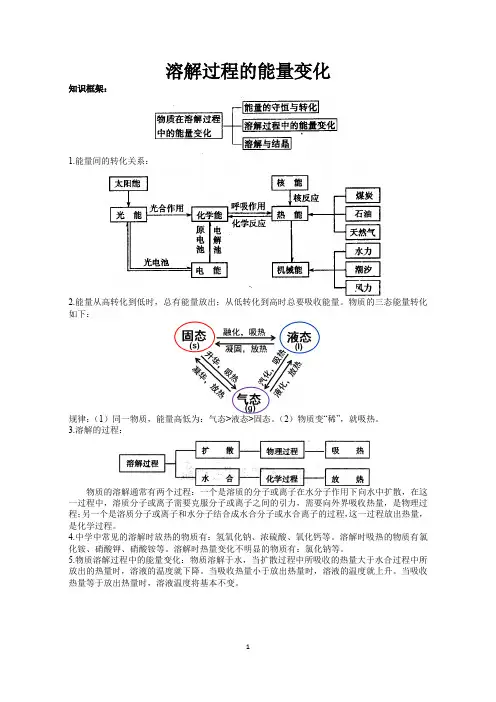
溶解过程的能量变化知识框架:1.能量间的转化关系:2.能量从高转化到低时,总有能量放出;从低转化到高时总要吸收能量。
物质的三态能量转化如下:规律:(1)同一物质,能量高低为:气态>液态>固态。
(2)物质变“稀”,就吸热。
3.溶解的过程:物质的溶解通常有两个过程:一个是溶质的分子或离子在水分子作用下向水中扩散,在这一过程中,溶质分子或离子需要克服分子或离子之间的引力,需要向外界吸收热量,是物理过程;另一个是溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程放出热量,是化学过程。
4.中学中常见的溶解时放热的物质有:氢氧化钠、浓硫酸、氧化钙等。
溶解时吸热的物质有氯化铵、硝酸钾、硝酸铵等。
溶解时热量变化不明显的物质有:氯化钠等。
5.物质溶解过程中的能量变化:物质溶解于水,当扩散过程中所吸收的热量大于水合过程中所放出的热量时,溶液的温度就下降。
当吸收热量小于放出热量时,溶液的温度就上升。
当吸收热量等于放出热量时,溶液温度将基本不变。
6.溶解:当把固体溶质加入水后,溶质表面的分子或离子由于本身的振动以及受到水分子的撞击和吸引会逐渐脱离固体表面进入水中,扩散到各个部分成为溶液,这个过程称为溶解。
7.结晶:已溶解的溶质分子或离子,在溶液中不停地运动着,当它们跟未溶解的固体表面碰撞时,又可重新被吸引到固体表面上来,这个过程称为结晶。
8.溶解和结晶的关系:溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率。
9.溶液。
10.结晶水:溶质从其水溶液里析出而形成晶体时,晶体里常常有一定数目的水分子,这样的水分子叫做结晶水。
晶体中的这种水分子,是作为晶体结构中的一种成分而存在于晶体中的。
有些盐溶于水中会形成稳定的水合离子,当这些盐从水溶液里结晶出来时,就带有一定数目的水分子。
溶解过程的能量变化(1)物质溶解于水,当扩散过程中吸收的热量大于水合过程中放出的热量时,溶液的温度下降(填“下降”或“升高”),溶解吸热(填“吸热”或“放热”)。
(2)物质溶解于水,当扩散过程中吸收的热量小于水合过程中放出的热量时,溶液的温度升高(填“下降”或“升高”),溶解放热(填“吸热”或“放热”)。
注意:任何物质溶于水均有热效应,不存在物质溶于水,扩散过程中吸收的热量等于水合过程中放出的热量的情况。
3.中学中常见的溶解时放热的物质有:氢氧化钠、浓硫酸、氧化钙等。
溶解时吸热的物质有氯化铵、硝酸钾、硝酸铵等。
溶解时热量变化不明显的物质有:氯化钠等。
4.溶液结晶:已溶解的溶质分子或离子重新变为固体的过程称为结晶。
5.溶解和结晶的关系:溶解和结晶这两个过程则是同时进行的相反的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系。
6.溶液。
7.结晶水:溶质从其水溶液里析出而形成晶体时,晶体里常常有一定数目的水分子,这样的水分子叫做结晶水。
8.结晶水合物:含有结晶水的物质叫做结晶水合物。
结晶水合物是纯净物。
如CuSO4·5H2O、CaSO4·2H2O、ZnSO4·7H2O等。
9.结晶水合物受热分解的过程:结晶水合物所含的结晶水一般都不稳定,受热后容易失去结晶水,如:CuSO4·5H2O→ CuSO4。
注:白色硫酸铜粉末常用于有无水的检验。
10.风化:结晶水合物中的结晶水不太稳定,在室温下或干燥的空气里会失去一部分或全部结晶水,这种现象叫做风化。
11.潮解:晶体吸收空气中的水蒸气,在晶体表面逐渐形成溶液的现象叫潮解。
12.常见的易风化的物质有:Na2CO3·10H2O、Na3PO4·12H2O、Na2SO4·10H2O等。
13.常见的易潮解的物质有:NaOH、CuSO4、MgCl2-6H2O、红磷、CaCl2、P2O5等。
4.1物质在溶解过程中的能量变化
★知识要点
一、.能量的守恒和转化 1.能源
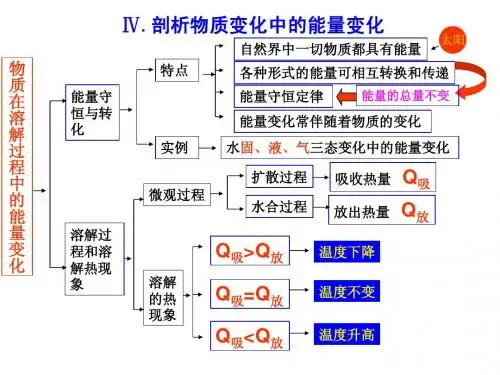
(1)能量转化与守恒定律:能量从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转换和传递过程中,各种形式的能量的总量保持不变。
(2)物质的三态变化中伴随能量变化:
二、.溶解的过程和溶解热现象
1.溶液:溶质分散到溶剂里,形成的均一、稳定的混合物。
2.物质的溶解过程
扩散过程:溶质的分子或离子在水分子作用下从晶体表面向水中扩散,在这一过程中,溶质分子或离子要克服分子或离子间的作用力,需要从外界吸收热量,是物理过程; 水合过程:溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程向外界放出热量,是化学过程。
3.溶解过程中的能量变化——溶解热现象
物质溶解时水溶液温度是升高还是降低,取决于扩散过程吸收热量和水合过程放出热量的相对大小。
扩散 溶解过程 水合 物理过程 化学过程 吸热
放热 能源 一次能源 二次能源 新能源 常规能源 可再生能源,如水能 不可再生能源,如煤炭、石油、天然气 可再生能源,如太阳能、风能、生物质能 不可再生能源,如核聚变燃料、油页岩、油砂 煤制品,如洗煤、焦炭、煤气
石油制品,如汽油、煤油、柴油、液化石油气 电能、氢能、余热、沼气、蒸汽等 吸收能量 固态 液态 气态
吸收能量 放出能量 放出能量
三、溶解和结晶
1.溶解:溶质分散到溶剂中的过程。
2.结晶:晶态溶质从溶液中析出的过程。
3.溶解和结晶的宏观现象和微观过程
溶解和结晶作为宏观现象是不能同时观察到的。
但是,就微观粒子的运动状态而言,溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系——溶解平衡。
4.溶解平衡
在一定条件下的饱和溶液中,当物质溶解速率和物质晶体析出速率相等,这个溶液体系就达到了溶解平衡状态。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率,原来的溶解平衡被破坏,并在新条件下建立新的平衡。
5.结晶水合物
有些盐溶于水中会形成稳定的水合离子,当这些盐从水溶液里结晶出来时,就带有一定数目的水分子。
所带水分子的多少,主要由这些盐电离产生的离子的大小和所带电荷的多少决定,如胆矾CuSO4·5H2O、石膏CaSO4·2H2O、皓矾ZnSO4·7H2O等。
但像NaCl、KBr、KNO3等盐,由于它们在溶液里形成的水合离子很不稳定,所以,当从溶液中结晶时,晶体不带结晶水。
由于结晶水存在于晶体结构中,所以结晶水合物是纯净物。
6.晶体的风化和潮解
1).风化:指在室温下和干燥的空气中,某些结晶水合物失去部分或全部结晶水,使晶体变形和破坏的现象。
风化属于化学变化。
2).潮解:指某些易溶于水的固体物质在潮湿的空气里,逐渐吸收水分而自身溶解其中,在其表面形成饱和溶液的一种现象。
潮解的主要过程是物理变化。
例1、下列说法正确的是()
A.氢氧化钠固体溶解时溶液的温度升高,说明氢氧化钠固体溶解时只发生水合过程B.浓硫酸注入水中,既有放热过程,又有吸热过程
C.氯化钠溶解时,没有放热过程和吸热过程,因此没有明显热效应
D.任何物质的溶解过程都会产生吸热或放热的现象
例2、对于有胆矾晶体存在的饱和硫酸铜溶液,下列措施不能破坏原溶解平衡的是()A.升高温度B.温度不变,蒸发部分水
C.加入少量硫酸铜晶体D.加入少量无水硫酸铜粉末
例3.下列各说法正确的是()
A.氯化钠易潮解,所以食盐应密封保存
B.加热胆矾后颜色由蓝逐渐变白是因为胆矾发生了风化
C.可用无水硫酸铜检验某酒精中是否含有微量的水
D.纯碱是一种常用的强碱
巩固练习
一、单项选择题
1.能源可分为一级能源和二级能源,自然界中以现成形式提供的能量为一级能源,需要依靠其他能源的能量间接制取的能量为二级能源。
下列叙述中,错误的是()A.电能是二级能源B.水力是二级能源
C.天然气是一级能源D.地热能是一级能源
2.天然气、石油、煤等在地球上的蕴藏量是有限的,下列说法中,人类开发能源正确的做法是()
①可利用电解水的方法得到氢气作能源;②可用酒精作能源;③砍伐树木作能源;
④应开发太阳能、核能等新的能源。
A.只有①B.①和④C.②和③D.只有④
3.下列说法不正确的是()
A.电解水生成氢气和氧气时,电能转变成化学能
B.煤燃烧时化学能转变成热能
C.绿色植物光合作用过程中太阳能转变成化学能
D.白炽灯工作时电能全部转变为光能
4.氯化钠固体溶解于水时,溶液的温度变化并不显著,原因是()
A.只发生了水合过程B.只发生了扩散过程
C.溶解过程中没有热效应D.水合过程放出的热量近似于扩散过程吸收的热量5.下列变化过程中,只有放热过程的是()
A.浓硫酸在水中稀释B.干冰汽化
C.水蒸气冷凝成液态水D.液态石油气燃烧
6.“摇摇冰”是一种即用即冷的饮料。
吸食时将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。
该化学物质是()
A.固体硝酸铵B.氯化钠C.固体氢氧化钠D.生石灰
7.如右图所示,在锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷
水,然后再加入足量的下列物质,结果产生了喷泉,水槽中加入的物质可
以是()
A.浓硫酸B.食盐C.硝酸钾D.氯化铵
二、填空题
8.溶质在水中溶解有两个过程。
一个是过程,在这个过程中需要热量,属于变化;一个是过程,这一过程热量,属于变化。
9.氟利昂是空调机中常用的制冷剂。
它是利用氟利昂由液态变为气态时外界能量,使周围环境温度来达到制冷的目的,但是大量的氟利昂排放到大气中会破坏。
10.t℃时,向硫酸铜的饱和溶液中加入ag无水硫酸铜,析出bg硫酸铜晶体,则(b-a)g 是()
A.饱和溶液失去溶剂的质量
B.减少的饱和溶液的质量
C.析出无水物的质量
D.饱和溶液失去溶质的质量。