新课标版化学高三总复习(课件)作业1高考调研2020一轮总复习
- 格式:doc
- 大小:115.50 KB
- 文档页数:7






2020版高考化学一轮复习专题一第二讲物质的量讲义(含解析)[江苏考纲要求] 1.理解溶液、溶解度、溶液中溶质的质量分数等概念。
2.理解物质的量、摩尔质量、气体摩尔体积标准状况下、物质的量浓度、阿伏加德罗常数的含义并能进行有关计算混合气体的平均相对分子质量的相关计算不作要求。
物质的量3.掌握一定溶质质量分数溶液和物质的量浓度溶液的配制方法。
[教材基础自热身] 1.物质的量1含义物质的量是一个物理量,表示含有一定数目粒子的集合体,符号为n,单位为摩尔,用符号mol表示。
2数值1 mol任何物质所含有的微粒数与0.012_kg 12C 所含的碳原子个数相等。
[注意] 摩尔可以计量所有微观粒子或微观粒子的特定组合。
2.阿伏加德罗常数1概念0.012 kg 12C中所含的碳原子数称为阿伏加德罗常数,符号为NA,近似值为6.021023_mol-1。
2物质的量、微粒数N与阿伏加德罗常数的关系为n=。
[注意] 阿伏加德罗常数有单位,应写为6.021023 mol-1,不能仅写数值6.021023。
3.摩尔质量1概念单位物质的量的物质所具有的质量,符号M,当微粒的摩尔质量以g·mol-1为单位时,在数值上等于该微粒的相对分子或原子质量。
2关系物质的量、物质的质量与摩尔质量关系为n=。
[注意] 摩尔质量、相对分子质量、质量是三个不同的物理量,具有不同的单位。
如H2O的摩尔质量为18 g·mol-1,H2O的相对分子质量为18,1 mol H2O的质量为18 g。
[知能深化扫盲点] 求算气体摩尔质量的四种常用方法1根据标准状况下气体的密度ρM=ρ22.4 L·mol-1。
2根据气体的相对密度=D。
3根据物质的质量m和物质的量nM=。
4根据一定质量m的物质中微粒数目N和阿伏加德罗常数NAM=NA·。
[对点练] 1.已知16 g A和20 g B 恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为________________。

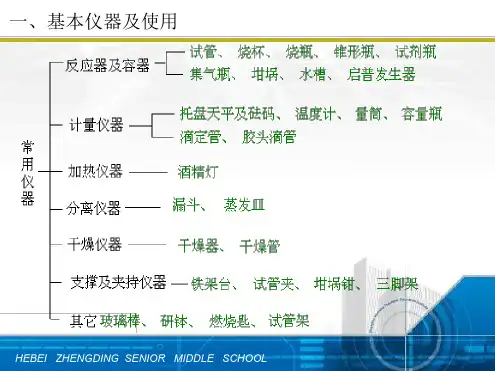

题组层级快练(二)1.下列实验操作或仪器选择正确的是()A.配制240 mL 0.1 mol·L-1 FeSO4溶液需要选择240 mL容量瓶B.配制1 mol·L-1 H2SO4溶液,为了节省时间,可将浓硫酸直接注入容量瓶中C.配制1 mol·L-1 AlCl3溶液时,将氯化铝晶体溶于适量浓盐酸中,加水稀释D.移液时,玻璃棒下端紧靠容量瓶刻度线以上的位置答案 C解析A项,实验室没有规格为240 mL的容量瓶。
应选择规格略大于配制溶液体积的容量瓶,错误;B项,不能在容量瓶中直接稀释浓硫酸,错误;C项,氯化铝易水解,将AlCl3溶于浓盐酸中可抑制AlCl3的水解,正确;D项,移液时,玻璃棒下端应紧靠容量瓶刻度线以下的位置,错误。
2.下列关于物质的量浓度表述正确的是()A.98%的H2SO4物质的量浓度为18.4 mol/L,则49%的H2SO4物质的量浓度为9.2 mol/L B.当2 L水吸收44.8 L氨气(标况)时所得氨水的浓度不是1 mol·L-1,只有当44.8 L(标况)氨气溶于水制得2 L氨水时,其浓度才是1 mol·L-1C.只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl -的物质的量浓度一定相同D.50 mL 1 mol/L的AlCl3溶液中的Cl-浓度与50 ml 3 mol/L的BaCl2溶液Cl-浓度相等答案 B解析A项,由物质的量浓度和质量分数的换算公式得:18.4=1 000×ρ1×98%98,9.2=1 000×ρ2×49%98;解得:ρ1=ρ2=1.84 g·mL-1,但是浓度不同,密度一定不同,说明此说法错误。
A项错误。
B项中说法正确,计算物质的量浓度时,应该用溶液总体积,显然2 L 水吸收44.8 L氨气(标况)时所得氨水的体积不可能是2 L,B项正确。


题组层级快练(一)1.下列说法正确的是()A.摩尔是用来衡量微观粒子多少的一种物理量B.在一定的温度和压强下,各种气体的摩尔体积相等C.阿伏加德罗常数的数值是0.012 kg 14C所含的原子个数D.若气体摩尔体积为22.4 L·mol-1,则所处条件为标准状况答案 B解析考查了物质的量、气体摩尔体积的相关知识。
A项,摩尔是物质的量的单位,不是物理量,故A项错误;B项,气体摩尔体积的定义是1 mol气体在一定条件下所占有的体积,气体体积与温度和压强有关,温度和压强一定的条件下,气体摩尔体积相同,故B项正确;C项,阿伏加德罗常数的数值是0.012 kg 12C所含的原子个数,故C项错误;D项,气体摩尔体积的定义是1 mol气体在一定条件下所占有的体积,气体体积与温度和压强有关,故气体摩尔体积为22.4 L·mol-1,不一定是在标况下,故D项错误。
2.(2018·山东)雾霾天气对环境造成了严重影响,部分城市开展PM2.5和臭氧的监测。
下列有关说法正确的是()A.臭氧的摩尔质量是48 gB.同温同压条件下,等质量的氧气和臭氧体积比为2∶3C.16 g臭氧中含有6.02×1023个原子D.1.00 mol 臭氧中含有电子总数为18×6.02×1023答案 C解析A项,臭氧的摩尔质量是48 g·mol-1,错误;B项,同温同压条件下,等质量的氧气和臭氧体积比为3∶2,错误;D项,1.00 mol 臭氧中含有电子总数为24×6.02×1023,错误。
3.(2019·洛阳模拟)下列叙述中正确的是()A.硫酸的摩尔质量是98 gB.铁原子的摩尔质量等于铁的相对原子质量C.标准状况下,22.4 L的O2质量是32 gD.2 g H2所含原子物质的量为1 mol答案 C解析A项,硫酸的摩尔质量为98 g/mol,故A项错误;B项,铁原子的摩尔质量是56 g/mol,相对原子质量是56,故B项错误;C项,22.4 L氧气标况下物质的量=22.4 L=1 mol,22.4 L/mol=1 mol,质量=1 mol×32 g/mol=32 g,故C项正确;D项,2 g氢气的物质的量= 2 g2 g/mol氢气为双原子分子,H原子的物质的量=2 mol,故D项错误。
4.下列两种气体的分子数一定相等的是()A.质量相等、密度不同的N2和C2H4 B.体积相等的CO和N2C.等温、等体积的O2和N2 D.等压、等体积的N2和CH4答案 A解析A项,N2和C2H4的摩尔质量相等,质量相等,故其物质的量也相等,则其所含分子数也一定相等,正确。
B、C、D三项可根据阿伏加德罗定律及推论加以判断,所含分子数均不一定相等。
5.设N A为阿伏加德罗常数的数值,下列说法正确的是()A.23 g Na与足量H2O反应完全后可生成N A个H2分子B.1 mol乙烯分子含有2N A个碳碳双键C.标准状况下,22.4 L N2和H2混合气中含N A个原子D.标准状况下,22.4 L Cl2与足量Fe和Cu混合物点燃,反应后,转移的电子为2N A个答案 D解析23 g Na的物质的量为1 mol,而1 mol Na与足量水反应可生成0.5 mol H2,即生成0.5N A个H2分子,A项错误;1个乙烯分子中含有一个碳碳双键,1 mol乙烯中含有N A个碳碳双键,B项错误;标准状况下22.4 L混合气体的物质的量为1 mol,而N2和H2均为双原子分子,因此1 mol混合气体中含2N A个原子,C项错误;标准状况下,22.4 L Cl2的物质的量为1 mol,与足量Fe与Cu混合物点燃,Cl2得到2 mol电子,转移的电子为2N A个,D项正确。
6.(双选)N A为阿伏加德罗常数的值。
下列说法正确的是()A.12 g熔融的NaHSO4中的离子总数为0.3N AB.向1 L 0.1 mol·L-1氯化铵溶液中通入少量氨气调节溶液为中性,则NH4+的数目为0.1N A C.4.2 g聚丙烯中含有的碳原子数为0.3N AD.向1 L 1 mol·L-1 FeBr2溶液中通入足量氯气,则转移电子数为3N A答案BC解析熔融的NaHSO4中只含Na+、HSO4-,故12 g (0.1 mol)熔融的NaHSO4中含0.2 mol离子,A 项错误;根据电荷守恒,c(NH 4+)+c(H +)=c(Cl -)+c(OH -),溶液呈中性,则c(NH 4+)=c(Cl -)=0.1 mol·L -1,NH 4+的数目为0.1N A ,B 项正确;聚丙烯为,4.2 g 聚丙烯中碳原子的物质的量为4.242nmol ×3 n =0.3 mol ,C 项正确;足量氯气既可以氧化Br -,也可以氧化Fe 2+,还可以与水发生氧化还原反应,,故转移的电子数大于3N A ,D 项错误。
7.设N A 为阿伏加德罗常数的值,下列叙述正确的是( )A .pH =1的稀硫酸中含有的H +数为0.1N AB .1 mol Na 2O 和Na 2O 2混合物中含有的阴、阳离子总数是3N AC .50 mL 18.4 mol/L 浓硫酸与足量铜微热反应,生成SO 2分子数目为0.46N AD .80 g NH 4NO 3晶体中含有NH 4+小于N A 个答案 B解析 溶液体积不知,pH =1的稀硫酸中含有的H +数不能确定,A 项不正确;Na 2O 和Na 2O 2含有的阴、阳离子总数都是3个,B 项正确;一定量的浓硫酸与足量铜反应时,当硫酸浓度变稀反应会停止,也就是说提供的硫酸不可能全部反应,C 项不正确;NH 4NO 3晶体中含有的NH 4+不会水解,80 g NH 4NO 3晶体中含有N A 个NH 4+,D 项错误。
8.N A 代表阿伏加德罗常数的值。
下列有关说法正确的是( )A .工业上加热Ag 2O 分解制银时,若转移2 mol 电子,则产生O 2的分子数为N AB .乙醇催化氧化生成44 g 乙醛时转移电子数为N AC .在标准状况下,11.2 L H 2和D 2的混合气体中含质子数为N AD .1 mol N 2和5 mol H 2在一定条件下反应生成NH 3的数目为2N A答案 C解析 工业炼银时发生反应2Ag 2O=====△4Ag +O 2↑,转移2 mol 电子时生成0.5 mol O 2,A项错误;2CH 3CH 2OH +O 2――→Cu 或Ag △2CH 3CHO +2H 2O ,n(CH 3CHO)=44 g 44 g·mol -1=1 mol ,生成1 mol CH 3CHO 时转移电子数为2N A ,B 项错误;1个H 2和1个D 2分子中均含有2个质子,则0.5 mol H 2和D 2的混合气体中含有的质子数为N A ,C 项正确;N 2和H 2合成氨的反应是可逆反应,N 2的转化率小于100%,D 项错误。
9.(2019·陕西冲刺)用N A表示阿伏加德罗常数的值,下列叙述中不正确的组合是()①12.4 g白磷(分子式为P4)中含有P-P共价键0.6N A②电解精炼铜的过程中,每转移N A个电子时,阳极溶解铜的质量为32 g③常温下1.0 L 0.1 mol·L-1 NH4Cl溶液中,NH4+和H+总数等于0.1N A④一定条件下6.4 g SO2与足量氧气反应生成SO3,转移电子数为0.2N A⑤1 mol羟基(-OH)与17 g NH3所含电子数都为N A⑥适量铜粉溶解于1 L 0.5 mol·L-1稀硝酸中,当生成2.24 L NO时,溶液中氮原子数为0.4N A A.①②④⑤⑥B.②③④⑤⑥C.①③⑤⑥D.③④⑤⑥答案 B解析①12.4 g白磷的物质的量为12.4 g31×4 g/mol=0.1 mol,而1 mol白磷中含有6 mol P-P 共价键,则12.4 g白磷(分子式为P4)中含有P-P共价键0.6N A,故①正确;②由Cu-2e-===Cu2+,每转移N A个电子时,阳极溶解铜的质量为0.5 mol×64 g/mol=32 g,但阳极材料为粗铜,则阳极溶解铜的质量小于32 g,故②错误;③根据电荷守恒可知:n(NH4+)+n(H +)=n(OH-)+n(Cl-),而1.0 L 0.1 mol·L-1 NH4Cl溶液中n(Cl-)=0.1 mol,故NH4+和H +的物质的量之和大于0.1 mol,故其数目总和大于0.1N A,故③错误;④SO2和氧气的反应是可逆反应,不能进行彻底,故6.4 g SO2即0.1 mol二氧化硫与足量氧气反应转移的电子的物质的量小于0.2 mol,故④错误;⑤1 mol羟基(-OH)中含有9 mol电子,17 g NH3所含电子为10 mol,显然电子数不同,故⑤错误;⑥若为标准状况,由3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O可计算出溶液中氮原子,但不知是否为标准状况,则无法利用NO的体积来计算其物质的量,故⑥错误。
10.某气体的摩尔质量为M g·mol-1,N A表示阿伏加德罗常数,在一定的温度和压强下,体积为V L的该气体所含有的分子数为x。
则MxV N A表示的是()A.V L该气体的质量(以g为单位) B.1 L该气体的质量(以g为单位)C.1 mol该气体的体积(以L为单位) D.1 L该气体中所含的分子数答案 B解析x除以N A为该气体的物质的量,然后乘以M表示其质量,再除以V表示1 L该气体的质量。
11.(2019·河北区二模)用N A 表示阿伏加德罗常数的值。
下列叙述正确的是( )A .CH 5+、-OH 、NH 3各1 mol ,所含的电子数均为10N AB .3.6 g 重水中含有的中子数为2N AC .10 g 溶质质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2N AD .一定条件下,6.4 g 铜与过量的硫反应,转移电子数目为0.2N A答案 C解析 A 项,—OH 中含9个电子,故1 mol —OH 中含9N A 个电子,故A 项错误;B 项,3.6 g 重水的物质的量为: 3.6 g 20 g/mol=0.18 mol ,重水中含有10个中子,则0.18 mol 重水中含有1.8 mol 中子,含有的中子数为1.8N A ,故B 项错误;C 项,10 g 质量分数为46%的乙醇水溶液中含有乙醇4.6 g ,含有0.1 mol 乙醇,0.1 mol 乙醇中含有0.6 mol H 原子;溶液中水的质量为10 g -4.6 g =5.4 g ,水的物质的量为0.3 mol ,含有0.6 mol 氢原子,所以该乙醇的水溶液中含有1.2 mol H 原子,含有的氢原子总数为1.2N A ,故C 项正确;D 项,Cu 与S 反应生成Cu 2S ,反应中1 mol Cu 转移1 mol 电子,则6.4 g 铜与过量的硫反应,转移电子数目为0.1N A ,故D 项错误。