1至36号元素名称,符号和核电荷数
- 格式:docx
- 大小:18.56 KB
- 文档页数:3



1到36号元素简写1号:氢,H,核电荷数1;
2号:氦,He,核电荷数2;
3号:锂,Li,核电荷数3;
4号:铍,Be,核电荷数4;
5号:硼,B,核电荷数5;
6号:碳,C,核电荷数6;
7号:氮,N,核电荷数7;
8号:氧,O,核电荷数8;
9号:氟,F,核电荷数9;
10号:氖,Ne,核电荷数10;
11号:钠,Na,核电荷数11;
12号:镁,Mg,核电荷数12;
13号:铝,Al,核电荷数13;
14号:硅,Si,核电荷数14;
15号:磷,P,核电荷数15;
16号:硫,S,核电荷数16;
17号:氯,Cl,核电荷数17;
18号:氩,Ar,核电荷数18;
19号:钾,K,核电荷数19;
20号:钙,Ca,核电荷数20;
21号:钪,Sc,核电荷数21;
22号:钛,Ti,核电荷数22;23号:钒,V,核电荷数23;24号:铬,Cr,核电荷数24;25号:锰,Mn,核电荷数25;26号:铁,Fe,核电荷数26;27号:钴,Co,核电荷数27;28号:镍,Ni,核电荷数28;29号:铜,Cu,核电荷数29;30号:锌,Zn,核电荷数30;31号:镓,Ga,核电荷数31;32号:锗,Ge,核电荷数32;33号:砷,As,核电荷数33;34号:硒,Se,核电荷数34;35号:溴,Br,核电荷数35;36号:氪,Kr,核电荷数36。


折叠元素表顺口溜我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜;我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离;我是硼,电子穷,我和本族大不同;我是碳,反应慢,既能成链又成环;我是氮,我阻燃,加氢可以合成氨;我是氧,不用想,离开我就憋得慌;我是氟,最恶毒,抢个电子就满足;我是氖,也不赖,通电红光放出来;我是钠,脾气大,遇酸遇水就火大;我是镁,最爱美,摄影烟花放光辉;我是铝,常温里,浓硫酸里把澡洗;我是硅,色黑灰,信息元件把我堆;我是磷,害人精,剧毒列表有我名;我是硫,来历久,沉淀金属最拿手;我是氯,色黄绿,金属电子我抢去;我是氩,活性差,霓虹紫光我来发;我是钾,把火加,超氧化物来当家;我是钙,身体爱,骨头牙齿我都在;我是钪,耐温广,高温合金我来帮;我是钛,过渡来,航天飞机我来盖;我是钒,酸碱烦,如虎添翼钢加钒;我是铬,正六铬,酒精过来变绿色;我是锰,价态广,七氧化物爆炸猛;我是铁,多用也,不锈钢喊我叫爷;我是钴,蓝色母,癌症要用六十钴;我是镍,无锈铁,镍钛合金能记忆;我是铜,色紫红,投入硝酸气棕红;我是锌,人必需,体内我立大功勋;我是镓,易熔化,六十七镓是奇葩;我是锗,可晶格,红外窗口能当壳;我是砷,颜色深,三价元素夺你魂;我是硒,补人体,口服液里有玄机;我是溴,挥发臭,液态非金我来秀;我是氪,很耐克,通电就显橘红色;我是铷,碱金属,沾水烟花钾不如;我是锶,天青石,八十七锶帮医师;我是钇,难分离,我在特种合金里;我是锆,熔点高,石头里面很多锆;我是铌,能吸气,网络让我当NB;我是钼,像石墨,提高再结晶温度;我是锝,能放射,地壳里面我没得;我是钌,量很少,王水我也应得了;我是铑,光泽好,抗腐蚀性我很好;我是钯,把氢拉,吸氢我就破裂啦;我是银,不是人,只有硝酸氟化溶;我是镉,污染的,当年日本痛痛得;我是铟,软如金,轻微放射宜小心;我是锡,五金里,与铅熔合成焊锡;我是锑,非SB,虽说锑锅那是铝;我是碲,毒性低,又是金属又非金;我是碘,升华烟,遇到淀粉蓝点点;我是氙,很陌生,太阳灯啊我来填;我是铯,金黄色,入水爆炸容器破;我是钡,硫酸钡,可以用来检查胃;我们是镧系,个个都很稀;镧!铈!镨!工业维生素;钕能用来造磁铁;钷有放射性;钐!铕!钆!铽!合金很奇特;还有镝钬铒铥镱镥;我是铪,笑哈哈,我和锆矿是一家;我是钽,能抗酸,我遇强酸比金懒;我是钨,高温度,其他金属早呜呼;我是铼,催化爱,我把氢气吸过来;我是锇,和铱合,保持百年很耐磨;我是铱,做钢笔,只有千万分之一;我是铂,很贵重,含量比金还淡薄;我是金,很稳定,扔进王水影无形;我是汞,吸入痛,温度高低我能懂;我是铊,能脱发,投毒出名看清华;我是铅,能储电,子弹头里也出现;我是铋,半衰期,大于宇宙的年纪;我是钋,核能破,α粒子我有很多;我是砹,极少在,要找到我很难哎;我是氡,放射中,三天我就造真空;我是钫,人造上,廿三分钟我就亡;我是镭,千年累,我把癌细胞变没;我们是锕系,个个会放粒;锕!钍!镤!航飞做热源;铀造原子弹很牛;镎也造炸弹;钚!镅!锔!锫!做核反应堆;还有锎锿镄钔锘铹;我们超锕系,我们都超重;鑪,钅杜,钅喜,钅波,钅黑,钅麦,鐽,錀,鎶,Uut,鈇,Uup,鉝,Uus,Uuo。

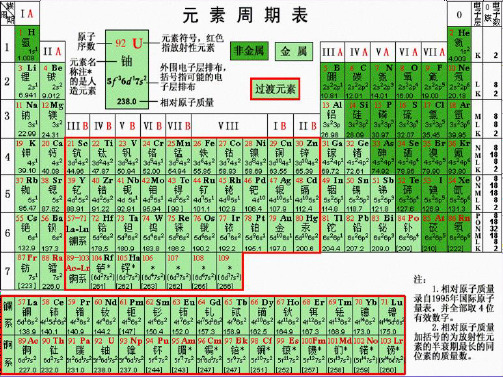
第一章物质结构元素周期律第一节元素周期表重难点一元素周期表1.构成原子(离子)的微粒间关系(1)原子序数=核电荷数=核内质子数=核外电子数(原子中)。
(2)离子电荷数=质子数-核外电子数。
(3)质量数(A)=质子数(Z)+中子数(N)。
(4)质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
(5)质子数(Z)=阴离子的核外电子数-阴离子的电荷数。
2.元素周期表的结构(3)过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。
“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。
“第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。
重难点二 零族定位法确定元素的位置 1.2.比大小定周期比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的两种0族元素,那么该元素就和序数大的0族元素处于同一周期。
3.求差值定族数(1)若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA 族或ⅡA 族。
(2)若比相应的0族元素少1~5时,则应处在同周期的ⅢA ~ⅦA 族。
(3)若差其他数,则由相应差值找出相应的族。
重难点三 元素的性质与原子结构 1.碱金属单质的相似性和递变性 (1)相似性①与O 2反应生成相应的氧化物,如Li 2O 、Na 2O 等。
②与Cl 2反应生成RCl ,如NaCl 、KCl 等。
③与H 2O 反应,能置换出H 2O 中的氢,反应通式为2R +2H 2O===2ROH +H 2↑。
④与非氧化性酸反应,生成H 2,反应通式为2R +2H +===2R ++H 2↑。
(R 表示碱金属元素)(2)递变性从Li 到Cs ,随着核电荷数的增加,碱金属元素原子的电子层数逐渐增多,原子核对核外电子的吸引能力逐渐减弱,失电子能力逐渐增强,金属性逐渐增强。



1~36号元素基态原子的核外电子排布广东郑春平基态原子是处于能量最低状态下的原子,基态原子的核外电子排布,决定了元素周期表的划分和原子半径的变化规律。
要认识基态原子的核外电子排布,必需要掌握排布原则和电子在原子轨道上的排布顺序。
.一、基态原子的核外电子排布三大原则1、能量最低原则:核外电子的排布要使整个原子的能量最低,以形成稳定结构。
2、泡利不相容原理:一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋方向必须相反。
3、洪特规则:对于基态原子,电子在能量相同的轨道上排布时,应尽可能的分占不同的轨道并且自旋方向相同。
洪特规则实际上是为了更好的遵循能量最低原则,根据光谱实验结果,洪特进一步指出,能量相同的原子轨道在全充满(p6和d10)、半充满(p3和d5)和全空(p0和d0)状态时,体系能量最低,原子最稳定。
二、电子在原子轨道上的排布顺序多电子原子中,电子填充电子轨道时,一般先填满能量低的轨道,再填能量高的轨道原子轨道能量的高低存在以下规律:1、相同电子层上原子轨道能量的高低:ns<np<nd<nf2、.形状相同的原子轨道能量的高低:1s<2s<3s<4s……3、电子层和形状相同的原子轨道的能量相等,如2p x、2p y、2p z轨道的能量相等因此随核电荷数递增,基态原子的电子按如下顺序填入核外电子运动轨道:1S,2S,2P,3S,3P,4S,3d,4P……。
其中,S、P、d分别有1、3、5个轨道,每个轨道只能容纳两个自旋方向相反的电子,当原子最外层的轨道能量相同时,最后几个电子的排布要符合洪特规则。
当出现d轨道时,电子按ns、(n-1)d、np顺序排布,这样的排布方式使体系的能量最低,这一规律叫“能级交错”。
电子排布顺序如图:三、原子核外电子排布的表示方法电子排布式:用数字在能级符号的右上角表明该能级上排布的电子数;为了避免电子排布式过于繁琐,可以把内层电子达到稀有气体结构的部分以相应稀有气体元素符号外加方括号表示。

一.元素周期表1.原子序数=核电荷数=核内质子数=核外电子数2.主族元素最外层电子数=主族序数3.电子层数=周期序数4.碱金属元素:密度逐渐增大,熔沸点逐渐变大,自上而下反应越来越剧烈银白色金属,密度小,熔沸点低,导电导热性强5.判断元素金属性强弱的方法:单质与水(酸)反应置换出氢的难易程度最高价氧化物的水化物(氢氧化物)的碱性强弱单质间的置换6.卤族元素:密度逐渐增大,熔沸点逐渐升高与氢气反应剧烈程度越来越弱,生成氢化物稳定性渐弱7.判断元素非金属性强弱的方法:与氢气生成气态氢化物的难易程度以及氢化物的稳定性最高价氧化物的水化物的酸性单质间的置换8.质量数:核内所有质子和中子的相对质量取近似整数相加9.核素:具有一定数目质子和一定数目的中子的一种原子10.同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素天然稳定存在的同位素,无论是游离态还是化合态各同位素所占的原子个数百分比一般是不变的在相同状况下,各同位素的化学性质基本相同(几乎完全一样),物理性质有所不同12.原子相对原子质量=1个原子的质量/(1/12 C12的原子质量)13.原子的近似相对原子质量=质量数14.元素的相对原子质量=各同位素的相对原子质量的平均值= A·a%+B·b%…15.元素的近似相对原子质量=各同位素质量数的平均值= A·a%+B·b%…二.元素周期律1.K、L、M、N、O、P、Q(1,2,3,4,5,6,7,)层数越大,电子离核越远,其能量越高2.能量最低原理3.各电子层最多容纳电子数:2n^24.最外层不超过8,次外层18,倒数第三层325.原子半径:同周期主族元素,原子半径从左到右逐渐减小同主族元素,元素原子半径从上到下逐渐增大6.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的结果(实质)7.同一周期元素,电子层数相同,从左到右,核电荷数增多,原子半径减小,失电子的能力逐渐减弱,得电子的能力逐渐增强8.同一主族,自上而下,元素的金属性逐渐增强,非金属性逐渐减弱,最外层电子数相同,电子层数增多,原子半径增大9.最高正价=最外层电子数最低负价=8—最外层电子数10.各周期元素种类:2,8,8,18,32,3211.稀有气体原子序数;2,10,18,36,54,8612.同族上下相邻的原子序数差:2,8,18,3213.同周期IIA族与IIIA族原子序数相差:1,1,11,11,2514.电子层数不同,原子序数(核电荷数)均不同时,电子层数越多,半径越大15.电子层数相同,原子序数(核电荷数)不同时,原子序数(核电荷数)越大,半径越小16.电子层数,原子序数(核电荷数)均相同时,核外电子数越多,半径越大17.电子排布相同的离子,离子半径随核电荷数递增而减小选修三.原子结构与性质1.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.2.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.3.原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.4.洪特规则的特例:对于一个能级,当电子排布为充满、半充满或全空时,是比较稳定的5.元素电离能:第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。

元素周期表1869年以前,科学家已经陆续发现了63种元素,这些元素之间似乎没有任何联系,好像互不相干。
俄国科学家门捷列夫(Dmitry Ivanovich Mendeleev,1834~1907)在前人工作的基础上,对元素及其性质进行了系统的研究,他将当时已知的63种元素依据相对原子质量大小规律进行排列,制成的表格成为现代元素周期表的雏形。
利用周期表,门捷列夫成功预测了当时尚未发现的元素(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序数越大,X 射线的频率就越高,因此他认为原子核的正电荷数决定了元素的化学性质,并把元素依照核内正电荷数(即质子数)排列,经过多年修订后才成为当代的元素周期表。
随着人们对元素地进一步认识,元素周期表得到了完善,现在元素周期表已经成为人们研究化学、研究物质的一个必备的工具。
在化学学科领域中使用的元素周期表提供的信息更突出了元素的原子结构信息。
让我们走进教材,充分认识元素周期表。
一、元素周期表的出现和发展1.元素周期表的出现和发展:2.原子序数:(1)含义:按照元素在周期表中的顺序给元素的编号。
(2)原子序数与原子结构的关系。
原子序数=核电荷数=__质子数__=__核外电子数__。
二、认识元素周期表的结构1.编排原则:2.周期表中周期的划分和一般特点:请将族所含元素与其名称用线连接。
①第ⅠA族(除氢)a.稀有气体元素②第ⅦA族b.碱金属元素③0族c.卤族元素答案:①—b②—c③—a1.19世纪中叶,俄国化学家门捷列夫的突出贡献是(B)A.提出原子学说B.编制出第一张元素周期表C.提出分子学说D.发现氧气解析:俄国化学家门捷列夫发现元素周期律,并编制出第一张元素周期表,所以选B。
2.第5周期ⅡA族元素的原子序数为(C)A.36 B.37C.38 D.39解析:因周期数等于电子层数,主族序数等于最外层电子数,则原子结构示意图为,所以选C。
3.铝元素在周期表中的位置是(B)A.第2周期ⅣA族B.第3周期ⅢA族C.第3周期ⅥA族D.第2周期ⅢA族解析:铝为13号元素,其原子结构示意图为,周期数等于电子层数,主族序数等于最外层电子数,所以选B。


化学元素周期表和周期律一.完成下列元素周期表1.并标明元素性质变化趋势、非金属性最强和金属性最强元素。
12.、完成氢化物周期表并标明氢化物稳定性趋势、氢化物最稳定的物质23.、完成最高价氧化物对于水化物周期表并标明最高价氧化物对于水化物性质变化趋势、最强酸和最强碱3第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克二.熟悉元素周期表的结构,熟记前36号元素及主族和零族元素的名称及符号。
1.记住7个横行,即个周期(短、长)。
2.记住18个纵行,包括个主族(ⅠA~ⅦA)、个副族(ⅠB~ⅦB)、1个第族(第8、9、10纵行)和1个族(即稀有气体元素)。
3.记住金属与非金属元素的分界线(氢、硼、硅、砷、碲、砹与锂、铝、锗、锑、钋之间)。
三、特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯()。
2、最活泼的非金属元素、无正价的非金属元素、无含氧酸的非金属元素、无氧酸(或氢化物)可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子的还原性最弱的元素是氟()。
3、最强的碱是()最强的含氧酸是()最高价氧化物的水化物能与其气态氢化物发生化合反应的短周期元素是()最高价氧化物的水化物能与其气态氢化物发生氧化还原反应的短周期元素是(())气态氢化物和它的氧化物在常温下生成该元素的单质的元素是()3、最稳定的气态氢化物是()气态氢化物中含氢质量分数最大的是()最小的是()4、形成化合物种类最多的元素是()、单质是自然界中硬度最大的物质的元素、气态氢化物中氢的质量分数最大的元素是碳()。
空气中含量最多的元素是()或气态氢化物的水溶液呈碱性的元素是氮()。
地壳中含量最多的元素是()地壳中含量最多的金属元素是()5、焰色反应呈黄色的元素是()透过蓝色钴玻璃观察焰色反应呈紫色的元素是()46、常温下单质呈液态的元素是()常温下单质呈液态的非金属元素是()7、无氧酸能腐蚀玻璃的元素是()最易着火的非金属单质的元素是()8、既能与酸反应又能与碱溶液反应可产生H2的金属元素为铝(),与碱溶液反应可产生H2的非金属元素为(),Al2O3和Al(OH)3都有两性。



中考化学知识记忆班级姓名1.核电荷数1-20的元素名称、符号氢H 氦He 锂Li铍Be 硼B ,碳C 氮N 氧O 氟F氖Ne 钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 钾K 钙Ca2.元素符号、相对原子质量:氢H 1 氦 He4 碳 C 12 氮N 14 氧O16 氟F19 氖 Ne20 钠Na23 镁Mg24 铝Al27 硅Si28 磷P31 硫S32 氯 Cl35.5 氩 Ar40 钾K39 钙Ca40 锰 Mn55 铁Fe56 铜Cu64 锌Zn65 银Ag108 钡Ba137 铂 Pt195 金Au197 汞Hg 201 碘I 1273.常见离子和化合物中元素的化合价:氢离子H+钠离子Na+钾离子K+银离子Ag+铵根离子NH4+ 钙离子Ca2+镁离子Mg2+铜离子Cu2+钡离子Ba2+锌离子Zn2+亚铁离子Fe2+ 铁离子Fe3+铝离子Al3+氯离子Cl-氢氧根离子OH-硝酸根离子NO3- 氧离子O2-硫酸根离子SO42-碳酸根离子 CO32-1+ H1+Na1+K1+Ag14+NH2+Ca2+Mg2+Cu2+Ba2+Zn)(2亚铁元素+Fe)(3铁元素+Fe3+Al1-Cl1-OH13-NO2-O24-SO23-CO(碳酸根显-2价或显-2价的碳酸根)4.常见物质的化学式与名称:单质:C:碳 S:硫 P:磷 Fe:铁Mg:镁 Al:铝 Hg:汞 Zn:锌Cu:铜Ag:银 O2:氧气 H2:氢气 N2:氮气 O3:臭氧氧化物CO:一氧化碳 CO2:二氧化碳 SO2:二氧化硫 MnO2:二氧化锰 SO3:三氧化硫 H2O2:过氧化氢CuO:氧化铜 CaO:氧化钙 MgO:氧化镁 HgO:氧化汞 Fe2O3:氧化铁 Al2O3:氧化铝H2O:水 P2O5:五氧化二磷 Fe3O4:四氧化三铁酸:HCl:盐酸 H2SO4:硫酸 HNO3:硝酸 H2CO3:碳酸 H2SO3亚硫酸CH3COOH:醋酸碱:NaOH:氢氧化钠 Ca(OH)2:氢氧化钙 KOH:氢氧化钾 Mg(OH)2:氢氧化镁Cu(OH)2:氢氧化铜NH3 .H2O氨水 Fe(OH)3:氢氧化铁 Al(OH)3:氢氧化铁盐酸盐:KCl:氯化钾 NaCl:氯化钠 KCl:氯化钾 AgCl:氯化银 CuCl2:氯化铜 CaCl2:氯化钙MgCl2:氯化镁 ZnCl2:氯化锌 BaCl2:氯化钡 FeCl2:氯化亚铁 AlCl3:氯化铝 FeCl3:氯化铁碳酸盐CaCO3:碳酸钙 Na2CO3:碳酸钠 NaHCO3:碳酸氢钠BaCO3:碳酸钡 K2CO3:碳酸钾NH4HCO3:碳酸氢铵硫酸盐:Na2SO4:硫酸钠ZnSO4:硫酸锌 MgSO4:硫酸镁 CaSO4:硫酸钙 CuSO4:硫酸铜 BaSO4:硫酸钡FeSO4:硫酸亚铁 Fe2(SO4)3:硫酸铁 Al2(SO4)3:硫酸铝 (NH4)2SO4:硫酸铵 Na2SO3:亚硫酸钠硝酸盐:AgNO3:硝酸银 NaNO3:硝酸钠 Cu(NO3)2:硝酸铜 KNO3:硝酸钾 H4NO3:硝酸铵 NaNO2:亚硝酸钠钾盐:KMnO4:高锰酸钾 K2MnO4:锰酸钾 KClO3:氯酸钾有机化合物:C2H5OH:乙醇 C6H12O6:葡萄糖 CH4:甲烷九年级化学方程式分类: 1.碳充分燃烧:C+O 2点燃CO 2 2.碳不充分燃烧:2C+O 2点燃2CO3.一氧化碳燃烧:2CO+O 点燃2CO 2 4.产生一氧化碳:C+CO 高温2CO5.硫燃烧:S+O 点燃SO 2 6.红磷燃烧:4P+5O 2点燃2P 2O 5 7.氢气燃烧:2H 2+O 点燃2H 2O 8.铁燃烧:3Fe+2O 点燃Fe 3O 4 9.镁燃烧:2Mg+O 点燃2Mg O 10.铝燃烧:4Al+3O 点燃2Al 2O 3 11.甲烷燃烧:CH 4+2O 2点燃CO 2+2H 2O 12.酒精燃烧:C 2H 5OH+3O 2点燃2CO 2+3H 2O13.呼吸原理: C 6H 12O 6+6O 26CO 2+6H 2O 14.高锰酸钾制氧气: △K 2MnO 4+MnO 2+O 2↑15.氯酸钾制氧气: 2KClO 3MnO 22KCl+3O 2↑ 16.过氧化氢制氧气: 2H 2O 2 MnO 22H 2O +O 2↑17.水通电分解: 2H 2O2H 2↑+O 2↑ 18.氧化汞分解: 2HgO △2Hg+O 2↑19.实验室制氢气的原理:Zn+H 2SO 4=ZnSO 4+H 2↑ 20.镁或硫酸性质:Mg+H 2SO 4=MgSO 4+H 2↑ 21.铁或硫酸性质:Fe+H 2SO 4=FeSO 4+H 2↑ 22.铝或硫酸性质:2Al+3H2SO4=Al2(SO4)3+3H2↑ 23.镁或盐酸性质:Mg+2HCl=MgCl2+H2↑ 24.锌或盐酸性质:Zn+2HCl=ZnCl2+H2↑ 25.铁或盐酸性质:Fe+2HCl=FeCl2+H2↑ 26.铝或盐酸性质:2Al+6HCl=2AlCl 3+3H 2↑ 27.酸或碱的性质:NaOH+HCl=NaCl+H 2O 28.酸或碱的性质:Ca(OH)2+2HCl=CaCl 2+2H 2O 29.酸或碱的性质:2NaOH+H 2SO 4=Na 2SO 4+2H 2O 30.酸或碱的性质:Ca(OH)2+H 2SO 4=CaSO 4+2H 2O 30.除铁锈的原理或金属氧化物与酸的性质: Fe 2O 3+6HCl=2FeCl 3+3H 2O Fe 2O 3+3H 2SO 4=Fe 2(SO 4)3+3H 2O 31.制取CO 2或CaCO 3 作补钙药剂:CaCO 3+2HCl=CaCl 2+CO 2↑+H 2O32.碳酸盐或酸的性质:Na 2CO 3+2HCl=2NaCl+CO 2↑+H 2O 33.治疗胃酸过多症的原理:NaHCO 3 +HCl=NaCl+CO 2↑+H 2O 34.氯化钠与硝酸银反应产生白色沉淀:NaCl+AgNO 3=NaNO 3+AgCl ↓ 35.制取氢氧化钠的原理:Ca(OH)2+Na 2CO 3=CaCO 3↓+2NaOH36.氢氧化钠与硫酸铜反应产生蓝色沉淀:2NaOH+CuSO 4=Na 2SO 4+Cu(OH)237.制取水煤气的原理:C+H 2高温H 2+CO 38.氢气还原氧化铜:H 2+CuO △Cu+H 2O 39.碳还原氧化铜:高温2Cu+CO 2↑ 40.一氧化碳还原氧化铜:CO+CuO △Cu+CO 241.氢气还原氧化铁:Fe 2O 3+3H 高温2Fe+3H 2O 42.碳还原氧化铁:2Fe 2O 3高温4Fe+3CO 2↑43.工业炼铁的原理:Fe 2O 3+3CO高温2Fe+3CO 2 44.铁置换硫酸铜中的铜:Fe+CuSO 4=Cu+FeSO 445.铜置换硝酸银中的银:Cu+2AgNO 3=2Ag+Cu(NO 3)2 46.铝置换硫酸铜中的铜:2Al+3CuSO 4=3Cu+Al 2(SO 4)3 47.生石灰制熟石灰:H 2O+CaO=Ca(OH)2 48.碳酸不稳定:H 2CO 3=H 2O+CO 2↑ 49.工业制生石灰的原理:CaCO 高温CaO+CO 2↑ 50.检验CO 2或澄清石灰水变浑浊原理:CO 2+Ca(OH)2=CaCO 3↓+H 2O51.烧碱变质的原理:CO 2+2NaOH=Na 2CO 3+H 2O 52.碱与非金属氧化物的性质SO 2+2NaOH=Na 2SO 3+H 2O SO 3+2NaOH=Na 2SO 4+H 2O 53.非金属氧化物的性质:H 2O+CO 2 =H 2CO 3 H 2O+SO 2 =H 2SO 3 H 2O+SO 3 = H 2SO 4: △班级姓名 1.书写元素符号、相对原子质量:氢氦碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙锰铁铜锌银钡铂金汞2.书写常见的离子和相应元素的化合价:氢离子钙离子镁离子钠离子钾离子铁离子银离子铜离子钡离子铝离子锌离子钾离子氢氧根离子硫酸根离子硝酸根离子氯离子碳酸根离子铵根离子亚铁离子3.用化学式表示下面常见的物质:单质:碳硫磷铁镁铝汞锌铜银氧气氧气氮气臭氧氧化物:水一氧化碳二氧化碳二氧化硫二氧化锰三氧化硫过氧化氢氧化铜氧化钙氧化镁氧化汞氧化铁氧化铝五氧化二磷四氧化三铁酸:盐酸硫酸硝酸碳酸亚硫酸醋酸碱: 氢氧化钠氢氧化钙氢氧化钾氢氧化镁氢氧化铜氢氧化铁氨水盐酸盐:氯化钾氯化钠氯化钾氯化银氯化铜氯化钙氯化镁氯化锌氯化钡氯化铝氯化铁氯化亚铁碳酸盐:碳酸钙碳酸钠碳酸氢钠碳酸钡碳酸钾碳酸氢铵硫酸盐:硫酸钠硫酸锌硫酸镁硫酸钙硫酸铜硫酸钡硫酸亚铁硫酸铁硫酸铝硫酸铵亚硫酸钠硝酸盐:硝酸银硝酸钠硝酸铜硝酸钾硝酸铵亚硝酸钠钾盐高锰酸钾锰酸钾氯酸钾有机化合物乙醇葡萄糖甲烷书写化学方程式:1.碳充分燃烧:2.碳不充分燃烧:3.一氧化碳燃烧:4.碳和二氧化碳反应:5.硫燃烧:6.红磷燃烧:7.氢气燃烧: 8.铁燃烧:9.镁燃烧: 10.铝燃烧:11.甲烷燃烧: 12.酒精燃烧:13.呼吸原理: 14.高锰酸钾制氧气:15.氯酸钾制氧气: 16.过氧化氢制氧气:17.水通电分解:18.氧化汞分解19.实验室制氢气的原理20.镁和硫酸反应:21.铁和硫酸反应22.铝和硫酸反应:23.镁和盐酸反应: 24.锌和盐酸反应25.铁和盐酸反应: 26.铝和盐酸反应:27.盐酸和氢氧化钠反应: 28.盐酸和氢氧化钙反应:29.硫酸和氢氧化钠反应:30.硫酸和氢氧化钙反应 30.盐酸或硫酸除铁锈的原理:31.实验室制CO2或CaCO3 作补钙药剂: 32.碳酸钠或盐酸酸反应:第二张33.治疗胃酸过多症的原理: 34.氯化钠与硝酸银反应产生白色沉淀:35.制取氢氧化钠的原理: 36.氢氧化钠与硫酸铜反应产生蓝色沉淀:37.制取水煤气的原理: 38.氢气还原氧化铜:39.碳还原氧化铜: 40.一氧化碳还原氧化铜:41.氢气还原氧化铁: 42.碳还原氧化铁:43.工业炼铁的原理: 44.铁置换硫酸铜中的铜:45.铜置换硝酸银中的银: 46.铝置换硫酸铜中的铜:47.生石灰制熟石灰: 48.碳酸不稳定:49.工业制生石灰的原理: 50.检验CO2或澄清石灰水变浑浊原理:51.烧碱变质的原理: 52.氢氧化钠与非金属氧化物(SO2、SO3)的反应:53.水与非金属氧化物(CO2、SO2)的反应附录:化学记忆 1.酸碱盐溶解性常见的酸多可溶,不溶暂且记硅酸。

示。
(1)试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
同主族内不同元素的E值变化的特点是____。
各
(2)同周期同,随原子序数增大,E值增大。
但个别元素的E值出现反常现象。
试预测下列关系中正确的是_______(填写编号,多选扣分)。
①E(砷)> E(硒);
②E(砷)<E(硒);
③E(溴)>E(硒);
④E(溴)<E(硒)
(3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:______<E<_______。
(4)10号元素E值较大的原因是_______________。
答案:(1)同主族的元素,随着原子序数的增大,E值变小;周期性
(2)①④(3)419<E<738
(4)10号是氖,该元素原子的最外层电子排布已达8电子稳定结构,不易失去电
)也是
键类型
一.电子跃迁
在通常情况下,原子核外电子的排布总是使整个原子处于能量(“最低”、“最高”)的状态,电子从能量较高的轨道跃迁到较低轨道时,将(“释放”、“吸收”)能量。
光是电子释放能量的重要形式之一。
我们日常生活中看到的、、、、等都与原子核外电子跃迁释放能量有关。
6.下列图象中所发生的现象与电子的跃迁无关的是
A B C D
1.焰色反应是物理变化还是化学变化,能否用电子跃迁的相关知识进行解释
1.物理变化;在通常情况下,原子核外电子的排布总是使整个原子处于能量最低的状态,电子从能量较高
的轨道跃迁到较低轨道时,将释放能量。
光是电子释放能量的重要形式之一。


1至36号元素名称,符号和核电荷数
1至36号元素名称,符号和核电荷数
1号:氢,H,核电荷数1;
2号:氦,He,核电荷数2;
3号:锂,Li,核电荷数3;
4号:铍,Be,核电荷数4;
5号:硼,B,核电荷数5;
6号:碳,C,核电荷数6;
7号:氮,N,核电荷数7;
8号:氧,O,核电荷数8;
9号:氟,F,核电荷数9;
10号:氖,Ne,核电荷数10;
11号:钠,Na,核电荷数11;
12号:镁,Mg,核电荷数12;
13号:铝,Al,核电荷数13;
14号:矽,Si,核电荷数14;
15号:磷,P,核电荷数15;
16号:硫,S,核电荷数16;
17号:氯,Cl,核电荷数17;
18号:氩,Ar,核电荷数18;
19号:钾,K,核电荷数19;
20号:钙,Ca,核电荷数20;
21号:钪,Sc,核电荷数21;
22号:钛,Ti,核电荷数22;
23号:钒,V,核电荷数23;
24号:铬,Cr,核电荷数24;
25号:锰,Mn,核电荷数25;
26号:铁,Fe,核电荷数26;
27号:钴,Co,核电荷数27;
28号:镍,Ni,核电荷数28;
29号:铜,Cu,核电荷数29;
30号:锌,Zn,核电荷数30;
31号:镓,Ga,核电荷数31;
32号:锗,Ge,核电荷数32;
33号:砷,As,核电荷数33;
34号:硒,Se,核电荷数34;
35号:溴,Br,核电荷数35;
36号:氪,Kr,核电荷数36。
核电荷数为47的元素名称?
银 Ag
116号元素的核电荷数为
核电荷数就是第几号元素
当研究人员用钙的同位素钙-48的离子轰击锔-248时,轰击的生成物中再次诞生了一个116号元素的原子。
该原子的核电荷数为116,中子数为176。
核电荷数从1~18的元素符号是什么?
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
某元素用符号36 P(在中间)其核电荷数是 15
磷-36 ?
磷的一种放射性同位素啊,β衰变,半衰期5.3秒。
第116号元素的核电荷数是多少
是116
对于元素的原子来说,原子序数=核电荷数=核外电子数=质子数关于1-20号元素名称及元素符号
亲爱李皮彭,坦荡养福来。
(氢氦锂铍硼,碳氮氧氟氖)
那美女桂林,牛肉要加钙。
(钠镁铝矽磷,硫氯氩钾钙)
这个是传说中的谐音法。
其实多读几遍,再弄清楚元素周期表行与列的关系就好了。
当年我学化学,慢慢也就背的了。
高考后也没再接触过化学,但是现在也
还记得的。
元素的核电荷数
当电子层数不变的情况下是这样的。
但当电子层数增加时,由于质子与电子间距离增加,其之间吸引力是会减弱的,而且这种因素对吸引力的影响比核电荷数的影响大。
所以应先考虑电子层数。
默写前20号元素名称及符号
在元素周期表中1~20号元素的名称依次是氢、氦、锂、铍、硼、碳、氮、氧、氟、氖、钠、镁、铝、矽、磷、硫、氯、氩、钾、钙,它们的元素符号依次是H、He、Li、Be、B、C、N、O、F、Ne、Na、Mg、Al、Si、P、S、Cl、Ar、K、Ca.
故答案是:H氢、He氦、Li锂、Be铍、B硼、C碳、N氮、O 氧、F氟、Ne氖、Na钠、Mg镁、Al铝、Si矽、P磷、S硫、Cl氯、Ar氩、K钾、Ca钙.
XY是元素周期表前20号元素,Y的核电荷数比X小4
Y最活泼的非金属元素是氟(F)原子序数是9 X是5号元素是硼(委实说这个不常考)2B+NaOH=2Na3BO3+H2。