默写铜元素名称、符号及序号
- 格式:docx
- 大小:10.77 KB
- 文档页数:1

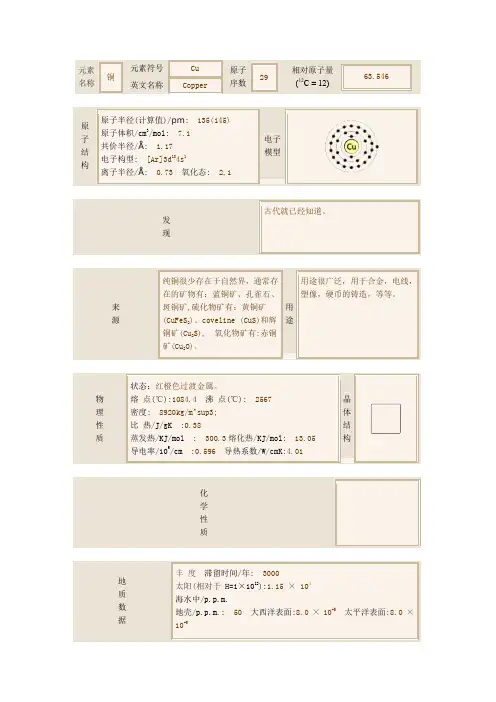
铜是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
铜合金机械性能优异,电阻率很低,其中最重要的数青铜和黄铜。
此外,铜也是耐用的金属,可以多次回收而无损其机械性能。
二价铜盐是最常见的铜化合物,常呈蓝色或绿色,是蓝铜矿和绿松石等矿物颜色的来源,历史上曾广泛用作颜料。
铜质建筑结构受腐蚀后会产生铜绿(碱式碳酸铜)。
装饰艺术主要使用金属铜和含铜的颜料。
铜是人类最早使用的金属之一。
早在史前时代,人们就开始采掘露天铜矿,并用获取的铜制造武器、式具和其他器皿,铜的使用对早期人类文明的进步影响深远。
铜是一种存在于地壳和海洋中的金属。
铜在地壳中的含量约为0.01%,在个别铜矿床中,铜的含量可以达到3%~5%。
自然界中的铜,多数以化合物即铜矿石存在。
铜的活动性较弱,铁单质与硫酸铜反应可以置换出铜单质。
铜单质不溶于非氧化性酸。
铜是与人类关系非常密切的有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,在中国有色金属材料的消费中仅次于铝。
铜是一种红色金属,同时也是一种绿色金属。
说它是绿色金属,主要是因为它熔点较低,容易再熔化、再冶炼,因而回收利用相当地便宜。
古代主要用于器皿、艺术品及武器铸造,比较有名的器皿及艺术品如司母戊鼎、四羊方尊。
电器和电子市场电器和电子市场约占总数的28%。
1997年,这两个市场成为铜消耗的第二大终端用户,拥有25%的市场份额。
在许多电器产品中,(例如:电线、母线、变压器绕组、重型马达、电话线和电话电缆)铜的使用寿命都相当地长,只有经过20到50年以后,里面的铜才可以进行回收利用。
其他含铜的电器和电子产品(比如:小型电器和消费电子产品)使用寿命则比较短,一般是5-10年。
商业性电子产品和大型电器产品通常要回收的,因为它们除含有铜以外,还有其他珍贵的金属。

初中化学元素默写资料元素氢(H):元素氢是化学元素中最简单的一种,原子数为1,原子序数为1,属于非金属元素。
氢气是一种无色、无味、无毒的气体,在自然界中以分子的形式存在。
氢气具有极强的可燃性,可以与氧气反应产生水,并释放大量的能量。
氢气也是一种重要的工业原料,在合成氨、石油加工、化学品制备等过程中广泛使用。
元素氧(O):元素氧是化学元素中最常见的一种,原子数为8,原子序数为16,属于非金属元素。
氧气是一种无色、无味、无毒的气体,在大气中占据约21%的体积比例。
氧气是人类呼吸和维持生命所必需的气体,也是许多燃烧反应和氧化反应的必需品。
此外,氧气还被广泛应用于氧焊、氧割等工业生产中。
元素碳(C):元素碳是化学元素中非常重要的一种,原子数为6,原子序数为12,属于非金属元素。
碳是生命的基础,所有有机物都是由碳元素组成的。
除了在生物体中存在,碳也广泛存在于地壳、化石燃料中。
在工业生产中,碳被用于制造钢铁、合成化学品以及生产人造纤维等。
元素氮(N):元素氮是化学元素中很重要的一种,原子数为7,原子序数为14,属于非金属元素。
氮气是一种无色、无味、非常稳定的气体,在大气中占据约78%的体积比例。
氮气主要被用于工业生产中的氮气干燥、氮气保护、氮气吹扫等过程。
元素铁(Fe):元素铁是化学元素中重要的一种,原子数为26,原子序数为56,属于过渡金属元素。
铁是地壳中含量最多的元素之一,也是人类使用最早的金属之一、铁能与氧反应形成氧化铁,常见的就是赤铁矿和磁铁矿。
铁被广泛应用于制造钢铁、铁器具等。
元素铜(Cu):元素铜是化学元素中一种重要的金属,原子数为29,原子序数为63,属于过渡金属元素。
铜具有良好的导电性和导热性,广泛应用于电子、电器、制铜合金等领域。
常用的铜合金有黄铜、青铜等。
元素氦(He):元素氦是化学元素中一种惰性气体,原子数为2,原子序数为2,属于稀有气体元素。
氦气是一种无色、无味、无毒的气体,具有很低的沸点和很低的密度。

金属铜化学式
金属铜化学式:Cu 。
铜是一种金属元素,也是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
铜合金机械性能优异,电阻率很低,其中最重要的数青铜和黄铜。
此外,铜也是耐用的金属,可以多次回收而无损其机械性能。
物理性质
纯铜是外观呈玫瑰红色、有光泽、有延展性、无气味的金属,表面氧化时呈紫红色,常温下为固体,其密度为8.89 g/cm³
(20 ℃),熔点为1083 ℃,具有优良的导电性、导热性、耐腐蚀性。
延展性好,可进行各种冷、热加工。
液态的铜密度为7.81 g/cm³(1200 ℃),并且液态铜能够吸收H₂、O₂、SO₂、CO ₂、CO等气体。
化学性质
铜在常温、干燥的空气中不发生变化,温度高于185 ℃时开始氧化,350 ℃以下生成红色的氧化亚铜,350-1500 ℃生成黑色氧化铜。
铜在潮湿的空气中会生成铜绿(CuCO₃·Cu(OH)₂)。
铜不与单独的盐酸、稀硫酸反应,能与硝酸、浓硫酸等氧化性的酸反应生成相应的铜盐和水。
铜红热状态与氨气反应生成氮化物。
在碳酸盐参与的条件下,铜能与氨水反应生成配盐。
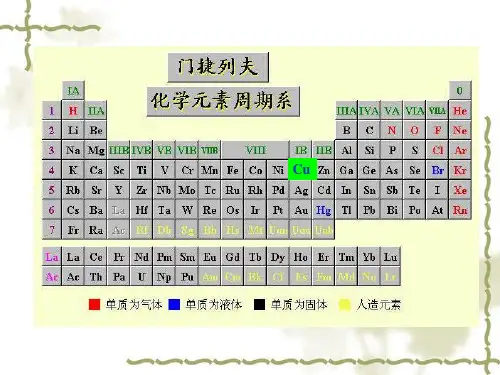

铜元素在元素周期表中的位置1、铜在周期表的位置:第四周期、第IB族。
2、铜是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高。
3、铜是一种存在于地壳和海洋中的金属。
铜在地壳中的含量约为0.01%,在个别铜矿床中,铜的含量可以达到3%~5%。
自然界中的铜,多数以化合物即铜矿石存在。
铜的活动性较弱,铁单质与硫酸铜反应可以置换出铜单质。
铜单质不溶于非氧化性酸。
铜是我们非常熟悉的元素,青铜器时代使用的各种农具、兵器、礼器都含有铜元素。
人们用铜和铜合金制造出了无数的文明载体,如司母戊鼎、四羊方尊等。
人类使用铜及其合金已有数千年历史,即使后来进入铁器时代,铜仍然是使用较为广泛的一种金属。
纯铜是一种柔软的金属,表面刚切开时为红橙色带金属光泽,延展性、导热、导电性能都很好。
因为铜的化学性质较稳定,不与非氧化性酸发生反应,所以非常容易回收再利用,也无损它的机械性能,因此垃圾分类千万别把它随便扔了,它属于废品回收站的主打回收产品,也被称为绿色金属(对环境没有害处的金属)。
在交通、化工、国防、建筑等领域,铜元素都是不可或缺的。
不过有一种溶液需要我们小心对待:将美丽迷人的蓝色硫酸铜溶液混合一定量石灰和水,就形成了天蓝色胶状悬浊液,它有一个好听的名字叫做“波尔多液”,是一种无机铜素杀菌剂,1882年由法国植物学教授米拉德在波尔多城发现。
他发现用这种溶液或者混合干粉喷洒过的葡萄树,不会发生霉叶病。
于是这一发现最终使波尔多地区成为了全世界有名的“葡萄园世界”,“波尔多液”也一炮走红。
但这种杀菌剂对人算不上友好,最初农场主们为了防止路人偷吃才洒上去的。
这种低毒性和广谱的抗菌性能,使其成为历史上应用最长的一种杀菌剂。
在科研舞台上,人们发现了铜在生物体中重要且性命攸关的功能,那就是铜能完成以下三种不同的化学过程:路易斯酸催化、单电子转移和双电子转移反应。

铜元素化学用语铜元素是一种常见的金属元素,在化学和工业领域中有着广泛的应用。
下面将详细介绍铜元素的化学用语。
一、铜元素的符号铜元素的化学符号是Cu。
这个符号来源于拉丁词“Cuprum”,这是铜的拉丁名。
在化学元素表中,铜位于周期表中的第四周期,属于过渡金属中的一种。
二、铜元素的原子结构铜原子具有29个核外电子,其原子结构中的电子排布遵循能量最低原理和泡利不相容原理。
电子排布式为1s2 2s2 2p6 3s2 3p6 3d10 4s1。
在这个电子排布式中,最后一个电子位于4s轨道上,这使得铜原子具有较高的化学活性。
三、铜的离子化学式铜元素可以形成多种离子,其中最常见的是+1和+2价离子。
铜离子的化学式分别是Cu+和Cu2+。
这些离子在化学反应中起着重要的作用,可以与其他元素形成化合物。
四、铜的化合物铜元素可以与多种元素形成化合物,其中一些常见的化合物包括:1.氧化铜(CuO):这是一种黑色固体,具有较高的化学稳定性。
氧化铜常用于制备铜盐和其他化合物。
2.硫酸铜(CuSO4):这是一种蓝色晶体,通常用于制备其他铜化合物、电镀和杀菌剂等。
3.氯化铜(CuCl2):这是一种绿色晶体,常用于制备其他铜化合物、电镀和颜料等。
4.氢氧化铜(Cu(OH)2):这是一种蓝色固体,具有较高的化学稳定性。
氢氧化铜常用于制备其他铜化合物和电镀等。
除了以上常见的化合物外,铜元素还可以与其他元素形成多种化合物,如碳酸铜、醋酸铜、草酸铜等。
这些化合物在化学研究和工业生产中都有广泛的应用。
五、铜的配位化学铜元素具有较高的配位能力,可以与多种配体形成配合物。
这些配合物在化学反应中起着重要的作用,可以用于制备新的化合物和材料。
常见的铜配合物包括:1.硫酸铜配合物:硫酸铜可以与多种配体形成配合物,如胺类、氨基酸类等。
这些配合物常用于制备新的材料和催化剂等。
2.氯化铜配合物:氯化铜可以与多种配体形成配合物,如胺类、酚类等。
这些配合物常用于制备新的药物和材料等。

一、引言化学是自然科学的一个重要分支,它研究物质的性质、结构、变化以及相关的能量变化。
在化学中,元素是构成物质的基本单位,它们由原子组成,具有特定的化学性质和物理性质。
本文将介绍化学周期表中1-36号元素的符号和名称,希望能够为读者深入了解化学元素提供帮助。
二、1-36号元素符号和名称1. 氢(Hydrogen,H)2. 氦(Helium,He)3. 锂(Lithium,Li)4. 铍(Beryllium,Be)5. 碳(Carbon,C)6. 氮(Nitrogen,N)7. 氧(Oxygen,O)8. 氟(Fluorine,F)9. 氖(Neon,Ne)10. 钠(Sodium,Na)11. 镁(Magnesium,Mg)12. 铝(Aluminium,Al)13. 硅(Silicon,Si)14. 磷(Phosphorus,P)15. 硫(Sulfur,S)16. 氯(Chlorine,Cl)17. 氩(Argon,Ar)18. 钾(Potassium,K)19. 钙(Calcium,Ca)20. 钪(Scandium,Sc)21. 钛(Titanium,Ti)22. 钒(Vanadium,V)23. 铬(Chromium,Cr)24. 锰(Manganese,Mn)25. 铁(Iron,Fe)26. 钴(Cobalt,Co)27. 镍(Nickel,Ni)28. 铜(Copper,Cu)29. 锌(Zinc,Zn)30. 镓(Gallium,Ga)31. 锗(Germanium,Ge)32. 砷(Arsenic,As)33. 硒(Selenium,Se)34. 溴(Bromine,Br)35. 氪(Krypton,Kr)36. 铷(Rubidium,Rb)三、结语本文介绍了化学周期表中1-36号元素的符号和名称,这些元素是构成物质的基本成分,对于我们了解物质的性质和变化具有重要意义。
希望通过本文的介绍,读者能够对这些化学元素有更深入的认识,进一步学习化学知识。

1-20 号元素名称及符号:氢H 氦He 锂Li 铍Be 硼 B 碳C 氮N 氧O 氟F 氖Ne钠Na 镁Mg 铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 钾K 钙Ca常用元素名称及符号:锰Mn 铁Fe 铜Cu 锌Zn 银Ag 钡Ba 金Au 汞Hg 铅Pb溴Br 碘I 钨W 铂Pt常见物质及化学式:氟气F2 氧气O2 氢气H2 氮气N2 氯气Cl2 溴Br2 碘I2 臭氧O 3氦气He 氖气Ne 氩气Ar 硅Si 磷P 硫S 碳C 钾K 钙Ca钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅Pb 铜Cu 汞Hg银Ag 铂Pt 金Au 锰Mn 钡Ba 钨W二氧化碳CO2 水H2O 一氧化碳CO 过氧化氢(双氧水)H2O2五氧化二磷P2O5 四氧化三铁Fe3O4 氧化铁Fe2O3 氧化亚铁FeO二氧化锰MnO2 二氧化硅SiO2 氧化铝Al2O3 氧化镁MgO 氧化铜CuO 氧化锌ZnO 氧化汞HgO 硫化氢H2S 氯化氢HCl 盐酸HCl硫酸H2SO4 硝酸HNO 3 碳酸H2CO3 磷酸H3PO4 氢氧化钠NaOH 氢氧化钙Ca(OH)2 氢氧化铜Cu(OH)2 氢氧化铁Fe(OH)3氢氧化铝Al(OH)3 氢氧化钾KOH 氯化钠NaCl 氯化镁MgCl 2氯化银AgCl 氯化钙CaCl2 氯化钾KCl 氯化钡BaCl2 氯化铁FeCl 3 氯化亚铁FeCl2 硫化锌ZnS 硫化亚铁FeS 硫酸钡BaSO 4 硝酸钾KNO 31硝酸银AgNO 3 硝酸钠NaNO 3 硝酸钡Ba(NO3)2 碳酸钠Na2CO3碳酸钙CaCO 3 碳酸钡BaCO 3 硫酸铵(NH4)2SO4 氯化铵NH4Cl 高锰酸钾KMnO 4 锰酸钾K2MnO 4 氯酸钾KClO3 甲烷CH4 乙炔C2H2酒精C2H5OH 葡萄糖C6H12O62。

铜元素的知识点总结
铜是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
铜合金机械性能优异,电阻率很低,其中最重要的数青铜和黄铜。
此外,铜也是耐用的金属,可以多次回收而无损其机械性能。
相对原
电
子
模
型
体则显绿色,是蓝铜矿和绿松石等矿物颜色的来源,历史上曾广泛用作颜料。
铜质建筑结构受腐蚀后会产生铜绿(碱式碳酸铜)。
装饰艺术主要使用金属铜和含铜的颜料。
铜是人类最早使用的金属之一。
早在史前时代,人们就开始采掘露天铜矿,并用获取的铜制造武器、工具和其他器皿,铜的使用对早期人类文明的进步影响深远。
铜是一种存在于地壳和海洋中的金属。
铜在地壳中的含量约为0.01%,在个别铜矿床中,铜的含量可以达到3%~5%。
自然界中的铜,多数以化合物即铜矿石存在。
铜的活动性较弱,铁单质与硫酸铜反应可以置换出铜单质。
铜单质不溶于非氧化性酸。

1-20号元素名称及符号1-20号元素名称及符号:氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、氖(Ne)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)、钾(K)、钙(Ca)。
常用元素名称及符号:锰(Mn)、铁(Fe)、铜(Cu)、锌(Zn)、银(Ag)、钡(Ba)、金(Au)、汞(Hg)、铅(Pb)、溴(Br)、碘(I)、钨(W)、铂(Pt)。
常见物质及化学式:氟气(F2)、氧气(O2)、氢气(H2)、氮气(N2)、氯气(Cl2)、溴(Br2)、碘(I2)、臭氧(O3)、氦气(He)、氖气(Ne)、氩气(Ar)、硅(Si)、磷(P)、硫(S)、碳(C)、钾(K)、钙(Ca)、钠(Na)、镁(Mg)、铝(Al)、锌(Zn)、铁(Fe)、锡(Sn)、铅(Pb)、铜(Cu)、汞(Hg)、银(Ag)、铂(Pt)、金(Au)、锰(Mn)、钨(W)。
二氧化碳(CO2)、水(H2O)、一氧化碳(CO)、过氧化氢(双氧水)(H2O2)、五氧化二磷(P2O5)、四氧化三铁(Fe3O4)、氧化铁(Fe2O3)、氧化亚铁(FeO)、二氧化锰(MnO2)、二氧化硅(SiO2)、氧化铝(Al2O3)、氧化镁(MgO)、氧化铜(CuO)、氧化锌(ZnO)、氧化汞(HgO)、硫化氢(H2S)、氯化氢(HCl)、盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、碳酸(H2CO3)、磷酸(H3PO4)、氢氧化钠(NaOH)、氢氧化钙(Ca(OH)2)、氢氧化铜(Cu(OH)2)、氢氧化铁(Fe(OH)3)、氢氧化铝(Al(OH)3)、氢氧化钾(KOH)、氯化钠(NaCl)、氯化镁(MgCl2)、氯化银(AgCl)、氯化钙(CaCl2)、氯化钾(KCl)、氯化钡(BaCl2)、氯化铁(FeCl3)、氯化亚铁(FeCl2)、硫化锌(ZnS)、硫化亚铁(FeS)、硫酸钡(BaSO4)、硝酸钾(KNO3)、硝酸银(AgNO3)、硝酸钠(NaNO3)、硝酸钡(Ba(NO3)2)、碳酸钠(Na2CO3)、碳酸钙(CaCO3)、碳酸钡(BaCO3)、硫酸铵((NH4)2SO4)、氯化铵(NH4Cl)、高锰酸钾(KMnO4)、锰酸钾(K2MnO4)、氯酸钾(KClO3)、甲烷(CH4)、乙炔(C2H2)、酒精(C2H5OH)、葡萄糖(C6H12O6)。
三个铜原子表示为:3Cu
由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字
2个铁原子:2Fe
铜(Cuprum)是一种金属元素,
自然铜
也是一种过渡元素,化学符号Cu,英文copper,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
铜合金机械性能优异,电阻率很低,其中最重要的数青铜和黄铜。
此外,铜也是耐用的金属,铜的活动性较弱,铁单质与硫酸铜反应可以置换出铜单质。
铜单质不溶于非氧化性酸。
例题
用化学符号表示:
分析:元素符号可以表示一种元素,还可以表示该元素的1个原子,有时还可以表示一种物质,例如金属元素的元素符号可以表示该金属元素组成的物质;
每个亚铁离子带2个单位正电荷;
冰是水的固体,每个水分子由2个氢原子和1个氧原子构成;
含氧质量分数最大的氧化物是过氧化氢,每个过氧化氢分子由2个氢原子和2个氧原子构成.
解答:解:3个铜原子可以表示为3Cu;亚铁离子可以表示为Fe2+;冰可以表示为H2O;含氧质量分数最大的氧化物是过氧化氢,可以表示为H2O2.
故填:3Cu;Fe2+;H2O;H2O2.。
铜的化学符号
铜是一种化学元素,它的化学符号是Cu(拉丁语Cuprum),它的原子序数是29,是一种过渡金属。
铜呈紫红色光泽的金属,密度8.92克/立方厘米。
熔点1083.4±0.2℃,沸点2567℃。
常见化合价+1和+2.电离能7.726电子伏特。
铜是人类发现最早的金属之一,也是最好的纯金属之一,稍硬、极坚韧、耐磨损。
还有很好的延展性。
导热和导电性能较好。
铜和它的一些合金有较好的耐腐蚀能力,在干燥的空气里很稳定。
铜是人类最早发现的古老金属之一,早在三千多年前人类就开始使用铜。
自然界中的铜分为自然铜、氧化铜矿和硫化铜矿。
自然铜及氧化铜的储量少,现在世界上80%以上的铜是从硫化铜矿精炼出来的,这种矿石含铜量极低,一般在2-3%左右。
铜的化学式铜是一种金属元素,其化学符号为Cu。
它的原子序数为29,它在元素周期表中的位置为第四周期第一族元素。
铜是一种有着良好导电性和导热性的金属,且具有良好的机械性能和耐腐蚀性能。
它在自然界中主要以硫化铜和氧化铜的形式存在。
铜也是一种重要的天然资源,被广泛应用于工业、建筑、电子、通讯、医学等领域。
铜的化学式为Cu,它是一个简单的单元素化合物,其分子式和化学式相同。
纯铜通常是一种红色金属,具有良好的导电性和导热性,因此它被广泛用于制造电线、输电线、电池等电子器件。
铜有多种化合物,包括氢氧化铜、硫酸铜、氯化铜、氧化铜等。
这些化合物在工业生产、科学研究、药物制造等领域都有着广泛的应用。
氢氧化铜的化学式为Cu(OH)2,它是由铜离子和氢氧根离子结合而成的。
氢氧化铜是一种弱碱性物质,可以用于中和酸性废水,净化水源。
在某些条件下,氢氧化铜会分解产生氧气和水。
硫酸铜的化学式为CuSO4,它是由铜离子和硫酸根离子结合而成的。
硫酸铜是一种重要的化学试剂,广泛用于冶金、电镀、制药等领域。
在医学中,硫酸铜可以用于治疗疟疾和真菌感染等疾病。
氯化铜的化学式为CuCl2,它是由铜离子和氯离子结合而成的。
氯化铜是一种重要的催化剂,在有机合成、生物化学、材料科学等领域有着广泛应用。
氧化铜的化学式为CuO,它是铜与氧反应产生的化合物。
氧化铜是一种黑色晶体,可以通过高温还原反应得到制备纯铜。
氧化铜也可以作为催化剂、电极材料、陶瓷材料等用途。
总的来说,铜是一种重要的金属元素,具有良好的物理化学性质和广泛的应用领域。
它的化学式为Cu,是一种简单的单元素化合物。
氢氧化铜、硫酸铜、氯化铜、氧化铜等铜化合物在生产和应用中发挥了重要作用。