实验室试剂配制记录模版
- 格式:pdf
- 大小:74.51 KB
- 文档页数:4

第1篇实验名称:溶液配制实验日期:2023年X月X日实验地点:化学实验室一、实验目的1. 掌握溶液配制的基本原理和方法。
2. 学会使用托盘天平、量筒、滴定管等仪器进行溶液配制。
3. 了解溶液浓度的计算和应用。
二、实验原理溶液配制是将溶质溶解于溶剂中,形成一定浓度的溶液。
溶液的浓度是指单位体积溶液中所含溶质的量。
本实验以配制一定浓度的盐酸溶液为例,介绍溶液配制的原理和方法。
三、实验仪器与试剂1. 仪器:托盘天平、量筒、滴定管、烧杯、玻璃棒、洗瓶、滤纸等。
2. 试剂:盐酸(分析纯)、蒸馏水、标准溶液(如0.1mol/L NaOH溶液)。
四、实验步骤1. 计算所需盐酸的物质的量:根据实验要求,计算所需盐酸的物质的量,即n (HCl)=C×V,其中C为溶液浓度,V为溶液体积。
2. 称量盐酸:使用托盘天平准确称量所需盐酸的质量,注意称量过程中避免污染。
3. 溶解盐酸:将称量好的盐酸加入烧杯中,加入少量蒸馏水,用玻璃棒搅拌至完全溶解。
4. 定容:将溶解后的盐酸转移至量筒中,加入蒸馏水至刻度线,用滴定管调整液面,使液面与刻度线相切。
5. 混匀:将量筒中的溶液摇匀,确保溶液浓度均匀。
6. 标准溶液的配制:按照相同的方法配制标准溶液,用于滴定实验。
五、实验数据记录1. 称量盐酸的质量:m(HCl)=X g2. 溶液体积:V(溶液)=Y mL3. 溶液浓度:C(溶液)=Z mol/L六、实验结果分析1. 计算溶液浓度:C(溶液)=m(HCl)/M(HCl)×1000/V(溶液),其中M (HCl)为盐酸的摩尔质量。
2. 比较实验结果与理论值:将实验测得的溶液浓度与理论值进行比较,分析误差产生的原因。
七、实验总结1. 本实验通过溶液配制,掌握了溶液配制的基本原理和方法。
2. 实验过程中,应注意称量准确、溶解充分、定容精确,以确保实验结果的准确性。
3. 实验结果与理论值存在一定误差,可能是由于实验操作不规范、仪器精度等因素造成的。

标准溶液配制记录一、前言。
标准溶液是化学分析中常用的一种溶液,它的浓度和成分都是经过严格计算和实验确定的。
正确、精确地配制标准溶液对化学分析结果的准确性和可靠性至关重要。
本文档旨在记录标准溶液的配制过程,以供参考和借鉴。
二、配制目的。
本次配制的标准溶液是XXX试剂,其主要用途是作为XXX分析的定量标准品。
通过配制标准溶液,可以确保在化学分析中得到准确的定量结果。
三、实验步骤。
1. 确定溶液浓度。
首先,根据实验需要和已知的化学反应式,计算出所需的标准溶液的浓度。
在确定浓度的过程中,需要考虑到实验的精确度和所需的最终结果。
2. 准备试剂和仪器。
在配制标准溶液之前,需要准备好所需的试剂和仪器。
试剂的纯度和仪器的准确度对标准溶液的配制至关重要。
3. 溶解试剂。
按照计算得出的配方,将所需的试剂溶解在适量的溶剂中。
在溶解过程中,需要充分搅拌并保持恒温,以确保试剂充分溶解。
4. 调整溶液体积。
根据需要,将溶解好的试剂溶液调整至所需的体积。
在调整体积时,需要使用准确的容量瓶或移液器,并注意避免气泡的产生。
5. 校正浓度。
配制好标准溶液后,需要进行浓度的校正。
校正的方法可以是比色法、滴定法或仪器分析法,根据实际情况选择合适的方法进行校正。
6. 记录实验数据。
在配制标准溶液的整个过程中,需要准确记录每一步的操作和实验数据。
这些数据将作为实验结果的依据,并在实验后的数据分析中起到重要的作用。
四、实验结果。
经过以上步骤,我们成功配制出了XXX浓度为XXX的标准溶液。
经过校正后,其浓度符合实验要求,可以用于后续的化学分析实验。
五、结论。
本次标准溶液配制实验成功完成,得到了符合要求的标准溶液。
在实验过程中,我们严格按照操作规程进行操作,严格控制试剂的纯度和仪器的准确度,最终取得了满意的实验结果。
六、致谢。
在实验过程中,得到了实验室老师和同事们的帮助和支持,在此表示衷心的感谢。
七、参考文献。
[1] XXX. 化学分析实验指导. 化学出版社, 20XX.[2] XXX. 分析化学. 化学工业出版社, 20XX.以上就是本次标准溶液配制的记录,希望对您有所帮助。

实验常用试剂、缓冲液的配制方法1、1M Tris-HCl□组份浓度1 M Tris-HCl(pH7.4,7.6,8.0)□配制量1L□配置方法1. 称量121.1gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3.按下表量加入浓盐酸调节所需要的pH值。
pH值浓HCl7.4 约70mL7.6 约60mL8.0 约42mL4. 将溶解定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2、1.5 M Tris-HCl □组份浓度1.5 M Tris-HCl(pH8.8)□配制量1L□配置方法1.称取181.7gTris置于1L烧杯中。
2. 加入约800mL的去离子水,充分搅拌溶解。
3. 用浓盐酸调pH值至8.8。
4. 将溶液定容至1L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
3、10×TE Buffer □组份浓度100 mM Tris-HCl,10 mM EDTA(pH 7.4,7.6,8.0)□配制量1L□配置方法1. 量取下列溶液,置于1L烧杯中。
1 M Tris-HCl Buffer(pH7.4,7.6,8.0)100mL500 mM EDTA(pH8.0)20mL2. 向烧杯中加入约800mL的去离子水,均匀混合。
3. 将溶液定至1L后,高温高压灭菌。
4. 室温保存。
4、3 M醋酸钠□组份浓度3 M 醋酸钠(pH5.2)□配制量100mL□配置方法1. 称取40.8gNaOAc•3H2O置于100~200mL烧杯中,加入约40mL的去离子水搅拌溶解。
2. 加入冰乙酸调节pH值至5.2。
3. 加入去离子水将溶液定容至100mL。

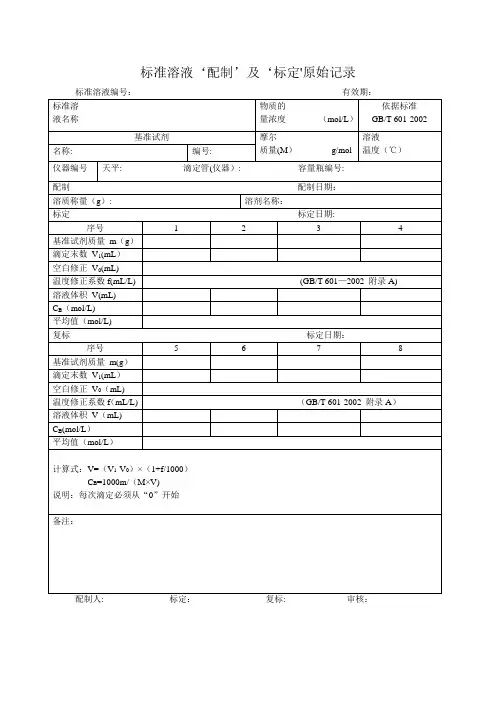
标准溶液‘配制’及‘标定'原始记录配制人: 标定:复标: 审核:标准物质配制(标定)记录编号: CHEC/QBG-075名称:、配制方法:使用天平型号编号室温℃、湿度%RH 配制:取定溶mL 标定:取份:⑴⑵⑶⑷用溶液滴定,滴定消耗量(mL) V1= 、V2= 、V3= 、V4= 、V0= 。
标准溶液浓度计算公式:C=计算结果():C1= C2= C3= C4= C =相对偏差(%):S1= S2= S3= S4=备注:.配制人:复核人:配制日期:年月日有效期年月日标准溶液配制记录编号: CHEC/QBG—147标准溶液名称:规格:配制方法:仪器名称:溯源标准:温度: ℃、湿度:%RH标准溶液拟配浓度:配制或稀释过程:配制日期:年月日有效期:年月日配制人:复核人:0。
1mol/L盐酸标准滴定溶液的标定编号:JL/LJ-001-01一、标定方法:GB/T5009。
1-2003二、使用仪器:AEL—200电子天平(仪器编号:JYB001)马弗炉(仪器编号:JYC009)三、操作1、量取9ml盐酸,加适量水并稀释至1000ml。
混匀,待标定.2、标定:精密称取约0.15g在270~300℃干燥至恒量的基准无水碳酸钠,加50ml水使之溶解,加10滴溴甲酚绿-甲基红混合指示液,用本溶液滴定至溶液由绿色转变为紫红色,煮沸2min,冷却至室温,继续滴定至溶液由绿色变为暗紫色.四、记录和结果1、计算公式:c(HCl)=m/[(V1-V2)×0。
0530]0。
0530……与1.00ml盐酸标准滴定溶液[c(HCl)=1mol/L]相当的基准无水碳酸钠的质量,g配制人: 复核人:配制日期:复核日期:标准溶液(滴定液)管理工作的基本要求关键词(必填项目):标准溶液、滴定液目的(必填项目):对标准溶液的使用等制定统一的要求,便于统一的管理.背景知识(选填项目):无。
原理(选填项目):无主体内容(操作步骤,必填项目):1 内容1.1 标准溶液的配制1.1。

实验室试剂配制记录模版实验室名称:[填写实验室名称]
试剂名称:[填写试剂名称]
试剂编号:[填写试剂编号]
试剂批号:[填写试剂批号]
浓度/纯度:[填写试剂浓度或纯度]
试剂配制过程:
1.准备容器:
1.1容器名称:[填写容器名称]
1.2容器编号:[填写容器编号]
1.3容器洗涤:[填写洗涤方法]
1.4容器去离子水漂洗:[填写去离子水漂洗次数]
2.称量试剂:
2.1称量天平:[填写天平型号]
2.2称量方法:[填写称量方法]
2.3称取试剂A:[填写试剂A的重量]
2.4称取试剂B:[填写试剂B的重量]
3.试剂溶解:
3.1加入溶剂:[填写溶剂名称和添加量]
3.2摇匀溶解:[填写摇匀的时间和速度]
3.3溶液浓度测定:[填写浓度测定的方法和结果]
3.4试剂溶液过滤:[填写过滤的方式和滤器型号]
4.试剂保存:
4.1保存温度:[填写保存温度]
4.2保存条件:[填写保存条件]
4.3保存容器:[填写保存容器]
试剂配制记录:
试剂名称,试剂编号,试剂批号,浓度/纯度,配制日期,配制人员-------------------------------
试剂A,,,,
-------------------------------
试剂B,,,,
-------------------------------
备注:[填写其他重要信息,如实验过程中的异常情况、其他实验室特殊要求等]。

实验室常用试剂、缓冲液的配制方法蛋白质电泳相关试剂、缓冲液的配制方法核酸电泳相关试剂、缓冲液的配制方法核酸、蛋白质杂交用相关试剂、缓冲液的配制方法SDS-PAGE分离胶配方表PAGE凝胶配方表(核酸电泳用)各种缓冲液的性质对照表离心机转子的转速与相对离心力RCF(g)间的换算关系相对离心力RCF值(g值)取决于转子的转速(rpm)和旋转半径(r,以mm计算),可用如下公式表示:此外,根据RCF值(g值)、rpm值、r值之间的关系,可从图A、图B中大致读出各种数值。
图A高速转子的相对离心力列线图要确定某一列上的未知值时,用尺子排列其他两列的已知值,所需值落在尺子与第三列的交切处.如:转子速度为80,000 rpm,旋转半径为20 mm时,相对离心力RCF值约为150,000 g。
图B低速转子的相对离心力列线图要确定某一列上的未知值时,用尺子排列其他两列的已知值,所需值落在尺子与第三列的交切处。
如:转子速度为5,000 rpm,旋转半径为40 mm时,相对离心力RCF值约为1,100 g。
密码子表色素在聚丙烯酰胺凝胶中的移动速度*大肠杆菌的基因型野生的大肠杆菌(E.coli)的基因组DNA中有470万个碱基对(bp),内含4288个基因。
E。
coli基因组中还包含有许多插入序列,如λ-噬菌体片段和一些其他特殊组份的片段,这些插入的片段都是由基因的水平转移和基因重组而形成的,由此表明了基因组具有它的可塑造性。
利用大肠杆菌基因组的这种特性对其进行改造,使其中的某些基因发生突变或缺失,从而给大肠杆菌带来可以观察到的变化,这种能观察到的特征叫做大肠杆菌的表现型(Phenotype),把引起这种变化的基因构成叫做大肠杆菌的基因型(Genotype).具有不同基因型的菌株表现出不同的特性。
这些不同基因型特性的菌株在基因工程的研究和生产中具有广泛的应用价值。
大肠杆菌基因型的表示方法有如下几种:1.根据基因产物或其作用产物的英文名称的第一个字母缩写成三个斜体字母来表示。

以下是一个可能的实验室试剂配制记录模板,供参考使用:
实验室试剂配制记录
1. 试剂信息
-试剂名称:
-质量/浓度:
-制备日期:
-制备人员:
2. 原料信息
-原料名称:
-原料质量/浓度:
-原料厂家:
-库存数量:
3. 配制过程
-步骤一:(详细描述配制过程中的每一个步骤,包括原料称量、溶解、稀释等操作)
-步骤二:(继续描述每个步骤直至配制完成)
4. 检验与调整
-检验项目及方法:
-检验结果:
-需要调整的情况及处理方法:
5. 最终产品
-最终产物质量/浓度:
-产物外观:
-存储条件:
-备注:
6. 复核与批准
-复核人:
-复核日期:
-批准人:
-批准日期:
7. 使用记录
-使用日期:
-使用实验室/项目:
-使用人员:
-使用目的:
8. 废弃处理
-废弃日期:
-废弃原因:
-处理方式:
9. 附注
-其他需要说明的事项或特殊情况。
在实际使用时,可以根据实验室的具体要求和管理体系进行相应的调整和补充。
此模板旨在记录试剂的配制过程和相关信息,以确保试剂配制的质量、安全和追溯性,并且有助于实验室管理和质量控制。
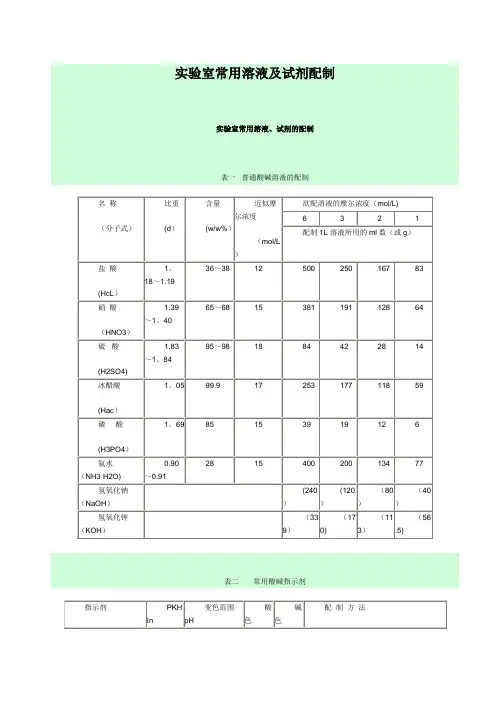
实验室常用溶液及试剂配制实验室常用溶液、试剂的配制表一普通酸碱溶液的配制表二常用酸碱指示剂表三混合酸碱指示剂表四容量分析基准物质的干燥表五缓冲溶液的配制1、氯化钾—盐酸缓冲溶液2、邻苯二甲酸氢钾—氢氧化钾缓冲溶液3、邻苯二甲酸氢钾-氢氧化钾缓冲溶液4、乙酸—乙酸钠缓冲溶液5、磷酸二氢钾-氢氧化钠缓冲溶液6、硼砂—氢氧化钠缓冲溶液7、氨水—氯化铵缓冲溶液8、常用缓冲溶液的配制实验室常用试验方法2九、柠檬酸(C6H8O7·H2O)称取试样1.5g(精确到0.0002g)于三角瓶内,加入水50ml溶解,加酚酞指示剂3滴,用1mol/L氢氧化钠标准溶液滴定至粉红色为终点,同时做空白试验。
计算:X%(一水)= (V1-V0)×C×0.06404 m×(1—0。
08566)×100X%(无水)= (V1—V0)×C×0.06404 m×100V1--——-消耗氢氧化钠标准溶液的体积,ml;V0—---—空白所消耗氢氧化钠标准溶液的体积,ml;C—----—氢氧化钠标准溶液浓度,mol/L;m———样品质量。
十、钙含量测定(磷酸氢钙CaHPO4、磷酸二氢钙Ca(H2PO4)2·H2O、钙粉等)称取2g(精确到0。
0002g)样品,用10ml盐酸(1+1)溶解,转移至100ml容量瓶中定溶,用移液管吸取10ml于250ml 锥形瓶中,加50ml水,5ml蔗糖溶液(25g/L),2ml三乙酸胺(1+1),1ml乙二胺(1+1),1滴孔雀绿指示液(1g/L),滴加氢氧化钾溶液(200g/L)至无色,再过量10ml,加0.1g盐酸羟胺(每加一种试剂都要摇匀),加钙黄绿素少许,在黑色背景下用0。
05mol/L的EDTA标准溶液滴定至绿色荧光消失呈现紫红色为滴定终点。
Ca%= C×V×0.4008 m ×100C—-——-—EDTA标准溶液的浓度,mol/L;V-—-—-消耗EDTA标准溶液的体积,ml;m—---样品质量.(二)氟(Fˉ)含量的测定:1、标准曲线的绘制;2、试样含量的测定:称取0.5g(精确到0.0002g)置于50ml纳氏比色管中,加1mol/L盐酸10ml,密闭提取1h(不时摇动),避免粘于管壁,提取后加总离子强度缓冲液25ml,加水至刻度,以滤纸过滤。
编码:R-PK031B/0配制试剂名称缓冲液配制总量500ml配制日期
有效期15天配制人复核人
配制方法:将缓冲液试剂袋中的试剂倒出,溶于500mL蒸馏水中,溶解、混匀即可。
于常温保存。
试剂使用记录
使用时间使用量使用人
编码:R-PK031B/0配制试剂名称底物配制总量13ml配制日期有效期20天配制人复核人
配制方法:往标注为底物的瓶中加入13mL蒸馏水,溶解、混匀即可。
于2-4℃保存。
试剂使用记录
使用时间使用量使用人
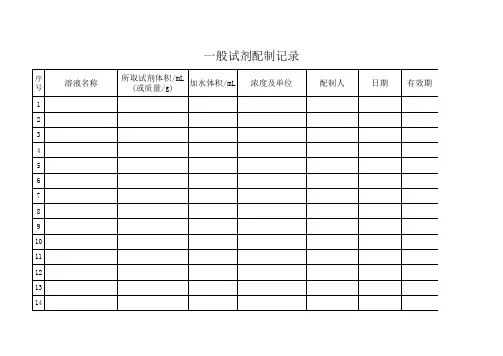
滴定液配制记录
配制试剂名称配制总量配制日期
有效期配制人复核人
配制方法:
标定过程:
试剂使用记录
使用时间使用量使用人使用时间使用量使用人
编码:R-PK032B/0。