氨基酸分类及等电点的计算方法
- 格式:pdf
- 大小:122.89 KB
- 文档页数:2

多肽等电点与疏水性一、氨基酸的等电点,该如何进行计算?1、氨基酸是两性电解质,在碱性溶液中表现出带负电荷,在酸性溶液中表现出带正电荷,在某一定pH 溶液中,氨基酸所带的正电荷和负电荷相等时的pH,称为该氨基酸的等电点。
2、氨基酸等电点的计算公式:pH=(pKn+pKn+1)/2n:氨基酸(或多肽)完全质子化时带正电荷基团数pK:解离基团的解离常数等电点的计算步骤先将氨基酸/多肽可解离基团的pK值自小到大按顺序排列判断n值判断氨基酸的分类酸性氨基酸和中性氨基酸的完全质子化数n=1碱性氨基酸的完全质子化数n=23、氨基酸等电点表甘氨酸5.97丙氨酸6.00缬氨酸5.96亮氨酸5.98异亮氨酸6.02苯丙氨酸5.48丝氨酸5.68苏氨酸6.16酪氨酸5.68半胱氨酸5.05蛋氨酸5.74脯氨酸6.30色氨酸5.89赖氨酸9.74精氨酸10.76组氨酸7.59门冬氨酸2.77谷氨酸3.22门冬酰胺5.41谷氨酰胺5.65二、20种氨基酸的疏水参数见下表(高正值的氨基酸具有更大的疏水性,而低负值的氨基酸则更加亲水):Arg(R)-4.5Lys(K)-3.9Asn(N)-3.5Asp(D)-3.5Gln(Q)-3.5Glu(E)-3.5His(H)-3.2Pro(P)-1.6Tyr(Y)-1.3Trp(W)-0.9Ser(S)-0.8Thr(T)-0.7Gly(G)-0.4Ala(A)1.8Met(M)1.9Cys(C)2.5Phe(F)2.8Leu(L)3.8Val(V)4.2Ile(I)4.5多肽保存多肽一般长期保存需要避光保存,并应保存在-20度以下,短期可以保存在4℃。
可以短时间以室温运输。
多肽在-20℃很稳定,特别是冷冻干燥并保存在干燥器中时,在将它们暴露于空气之前,冷冻干燥多肽可以放于室温自然升温,这将使湿度影响减少,当无法冷冻干燥时,最好的方法是以小的工作样量存放。
对于含Cys, Met or Trp的多肽,脱氧缓冲剂对其溶解必不可少,因为这种多肽容易空气氧化,在封瓶前,氮气或氩气保护会降低氧化作用。

氨基酸的解离和等电点_陈建华建华作为蛋质白华本构件的基酸氨进行酸解性离h3·,除有具基外还佼有基氨例如甘氨酸,,所以是种一性两解质电:,既能,又能进行碱性解一离。
未解离前是以两性离子式n形chc00z存在,在不的同+ph值环下境hz,进如行下两种不同解的离工13`nchzhcooh井hh一3`nch,ooczz孚h一nchco、o圣i,即在氢离子浓度较低的碱环性境下言丛本`上是放质子出呈正子离状态,,呈负子离状态”“,在离氢子度浓较,高的性环酸境下:,它本从上收质吸子,有只氢离子在浓适度中时“才它要主。
以两离性子(中性分戈子)态状存在。
面上所之以加上基上本基本”,要主,”是为因不管。
在哪种环境下3十z,除了基本解离过程以外,都还有少量与“”过程相反的解离过程c一ooh上怎于,钧{j氢离子浓度才算适呢中?这与氨基酸的两个解离基团解的离数常有关果我们把如hnch于,co看成是一个元弱二具酸有二个可解离的hl于o k:,即h和的’一nh3+上h的那么:}3工`nc江icoho孚h 3:十z到cijcoo一+h+十(1)(2)zk2h3十chznoco一:、ziicoo一卜hhnc-续把以上两方程中式的正离负和子两性离子,卜分别用ha_’,a一,i七、代替,则电离平衡ij有:十10 / 116__来源网络整理,仅作为学习参k,=〔ha〕〔11〕:h〔a〕卜(3),kz〔a〕〔h〕h〔a〕(4)两相式得:乘k,k,一华子六气二〔以nlzaa〔一二八`j(5),甘氨若酸主要以两离性子状存态在所程只由有少欣存在i等电胃点(5),,则方程式(’一1)左向的程过和住方(式。
2)i句的右过。
而产且生的haa和不能有哪一方占优势于是有等了电点的概念!川两性解电质(氨基酸)其在正离子度和负离浓子浓度等相时的ph这z样有:〔h〕一创卜瓦灭万,6(,,`p一,合`kp`卜pk 一z,7,`氨。
丛的等电酸点与氨胶本墓身浓的无度关·只两与个基的团离常解数或p(k值)有关.如甘氨酸的pk一2;.43,pk一9z06,,.故pl一579。


三个pk等电点的计算方法
等电点(pI)是指分子或表面不带电荷时的pH值,是针对带电荷的物质而言,不只限于两性电解质如氨基酸和蛋白质。
对于具有三个pk等电点的物质,可以使用以下方法计算:方法一:PI=(PKa+PKb)/2。
方法二:先写出物质电性由最正到最负的过程,然后计算等电点。
例如,对于谷氨酸,其过程为NH3+(aCOOH,R-COOH)到NH3+(aCOO-,R-COOH)到NH3+(aCOO-,R-COO-)最后到NH3 (aCOO-,R-C。
方法三:若三个PK值中有两个是碱性,一个是酸性,则等电点是两个碱性值的平均数,即PI=(PK1+PK2)/2。
需要注意的是,等电点的计算可能会因物质的性质和环境条件而有所不同,在实际应用中,需要根据具体情况选择合适的计算方法。

氨基酸等电点的计算氨基酸等电点,听起来像是某个高大上的化学术语,其实也没那么复杂,稍微捋一捋就能搞懂。
要是你有点生物学或者化学基础,可能会觉得这个东西有点像“化学版的生日派对”,你听我这么一说,可能一下就有画面了!等电点嘛,说白了就是氨基酸在某种特定的酸碱环境下,它的电荷“平衡点”。
别看它说的像是个“高冷”的东西,背后其实藏着的只是氨基酸的一种特殊行为——它会根据周围的酸碱环境,自己调节“心态”,不多也不少,正负电荷刚好一对一,平衡得恰到好处。
咋样,是不是听起来有点意思?到底氨基酸是怎么调皮捣蛋地找到这个平衡点的呢?其实挺简单的,氨基酸的“个性”也不复杂。
每个氨基酸分子都像是个“多面手”,它既有能接受氢离子的氨基(NH₂),又有能释放氢离子的羧基(COOH)。
你看,它这个“多面手”的角色可不是白当的,正是这两个活跃的部分决定了它的电荷状态。
当周围的环境比较酸性时,氨基酸的羧基(COOH)就会被“唤醒”去释放氢离子,变成负电荷(COO⁻)。
而当环境比较碱性时,氨基(NH₂)就会努力去吸引氢离子,变成正电荷(NH₃⁺)。
一来一往,氨基酸就变成了“正负电荷”的双面间谍。
这时候问题来了,氨基酸在“酸碱的漩涡”中拼命调节,终于找到了一个“心平气和”的点,那就是它的等电点。
没错,就是那一刻,氨基酸既没有多余的正电荷,也没有多余的负电荷,左右开弓的状态结束了,终于成了一个“平和”的中性物质。
它好像是彻底放下了刀枪,穿上了和平的白袍,和周围环境达成了某种微妙的共识。
说白了,等电点就是氨基酸的“情绪低谷”,它在这个点上既不偏向酸性,也不偏向碱性,所有的“脾气”都平息了。
等电点是个挺有趣的东西,因为每种氨基酸都有自己独特的等电点。
就像每个人都有自己的“心境”,它们也有自己“内心的平衡点”。
有的氨基酸的等电点低一点,有的则高一点,这主要是看它们的氨基和羧基的“性格”如何。
有的氨基酸可能更加“友好”一点,容易接受氢离子,所以下一个等电点会低一点;有的则相对固执,喜欢保留自己的电荷,等电点自然会高一些。

氨基酸的两性解离与等电点
主讲教师:彭浩
兼性离子
•是指在同一分子上带有能释放质子的正离子基团和能接受质子的负离子基团。
•依照酸碱质子理论,兼性离子既起酸,即质子供体的作用,又起碱即质子接纳体的作用。
氨基酸——两性电解质
非分子形式兼性离子形式
氨基酸完全质子化时,可以看作多元酸;侧链不解离的中性氨基酸可看作二元酸;酸性氨基酸和碱性氨基酸可视为三元酸。
以甘氨酸为例
K1和K2分别代表α-碳上的羧基和氨基正离子的解离常数,氨基酸侧链R基的解离常数标为K R
多元酸的解离常数
•按其酸性递降顺序编号为K1、K2、K3等氨基酸的解离常数
•可用测定滴定曲线的实验方法求得
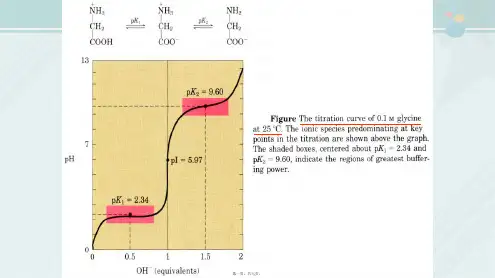
甘氨酸滴定曲线
甘氨酸的两个可解离基团,羧基和氨基,
均用0.1mol/L氢氧化钠
强碱溶液进行滴定。
甘氨酸滴定曲线
甘氨酸滴定曲线
滴定曲线上的这一拐点标为pI,称为等电点
甘氨酸滴定曲线
R基不含可解离基团的中性氨基酸都具有类似甘氨酸的滴定曲线。
R基含有可解离基团的氨基酸,相当于三元酸,有3个pKa。
谷氨酸(A)和赖氨酸(B)的滴定曲线
氨基酸的带电荷状况与其溶液的pH有关,改变pH可以使氨基酸带净正电荷或带净负电荷,也可以使它处于带正、负电荷数目相等,即
净电荷为零的兼性离子状态。
甘氨酸滴定曲线
滴定曲线上的这一拐点标为pI,称为等电点一氨基一羧基AA的
等电点计算:
pK´1+pK´2
pI= 2。

氨基酸等电点一、引言在生物化学中,氨基酸等电点(isoelectric point,简称pI)是指氨基酸溶液中带净电荷的氨基酸分子所带电荷总和为零的 pH 值。
在达到pI时,氨基酸尤其是蛋白质在溶液中几乎呈电中性。
二、氨基酸及其离子形态氨基酸的化学结构中含有一个氨基(NH2)和一个羧基(COOH)。
这两个官能团都可以解离,使氨基酸具有酸性和碱性。
当氨基酸中的氨基解离时,它会失去一个质子(H+),产生氨基负离子(NH2-)。
而当羧基解离时,它会释放出一个质子,产生羧基负离子(COO-)。
在溶液中,氨基酸可以同时存在不同形式的离子:阳离子形式、中性形式和阴离子形式。
当氨基酸溶液的pH值小于pKa时,氨基酸中的胺基以NH3+形式存在;当pH 值大于pKa时,胺基以NH2形式存在;当pH等于pKa值时,两种形式的平衡存在,并会生成等电点。
三、等电点的定义等电点是指氨基酸带净电荷的总和为零的pH值。
当氨基酸溶液的pH等于其等电点时,溶液中带正电荷的离子数量等于带负电荷的离子数量。
也就是说,当pH等于氨基酸的等电点时,氨基酸具有最低的净电荷。
四、计算等电点的方法为了计算氨基酸的等电点,可以利用氨基酸的酸性和碱性性质。
氨基酸的等电点可以通过以下两个过程计算:4.1 离子电荷平衡法离子电荷平衡法是一种通过计算带正电荷的离子数目和带负电荷的离子数目来确定等电点的方法。
1.计算氨基酸溶液中胺基的电荷数目;2.计算氨基酸溶液中羧基的电荷数目;3.将胺基和羧基的电荷数目相加,并将结果除以2,得到等电点的近似值。
4.2 Henderson-Hasselbalch方程Henderson-Hasselbalch方程是计算任意酸碱缓冲溶液的pH值的公式。
对于氨基酸而言,可以利用Henderson-Hasselbalch方程来计算等电点。
Henderson-Hasselbalch方程的公式为:pH = pKa + log([A-]/[HA]),其中pKa 代表氨基酸的酸解离常数,[A-]代表氨基酸带负电荷离子的浓度,[HA]代表氨基酸带正电荷离子的浓度。

等电点:某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0,等电点一般在5~6.3之间;酸性氨基酸的羧基解离程度更大,pI明显小于7.0,等电点一般在2.8~3.2之间。
;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0,等电点一般在7.6~10.8之间;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH 即为其等电点。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
氨基酸形成内盐:氨基酸的晶体是以偶极离子的形式存在。
这种偶极离子是分子内的氨基与羧基成盐的结果,故又叫内盐。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
蛋白氨酸、缬氨酸、异亮氨酸、赖氨酸、苏氨酸、色氨酸、苯丙氨酸,丙氨酸、谷氨酸、天门冬氨酸、甘氨酸、胱氨酸、脯氨酸、酷氨酸、丝氨酸、脯氨酸20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类根据侧链基团的极性1、非极性氨基酸(疏水氨基酸):8种丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe)色氨酸(Trp)蛋氨酸(Met)2、极性氨基酸(亲水氨基酸):1)极性不带电荷:7种甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)2)极性带正电荷的氨基酸(碱性氨基酸): 3种赖氨酸(Lys)精氨酸(Arg)组氨酸(His)3)极性带负电荷的氨基酸(酸性氨基酸): 2种天冬氨酸(Asp)谷氨酸(Glu)根据氨基酸分子的化学结构1、脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺2、芳香族氨基酸:苯丙氨酸、酪氨酸3、杂环族氨基酸:组氨酸、色氨酸4、杂环亚氨基酸:脯氨酸等电点的计算1)侧链不含离解基团的中性氨基酸,其等电点是它的p K1和p K2的算术平均值:p I= (p K1 + p K2 )/2;(K1:-COOH电离常数;K2:-NH3+电离常数)以Gly为例:2)侧链含有可解离基团的氨基酸,其p I值也决定于两性离子两边的p K 值的算术平均值。

氨基酸等电点的相关问题一、定义等电点(pI,isoelectric point):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,所带净电荷为零,呈电中性,此时溶液的pH称为该氨基酸的等电点。
两性离子所带电荷因溶液的pH值不同而改变,当两性离子正负电荷数值相等时,溶液的pH值即其等电点。
当外界溶液的pH大于两性离子的pl值,两性离子释放质子带负电。
当外界溶液的pH小于两性离子的pl值,两性离子质子化带正电。
二、两性与等电点的关系氨基酸具有氨基和羧基的典型反应,例如氨基可以羟基化、酰基化可与亚硝酸作用;羧基以成酯或酰氯或酰胺等。
此外,由于分子中同时具有氨基与羧基,还有氨基酸所特有的性质。
氨基酸分子中既含有氨基,又含有羧基,所以氨基酸与强酸强碱都能成盐,氨基酸是两性物质,本身能形成内盐。
氨基酸的高熔点(实际为分解点)、难溶于非极性有机溶剂等性质说明氨基酸在结晶状态是以两性离子存在的。
在水溶液中,氨基酸二偶极离子即可以与一个结合成为正离子,又可以失去一个成为负离子。
这三种离子在水溶液中通过得到或失去互相转换同时存在,在pH值达到等电点时溶液处于平衡。
等电点不是中性点,不同氨基酸由于结构不同,等电点也不同。
酸性氨基酸水溶液的pH值必然小于7,所以必须加入较多的酸才能使正负离子量相等。
反之,碱性氨基酸水溶液中正离子较多,则必须加入碱,才能使负离子量增加。
所以碱性氨基酸的等电点必然大于7。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示。
中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0;酸性氨基酸的羧基解离程度更大,pI明显小于7.0;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH即为其等电点。

计算氨基酸的等电点氨基酸的带电状况与溶液的ph值有关,改变ph值可以使氨基酸带上正电荷或负电荷,也可以使他处于正负电荷数相等即净电荷为零的兼性离子状态,此时的ph值为氨基酸的等电点。
氨基酸是同时带氨基和羧基的物种,在水溶液中羧基失去氢离子带负电,而氨基得到氢离子带正电,由于羧基酸性和氨基的碱性不相同,所以氨基酸往往整体上是带电的。
调节溶液的pH值,可以改变二者的电离状况,到某一点时羧基所带的负电荷与氨基所带的正电荷相同,氨基酸表现为整体不带电,这点的pH值就是氨基酸的等电点。
记-COOH的电离常数为Ka1 ,-NH3+的电离常数为Ka2,则等电点的pH值为pH=(Ka1+Ka2)/2解释氨基酸的等电点氨基酸是两性分子,能结合H(+)的-NH2,形成正电荷离子,也带有能够电离出H(+)的-COOH,形成负离子。
因此,氨基酸分子的整体与溶液的pH有关,改变溶液pH可以使氨基酸带上正电荷,负电荷或者正好处于净电荷为零的兼性离子状态,这个pH就是该氨基酸的等电点。
解离常数(pK)是水溶液中具有一定离解度的溶质的的极性参数。
离解常数给予分子的酸性或碱性以定量的量度,pKa减小,对于质子给予体来说,其酸性增加;对于质子接受体来说,其碱性增加。
pK=PH+log电子受体/电子供体氨基酸中,-COOH的电离常数为Ka1 ,-NH(3+)的电离常数为Ka2,该氨基酸的等电点的pH就是(Ka1+Ka2)/2去哪找等电点计算方法的资料?建议你去买本生化的教辅书等电点:如果调节溶液的PH值使得其中的氨基酸呈电中性,我们把这个PH值称为氨基酸的等电点:PI。
PI是氨基酸的重要常数之一,它的意义在于,物质在PI处的溶解度最小,是分离纯化物质的重要手段。
等电点的计算:对于所有的R基团不解离的氨基酸而言(即解离只发生在α-羧基和α-氨基上),计算起来非常简单:PI=(PK1’+PK2’)/2若是碰到R基团也解离的,氨基酸就有了多级解离,这个公式就不好用了,比如Lys、Glu、Cys等。
氨基酸和蛋白质等电点氨基酸和蛋白质等电点(isoelectric point, pI)是化学性质中一个重要的参数,对于理解生物化学和蛋白质功能至关重要。
本文将从氨基酸和蛋白质等电点的定义、计算方法和意义等方面进行全面解析,希望能够给读者带来一定的指导和启发。
首先,我们来了解一下氨基酸和蛋白质。
氨基酸是构成生物体内蛋白质的基本组成单元,它们由氨基(-NH2)、羧基(-COOH)和侧链基团(-R)组成。
目前已知的氨基酸有20种,它们的侧链基团的性质各异,决定了氨基酸的不同化学性质。
蛋白质是生命体内复杂而重要的分子,它们通过氨基酸之间的肽键连接而成。
蛋白质作为生物体内的工程师,承担着各种生物功能,如结构支持、酶催化、运输传递等。
了解蛋白质的化学性质,尤其是等电点,有助于揭示其在生物过程中的作用和调控机制。
那么,什么是等电点呢?等电点是指具有正电荷和负电荷的氨基酸或蛋白质,在特定条件下其总电荷为零的 pH 值。
也就是说,当氨基酸或蛋白质处于等电点状态时,它们不带电。
这是因为在酸性条件下,氨基酸的阳离子化,而在碱性条件下则阴离子化。
当 pH 值等于等电点时,氨基酸或蛋白质的阳离子和阴离子的数量相等,故总电荷为零。
那么如何计算氨基酸和蛋白质的等电点呢?这涉及到氨基酸和蛋白质的酸碱性质以及 Henderson-Hasselbalch 方程的应用。
对于氨基酸而言,它的等电点可以通过考察氨基酸的两个离子化过程:氨基质(-NH3+)和羧基质(-COO-)。
通过计算这两个离子化状态所占的比例,并找到它们相等的 pH 值,即可得到氨基酸的等电点。
对于蛋白质,由于它们是由多个氨基酸残基连接而成,所以计算等电点时需要考虑每个氨基酸残基的酸碱性质和比例,计算方法与氨基酸类似。
等电点对于理解氨基酸和蛋白质的生理功能具有重要的指导意义。
首先,等电点可以用于预测蛋白质在不同环境下的电荷状态,从而预测其溶解度和电动性。
其次,等电点还可以用于蛋白质的分离纯化。
等电点:某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0,等电点一般在5~6.3之间;酸性氨基酸的羧基解离程度更大,pI明显小于7.0,等电点一般在2.8~3.2之间。
;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0,等电点一般在7.6~10.8之间;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH 即为其等电点。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
氨基酸形成内盐:氨基酸的晶体是以偶极离子的形式存在。
这种偶极离子是分子内的氨基与羧基成盐的结果,故又叫内盐。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
蛋白氨酸、缬氨酸、异亮氨酸、赖氨酸、苏氨酸、色氨酸、苯丙氨酸,丙氨酸、谷氨酸、天门冬氨酸、甘氨酸、胱氨酸、脯氨酸、酷氨酸、丝氨酸、脯氨酸20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类根据侧链基团的极性1、非极性氨基酸(疏水氨基酸):8种丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe)色氨酸(Trp)蛋氨酸(Met)2、极性氨基酸(亲水氨基酸):1)极性不带电荷:7种甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)2)极性带正电荷的氨基酸(碱性氨基酸): 3种赖氨酸(Lys)精氨酸(Arg)组氨酸(His)3)极性带负电荷的氨基酸(酸性氨基酸): 2种天冬氨酸(Asp)谷氨酸(Glu)根据氨基酸分子的化学结构1、脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺2、芳香族氨基酸:苯丙氨酸、酪氨酸3、杂环族氨基酸:组氨酸、色氨酸4、杂环亚氨基酸:脯氨酸等电点的计算1)侧链不含离解基团的中性氨基酸,其等电点是它的p K1和p K2的算术平均值:p I= (p K1 + p K2 )/2;(K1:-COOH电离常数;K2:-NH3+电离常数)以Gly为例:2)侧链含有可解离基团的氨基酸,其p I值也决定于两性离子两边的p K 值的算术平均值。
等电点:
某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示
中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0,等电点一般在5~6.3之间;酸性氨基酸的羧基解离程度更大,pI明显小于7.0,等电点一般在2.8~3.2之间。
;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0,等电点一般在7.6~10.8之间;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH 即为其等电点。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
氨基酸形成内盐:氨基酸的晶体是以偶极离子的形式存在。
这种偶极离子是分子内的氨基与羧基成盐的结果,故又叫内盐。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
蛋白氨酸、缬氨酸、异亮氨酸、赖氨酸、苏氨酸、色氨酸、苯丙氨酸,丙氨酸、谷氨酸、天门冬氨酸、甘氨酸、胱氨酸、脯氨酸、酷氨酸、丝氨酸、脯氨酸
20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类
根据侧链基团的极性
1、非极性氨基酸(疏水氨基酸):8种 丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe) 色氨酸(Trp)蛋氨酸(Met)
2、极性氨基酸(亲水氨基酸):
1)极性不带电荷:7种 甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)
2)极性带正电荷的氨基酸(碱性氨基酸): 3种 赖氨酸(Lys)精氨酸(Arg)组氨酸(His)
3)极性带负电荷的氨基酸(酸性氨基酸): 2种 天冬氨酸(Asp)谷氨酸(Glu)
根据氨基酸分子的化学结构
1、 脂肪族氨基酸: 丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺
2、 芳香族氨基酸:苯丙氨酸、酪氨酸
3、 杂环族氨基酸:组氨酸、色氨酸
4、 杂环亚氨基酸:脯氨酸
等电点的计算
1)侧链不含离解基团的中性氨基酸,其等电点是它的p K1和p K2的算术平均值:p I= (p K1 + p K2 )/2;(K1:-COOH电离常数;K2:-NH3+电离常数)
以Gly为例:
2)侧链含有可解离基团的氨基酸,其p I值也决定于两性离子两边的p K 值的算术平均值。
a. 酸性氨基酸:p I= (p K1 + p K R-COO- )/2
以Asp为例:
b. 碱性氨基酸:p I= (p K R-NH2 + p K2 )/2
以Lys为例:。