第3章氨基酸详解
- 格式:ppt
- 大小:3.11 MB
- 文档页数:127



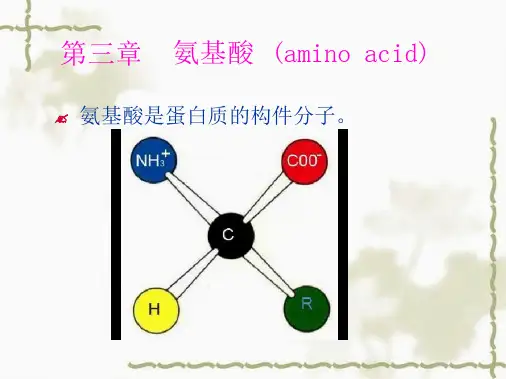

第3章氨基酸四大类生物分子中蛋白质是生物功能的主要载体,而氨基酸(amino acid)是蛋白质的构件分子。
自然界中存成千上万在的种蛋白质,在结构和功能上的惊人的多样性归根结底是由20种常见氨基酸的内在性质造成的。
这些性质包括①聚合能力,②特有的酸碱性质,③侧链的结构及其化学功能的多样性,④手性。
本章主要讲述这些性质,它们是讨论蛋白质和酶的结构、功能以及许多其他有关问题的基础。
一、氨基酸—蛋白质的构件分子(一)蛋白质的水解一百多年前就开始了关于蛋白质的化学研究。
在早期的研究中,水解作用提供了关于蛋白质组成和结构的极其价值的资料。
蛋白质可以被酸、碱或蛋白酶催化水解。
在水解过程中,逐渐降解成相对分子质量越来越小的肽段(peptide fragment),直到最后成为氨基酸的混合物。
根据蛋白质的水解程度,可分为完全水解和部分水解两种情况。
完全水解或称彻底水解,得到的水解产物是各种氨基酸的混合物。
部分水解即不完全水解,得到的产物是各种大小不等的肽段和氨基酸。
下面简略地介绍酸、碱和酶3种水解方法及其优缺点:⑴酸水解常用H2SO4或HCl进行水解。
一般6mol/L HCl,4mol/L H2SO4;回流煮沸20h 左右可使蛋白质完全水解。
酸水解的优点是不引起消旋作用(racemization),得到的是L-氨基酸。
缺点是色氨酸完全被沸酸所破坏,羟基氨基酸(丝氨酸及苏氨酸)有一小部分被分解,同时天冬氨酸和谷氨酰胺的酰胺基被水解下来。
⑵碱水解一般与5mol/L NaOH共煮10~20h,即可使蛋白质完全水解。
水解过程中多数氨基酸遭到不同程度的破坏,并且产生消旋现象,所得产物是D-和L-氨基酸的混合物,称消旋物(见本章氨基酸的光学活性部分)。
此外,碱水解所需时间较长。
因此酶法主要用于部分水解。
常用的蛋白酶有胰蛋白酶(trypsin)、胰凝乳蛋白酶或称糜蛋白酶(chymotrypsin)以及胃蛋白酶(pepsin)等,它们主要用于蛋白质一级结构分析以获得蛋白质的部分水解产物。






第三章氨基酸提要α-氨基酸是蛋白质的构件分子,当用酸、碱或蛋白酶水解蛋白质时可获得它们。
蛋白质中的氨基酸都是L型的。
但碱水解得到的氨基酸是D型和L型的消旋混合物。
参与蛋白质组成的基本氨基酸只有20种。
此外还有若干种氨基酸在某些蛋白质中存在,但它们都是在蛋白质生物合成后由相应是基本氨基酸(残基)经化学修饰而成。
除参与蛋白质组成的氨基酸外,还有很多种其他氨基酸存在与各种组织和细胞中,有的是β-、γ-或δ-氨基酸,有些是D型氨基酸。
氨基酸是两性电解质。
当pH接近1时,氨基酸的可解离基团全部质子化,当pH在13左右时,则全部去质子化。
在这中间的某一pH(因不同氨基酸而异),氨基酸以等电的兼性离子(H3N+CHRCOO-)状态存在。
某一氨基酸处于净电荷为零的兼性离子状态时的介质pH称为该氨基酸的等电点,用pI表示。
所有的α-氨基酸都能与茚三酮发生颜色反应。
α-NH2与2,4-二硝基氟苯(DNFB)作用产生相应的DNP-氨基酸(Sanger反应);α-NH2与苯乙硫氰酸酯(PITC)作用形成相应氨基酸的苯胺基硫甲酰衍生物(Edman 反应)。
胱氨酸中的二硫键可用氧化剂(如过甲酸)或还原剂(如巯基乙醇)断裂。
半胱氨酸的SH基在空气中氧化则成二硫键。
这几个反应在氨基酸荷蛋白质化学中占有重要地位。
除甘氨酸外α-氨基酸的α-碳是一个手性碳原子,因此α-氨基酸具有光学活性。
比旋是α-氨基酸的物理常数之一,它是鉴别各种氨基酸的一种根据。
参与蛋白质组成的氨基酸中色氨酸、酪氨酸和苯丙氨酸在紫外区有光吸收,这是紫外吸收法定量蛋白质的依据。
核磁共振(NMR)波谱技术在氨基酸和蛋白质的化学表征方面起重要作用。
氨基酸分析分离方法主要是基于氨基酸的酸碱性质和极性大小。
常用方法有离子交换柱层析、高效液相层析(HPLC)等。
习题1.写出下列氨基酸的单字母和三字母的缩写符号:精氨酸、天冬氨酸、谷氨酰氨、谷氨酸、苯丙氨酸、色氨酸和酪氨酸。
[见表3-1]表3-1 氨基酸的简写符号名称三字母符号单字母符号名称三字母符号单字母符号丙氨酸(alanine) Ala A 亮氨酸(leucine) Leu L精氨酸(arginine) Arg R 赖氨酸(lysine) Lys K天冬酰氨(asparagines) Asn N 甲硫氨酸(蛋氨酸)(methionine) Met M天冬氨酸(aspartic acid) Asp D 苯丙氨酸(phenylalanine) Phe FAsn和/或Asp Asx B半胱氨酸(cysteine) Cys C 脯氨酸(praline) Pro P 谷氨酰氨(glutamine) Gln Q 丝氨酸(serine) Ser S谷氨酸(glutamic acid) Glu E 苏氨酸(threonine) Thr TGln和/或Glu Gls Z甘氨酸(glycine) Gly G 色氨酸(tryptophan) Trp W组氨酸(histidine) His H 酪氨酸(tyrosine) Tyr Y 异亮氨酸(isoleucine) Ile I 缬氨酸(valine) Val V 2、计算赖氨酸的εα-NH3+20%被解离时的溶液PH。