(全国版)19版高考化学一轮复习第5章物质结构元素周期律第2节元素周期表和元素周期律限时规范特训
- 格式:doc
- 大小:144.04 KB
- 文档页数:7




(全国版)2019版高考化学一轮复习第5章物质结构元素周期律第2节元素周期表和元素周期律学案编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((全国版)2019版高考化学一轮复习第5章物质结构元素周期律第2节元素周期表和元素周期律学案)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(全国版)2019版高考化学一轮复习第5章物质结构元素周期律第2节元素周期表和元素周期律学案的全部内容。
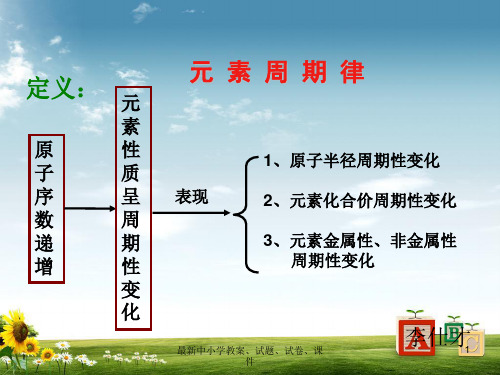
第2节元素周期表和元素周期律考试说明1.掌握元素周期律的实质。
2.了解元素周期表的结构及应用。
3.了解金属元素、非金属元素在元素周期表中的位置及其性质递变规律。
4.以第ⅠA族和第ⅦA族为例,掌握同一主族内元素性质的递变规律与原子结构的关系。
5.以第三周期为例,掌握同一周期元素性质的递变规律与原子结构的关系。
命题规律元素周期律及其应用是每年必考的热点,主要利用“位、构、性”的关系考查元素推断及元素化合物的性质,结合元素周期律考查元素的金属性及非金属性强弱、微粒半径、最高价氧化物对应水化物酸碱性的比较、气态氢化物的稳定性和元素周期表的结构,以及常见元素单质和化合物的性质特点,以选择题型为主。
考点1 元素周期表世界上第一张元素周期表是在1869年由俄国化学家门捷列夫绘制完成的。
1.原子序数按照元素在周期表中的顺序给元素所编的序号。
原子序数=核电荷数=质子数=核外电子数.2.元素周期表的编排原则(1)把电子层数相同的元素按原子序数递增顺序从左到右排成一横行,共有7个横行。
(2)把不同横行中最外层电子数相同的元素按电子层数递增的顺序从上到下排成一纵行,共有18个纵行。

(全国通用版)2019版高考化学一轮复习第五章物质结构元素周期律高效演练直击高考5.2 元素周期表元素周期律编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((全国通用版)2019版高考化学一轮复习第五章物质结构元素周期律高效演练直击高考5.2 元素周期表元素周期律)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(全国通用版)2019版高考化学一轮复习第五章物质结构元素周期律高效演练直击高考5.2 元素周期表元素周期律的全部内容。
5.2 元素周期表元素周期律高效演练·直击高考1。
(2018·鞍山模拟)W、X、Y、Z为原子序数递增的四种短周期元素。
W是原子半径最小的元素,X的一种核素在考古时常用来鉴定一些文物的年代,Y是植物生长所需化学肥料中主要的营养元素之一,Z原子的最外层电子数是X原子最外层电子数的1.5倍.下列说法正确的是( )A.氢化物的沸点:Z一定高于YB。
最高价氧化物对应水化物的酸性:X强于YC。
W、X、Y、Z都能分别与氯元素形成共价化合物D。
仅由W、Y、Z三种元素组成的化合物不可能属于盐类【解析】选C.W、X、Y、Z为原子序数递增的四种短周期元素。
W是原子半径最小的元素,则W 是H。
X的一种核素在考古时常用来鉴定一些文物的年代,所以X是C.Y是植物生长所需化学肥料中主要的营养元素之一,则Y是N。
Z原子的最外层电子数是X原子最外层电子数的1。
5倍,即最外层电子数是6,所以Z是O或S。
A项,若Z为S,则硫化氢的沸点低于氨气的沸点,错误;B项,碳元素的非金属性弱于氮,则最高价氧化物对应水化物的酸性:H2CO3弱于HNO3,错误;C项,W、X、Y、Z都能分别与氯元素形成共价化合物,例如HCl、CCl4、NCl3、ClO2、SCl2,正确;D项,仅由W、Y、Z三种元素组成的化合物可能属于盐类,例如硝酸铵是盐类,错误。
第2节元素周期表和元素周期律板块三限时规范特训时间:45分钟满分:100分一、选择题(每题6分,共72分)1.[2017·河北张家口模拟]下列有关元素的性质或递变规律的说法正确的是( ) A.第ⅠA族与第ⅦA族元素间可形成共价化合物或离子化合物B.第三周期主族元素从左到右,氧化物对应的水化物酸性依次增强C.同主族元素的简单阴离子还原性越强,对应的简单氢化物沸点越高D.同周期金属元素的主族序数越大,其原子失电子能力越强答案 A解析第ⅠA族为H和碱金属元素,第ⅦA族元素为卤族元素,H与卤族元素形成共价化合物,碱金属元素与卤族元素形成离子化合物,A正确;第三周期元素从左到右非金属性逐渐增强,其最高价氧化物对应水化物的酸性依次增强,B错误;同主族元素的简单阴离子还原性越强,元素非金属性越弱,对应简单氢化物的稳定性越弱。
沸点与分子间作用力有关,结构相似的分子晶体相对分子质量越大,分子间作用力越强,熔沸点越高,如第ⅦA族沸点HF>HI>HBr>HCl,HF、NH3、H2O在同族氢化物中沸点反常,是因为分子间有氢键,C错误;同周期金属元素主族序数越大,金属性越弱,越难失去电子,如第三周期中,Na比Al容易失去电子,D错误。
2.[2017·湖北黄冈高三质检]X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。
下列说法正确的是( ) A.原子最外层电子数:X>Y>ZB.单质沸点:X>Y>ZC.离子半径:X2->Y+>Z-D.原子序数:X>Y>Z答案 D解析根据题中信息可确定X、Y、Z分别为S、Na和F。
原子最外层电子数F>S>Na,A 错误;单质沸点Na>S>F2,B错误;离子半径S2->F->Na+,C错误;原子序数S>Na>F,D正确。
3.[2017·湖南长沙长郡中学期中]美国FDA证实,该国地质勘测局在内华达州法隆镇的一些奶牛场附近的井水中发现了84号元素Po(钋)的一种放射性致癌同位素。
钋是目前已知最稀有的元素之一,下列有关它的说法正确的是( )A.门捷列夫能预测钋在地球上的分布B.钋位于元素周期表第七周期第ⅥA族C.钋原子的最外层电子数为6D.钋属于副族元素答案 C解析门捷列夫发现了元素周期律,但不能预测元素在地球上的分布,A错误;钋的原子序数为84,和86号元素的原子序数相差2,故钋位于元素周期表第六周期第ⅥA族,B、D 错误;钋原子的最外层电子数为6,C正确。
4.已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价绝对值与W元素最高正价相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R的最高价氧化物对应的水化物两两反应均生成盐和水。
下列说法正确的是( )A.原子半径由大到小的顺序:Z、W、YB.简单气态氢化物的稳定性由强到弱的顺序:X、Y、RC.W的最高价氧化物对应的水化物碱性比Z的强D.R的最高价氧化物对应水化物的化学式一定是HRO4答案 A解析根据W的冶炼方法及“Z、W、R的最高价氧化物对应的水化物两两反应均生成盐和水”可知W为铝元素,“X元素最低负价绝对值与W元素最高正价相等”则X为氮元素,由“X、Y、Z、W、R原子序数依次增大”可知Z为钠元素,R为硫元素或氯元素,Y为氧元素或氟元素。
A项,原子半径:Na>Al>Y,正确;B项,X、Y、R的气态氢化物中Y的氢化物最稳定,错误;C项,氢氧化铝是两性氢氧化物,碱性弱于氢氧化钠,错误;D项,R为硫元素或氯元素,当R为硫元素时最高价氧化物对应水化物为H2SO4,错误。
5.[2018·山东临沂质检]下列关于元素周期表的说法中正确的是( )A.同一主族元素的原子序数的差不可能为10B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定为1C.催化剂一般在金属元素与非金属元素的分界处寻找D.过渡元素全部是金属元素答案 D解析第ⅠA族的H元素和Na元素的原子序数相差10,A项错误;从第四周期开始,同周期第ⅡA族与第ⅢA族元素的原子序数差值不为1,B项错误;催化剂应在过渡元素区域寻找,C项错误。
6.[2017·太原重点中学联考]R、X、Y、Z、A是短周期主族元素,它们在周期表中的相对位置如图所示。
X原子最外层电子数等于其电子层数的3倍。
下列推断正确的是( )AB.原子半径由小到大的顺序为:Z<A<Y<XC.最高价氧化物对应的水化物酸性由弱到强的顺序为:Z<R<AD.RY3、A2X、ZA5分子中每个原子最外层都达到8电子结构答案 C解析由元素的位置关系知,X位于第2周期,只有氧原子的最外层电子数等于其电子层数的3倍,则X为氧元素,由此推知R为氮元素,Y为氟元素,Z为磷元素,A为氯元素。
A项,热稳定性:PH3<NH3<H2O<HF,错误;B项,原子半径:r(P)>r(Cl)>r(O)>r(F),错误;C 项,酸性:H3PO4<HNO3<HClO4,正确;D项,PCl5分子中磷原子最外层有10个电子,错误。
7.四种短周期元素在周期表中的相对位置如图所示,其中Z元素最外层电子数是其电子层数的2倍。
下列说法正确的是( )A.四种短周期元素中WB.Z元素在周期表中的位置是第三周期ⅣA族C.原子最外层电子数由多到少的顺序:Y>X>W>Z,最高正价由高到低的顺序:W>ZD.元素非金属性由强到弱的顺序:W>Z,W的单质常温下可与氢氧化钠溶液反应答案 D解析由题意Z元素最外层电子数是其电子层数的2倍可知Z为S元素,则Y为O元素,X为N元素,W为Cl元素。
A项,四种元素中原子半径最小的为O,错误;B项,S元素在周期表中的位置为第三周期第ⅥA族,错误;C项,Cl原子最外层电子数最多,O和S原子最外层电子数相同,错误;D项,S和Cl处于同一周期,非金属性:S<Cl,Cl2在常温下与氢氧化钠溶液发生反应生成氯化钠、次氯酸钠和水,正确。
8.[2017·河北保定期中]下列叙述正确的是( )A.铅位于元素周期表中金属元素与非金属元素交界处,可作半导体材料B.若存在简单阴离子R2-,则R一定属于第ⅥA族元素C.S和Se属于第ⅥA族元素,H2S的还原性比H2Se的强D.最外层电子数为1的元素一定属于第ⅠA族元素答案 B解析A项,Pb不位于金属元素与非金属元素交界处,不可作半导体材料,错误;C项,H2S的还原性比H2Se的弱,错误;D项,最外层电子数为1的元素也可能为过渡元素,错误。
9.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。
下列叙述正确的是( )A.原子最外层电子数由多到少的顺序:Y、X、W、ZB.原子半径由大到小的顺序:W、Z、Y、XC.元素非金属性由强到弱的顺序:Z、W、XD.简单气态氢化物的稳定性由强到弱的顺序:X、Y、W答案 A解析由题意推断,X、Y、Z、W分别是O、F、Al、Si。
最外层电子数:F>O>Si>Al,A 项正确;原子半径:Al>Si>O>F,B项错误;非金属性:O>Si>Al,C项错误;简单气态氢化物的稳定性:HF>H2O>SiH4,D项错误。
10.[2018·安徽合肥质检]X、Y、Z、W是原子序数依次增大的不同主族短周期元素,其中两种为金属元素,X原子的最外层电子数与次外层电子数相等,X与W、Y与Z这两对原子的最外层电子数之和均为9。
下列说法正确的是( )A.Y的简单离子半径大于W的简单离子半径B.Z的氧化物对应水化物为强酸C.固体Y2Z3不能从溶液中制得D.XW2分子中各原子最外层都达到8电子稳定结构答案 C解析X原子的最外层电子数与次外层电子数相等,且X的原子序数最小,则X为Be元素;X与W、Y与Z这两对原子的最外层电子数之和均为9,X、Y、Z、W的原子序数依次增大,且有两种金属元素,则X、Y、Z、W应为Be、O、Al、Cl或Be、Al、S、Cl,Y离子半径小于W离子,A错误;Z元素的氧化物有Al2O3、SO2、SO3,对应的水化物分别为Al(OH)3、H2SO3、H2SO4,B错误;固体Y2Z3为Al2S3,由于Al3+与S2-在水溶液中发生相互促进的双水解反应生成Al(OH)3沉淀和H2S气体,故不能从溶液中制取Al2S3,C正确;XW2为BeCl2,分子中Cl原子最外层达到8电子稳定结构,Be原子不满足8电子稳定结构,D错误。
11.甲~庚等元素在周期表中的相对位置如下表。
己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。
下列判断正确的是( )A.丙与戊的原子序数相差18B.气态氢化物的稳定性:庚<己<戊C.常温下,甲和乙的单质均能与水剧烈反应D.丁的最高价氧化物可用于制造光导纤维答案 D解析根据题中信息可确定己和甲分别为S和Mg,则乙、丙、丁、戊、庚分别为Ca、B、Si、As和F。
B和As原子序数分别为5和33,二者相差28,A项错误;根据非金属性可确定稳定性:HF>H2S>AsH3,B项错误;常温下Mg和水反应非常缓慢,C项错误;SiO2可用于制造光导纤维,D项正确。
12.[2017·山东青岛高三期末]根据表中八种短周期元素的有关信息判断,下列说法错误的是( )A.元素④气态氢化物的稳定性强于元素⑤气态氢化物的稳定性B.元素②气态氢化物的沸点低于元素⑤气态氢化物的沸点C.元素②⑥形成的化合物具有两性D.元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强答案 B解析由题给原子半径和元素化合价信息结合元素周期律可知,①为氢、②为氧、③为硼、④为氯、⑤为硫、⑥为铝、⑦为锂、⑧为钠。
氯的非金属性强于硫,氯化氢的稳定性强于硫化氢,A项正确;水的沸点高于硫化氢,B项错误;氧和铝形成化合物氧化铝是两性氧化物,C项正确;氯的非金属性强于硫,高氯酸的酸性强于硫酸,D项正确。
二、非选择题(共28分)13.[2018·合肥一六八中测试](13分)X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大。
元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数之比为3∶8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一。