石灰氧化镁测定方法
- 格式:doc
- 大小:22.20 KB
- 文档页数:6
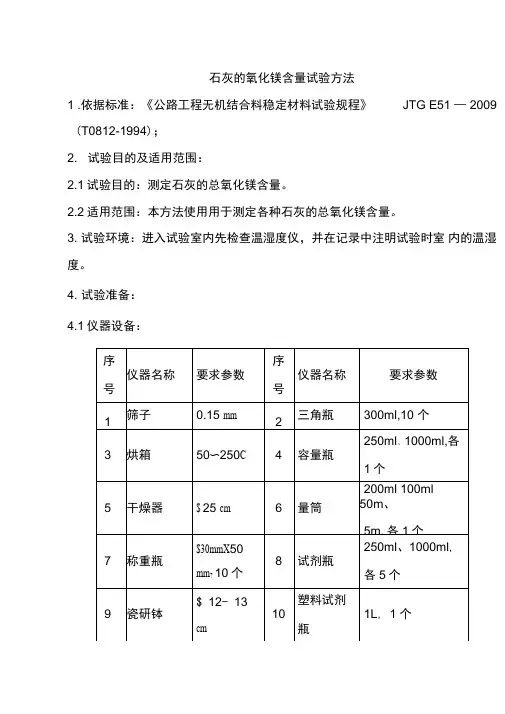

T 0812—1994 石灰氧化镁测定方法1 适用范围本方法适用于测定各种石灰的总氧化镁含量。
2 仪器设备2.1 方孔筛:0.15mm,1个。
2.2 烘箱:50~250℃,1台。
2.3 干燥器:φ25cm,1个。
2.4 称量瓶:φ30mm×50mm,10个。
2.5 瓷研钵:φ12~13cm,1个。
2.6 分析天平:量程不小于50g,感量0.0001g,1台。
2.7 天子天平:量程不小于500g,感量0.01g,1台。
2.8 电炉:1500W,1个。
2.9 石棉网:20cm×20cm,1块。
2.10 玻璃珠:φ3mm,1袋(0.25kg)。
2.11 具塞三角瓶:250mL,20个。
2.12 漏斗:短颈,3个。
2.13 塑料洗瓶:1个。
2.14 塑料桶:20L,1个。
2.15 下口蒸馏水瓶:5000mL,1个。
2.16 三角瓶:300mL,10个。
2.17 容量瓶:250mL、1000mL,各1个。
2.18 量筒:200mL、100mL、50mL、5mL,各1个。
2.19 试剂瓶:250mL、1000mL,各5个。
2.20 塑料试剂瓶:1L,1个。
2.21 烧杯:50mL,5个;250mL(或300mL),10个。
2.22 棕色广口瓶:60mL,4个;250mL,5个。
2.23 滴瓶:60mL,3个。
2.24 酸滴定管:50mL,2支。
2.25 滴定台及滴定管夹:各1套。
2.26 大肚移液管:25mL、50mL,各1支。
2.27 表面皿:7cm,10块。
2.28 玻璃棒:8mm×250mm及4mm×180mm,各10支。
2.29 试剂勺:5个。
2.30 吸水管:8mm×150mm ,5支。
2.31 洗耳球:大、小各1个。
3 试剂3.1 1﹕10盐酸:将1体积盐酸(相对密度1.19)以10体积蒸馏水稀释。
3.2 氢氧化铵—氯化铵缓冲溶液:将67.5g 氯化铵溶于300mL 无二氧化碳蒸馏水中,加浓氢氧化铵(氨水)(相对密度为0.90)570mL ,然后用水稀释至1000mL 。

氧化钙和氧化镁含量简易测定方法
试剂
(1)1N盐酸标准液:取83mL(相对密度1.19)浓盐酸以蒸馏水稀释至1000mL.
(2)1%酚酞指示液.
试验步骤:
迅速称取石灰试样0.8—1.0g(标准至0.0005g)放入300mL三角瓶中.放入150mL新煮沸并已冷却的蒸馏水和10颗玻璃珠.瓶口上插一短颈漏斗,加热5min,但勿使沸腾,迅速冷却.滴入酚酞示剂2滴,在不断摇动下以盐酸标准液滴定,控制速度为每秒2—3滴,至粉红色完全消失,稍停,又出现红色,继续滴入盐酸,如此重复几次,直至5min内不出现红色为止.如滴定过程持续半小时以上,则结果只能作参考.
V×N×0.028
CaO+MgO= ×100
G
式中;V-滴定消耗盐酸标准溶液的体积mL:
N-盐酸标准溶液当量浓度:
G-样品质量:
0.028-氧化钙的毫克当量.因氧化镁含量甚少,并且两者之毫克当量相差不大,故有效(CaO+MgO)%的毫克当量都以CaO的毫克当量计算.。

石灰中有效氧化镁和氧化钙含量试验记录
试验目的:
研究石灰中有效氧化镁和氧化钙的含量,探索石灰材料的质量和性能。
实验设备:
1.石灰样品
2.显微镜
3.高精度天平
4.显色剂
5.试管
6.玛瑙研钵
7.玻璃棒
8.绞龙器
9.烘箱
实验步骤及观察记录:
1.取一定量的石灰样品,将其放入玛瑙研钵中;
2.使用玻璃棒将石灰样品绞碎成粉末状,并搅拌均匀;
3.将绞碎后的石灰样品称取一定质量,记录称重结果;
4.将所称的石灰样品倒入试管中,再加入一定量的水,用玻璃棒搅拌
均匀;
5.将试管中的溶液过滤,收集滤液;
6.将滤液中的氧化镁和氧化钙含量测定。
观察记录及数据记录:
1.称取的石灰样品质量为10g;
2. 溶液过滤后,得到的滤液量为30ml;
3.根据测定结果,滤液中的氧化镁含量为3g/L,氧化钙含量为12g/L。
实验结果分析:
根据实验数据分析得出,该石灰样品的有效氧化镁含量为0.03g,氧
化钙含量为0.12g。
结论:
通过对石灰中有效氧化镁和氧化钙含量的测定,我们得出了该石灰样
品的含量为0.03g/10g(0.3%)的氧化镁和0.12g/10g(1.2%)的氧化钙。
这为进一步研究石灰材料的性能和应用提供了参考和依据。


石灰有效氧化钙和氧化镁简易测定方法石灰是一种常见的化学物质,主要成分是氧化钙(CaO)。
而氧化钙和氧化镁(MgO)都是常用的氧化剂,在实验室中常用于测定某些化学物质的含量。
测定方法一般采用滴定法。
滴定法是一种常见的定量分析方法,通过滴定剂与待测物质发生化学反应,从而确定待测物质的含量。
在测定氧化钙和氧化镁的含量时,一般是将它们与酸反应产生盐类,然后用酸碱滴定法测定所生成的盐类的含量。
对于氧化钙的测定,常用的滴定剂是盐酸。
首先将待测样品与过量的盐酸反应生成氯化钙,然后用酸碱滴定法测定生成的氯化钙的含量。
具体操作步骤如下:1. 称取一定量的待测样品,加入适量的盐酸中进行反应。
2. 将反应混合物进行加热,使反应充分进行。
3. 将反应混合物冷却至室温,然后用酸碱滴定法进行滴定。
常用的指示剂是酚酞或溴酚蓝,滴定终点为溶液颜色由红变黄。
4. 记录滴定所耗的滴定液的体积,根据滴定液的浓度计算出样品中氧化钙的含量。
对于氧化镁的测定,常用的滴定剂是硫酸。
测定方法与氧化钙类似,具体操作步骤如下:1. 称取一定量的待测样品,加入适量的硫酸中进行反应。
2. 将反应混合物进行加热,使反应充分进行。
3. 将反应混合物冷却至室温,然后用酸碱滴定法进行滴定。
常用的指示剂是甲基橙或溴酚绿,滴定终点为溶液颜色由黄变红。
4. 记录滴定所耗的滴定液的体积,根据滴定液的浓度计算出样品中氧化镁的含量。
需要注意的是,在进行滴定时应注意滴定液的浓度、滴定速度和反应温度等因素,以确保测定结果的准确性。
此外,由于石灰和氧化镁常用于建筑材料中,因此在工业生产中也需要对石灰和氧化镁的含量进行测定,以确保产品的质量。
石灰有效氧化钙和氧化镁的简易测定方法主要采用滴定法,通过滴定剂与待测物质发生反应,从而确定其含量。
这种方法简单易行,准确度较高,广泛应用于化学分析和工业生产中。

doi:10 3969/j issn 1004-275X 2020 08 032电感耦合等离子体发射光谱法测定石灰石中的氧化钙、氧化镁阳国运,潘倩妮,何雨珊,黄献珠(广西壮族自治区地质矿产测试研究中心,广西 南宁 530023)摘 要:采用盐酸溶解石灰石样品,再加入酒石酸络合,降低记忆效应,加入内标后稀释后于电感耦合等离子体发射光谱仪上测定。
该方法避免了因记忆效应引起测试不稳定的问题,经石灰石国家标准物质分析验证,高含量氧化钙、氧化镁(10%以上)测试结果准确且重现性好(RSD<0 4%,n=6),适用于一般石灰石样品中氧化钙、氧化镁的快速、准确分析。
关键词:石灰石;氧化钙;氧化镁;络合;内标;发射光谱法法 中图分类号:O657 31;TQ172 41 文献标识码:A 文章编号:1004-275X(2020)08-100-04DeterminationofCalciumOxideandMagnesiumOxideinLimestonebyInductivelyCoupledPlasmaEmissionSpectrometryYangGuoyun,PanQianni,HeYushan,HuangXianzhu (GuangxiZhuangAutonomousRegionGeologicalandMineralTestingResearchCenter,GuangxiNanning530023) Abstract:Dissolvethelimestonesamplewithhydrochloricacid,andthenaddtartaricacidtoreducethememoryeffect Afteraddingtheinternalstandard,diluteitandmeasureitonaninductivelycoupledplasmaemissionspectrometer Thismethodavoidstheproblemofunstabletestduetomemoryeffect Asverifiedbytheanalysisofthenationalstandardmaterialforlime stone,thetestresultsofhighcontentcalciumoxideandmagnesiumoxide(morethan10%)areaccurateandreproducible(RSD<0 4%,n=6),Itissuitableforquickandaccurateanalysisofcalciumoxideandmagnesiumoxideingenerallime stonesamples Keywords:limestone;calciumoxide;magnesiumoxide;complexation;internalstandard;emissionspectrummethod 石灰岩以其在自然界中分布广、易于获取的特点而被广泛应用造纸、橡胶、油漆、涂料、医药、化妆品、饲料、密封、粘结、抛光等产品的制造中。



石灰有效氧化钙和氧化镁简易测定的原理咱来说说石灰有效氧化钙和氧化镁简易测定这档子事儿哈。
你看哈,石灰就像是我们生活中的一个小魔术道具,而有效氧化钙和氧化镁就是这个魔术的关键秘密啦!那这个简易测定呢,就好比是我们解开这个魔术秘密的钥匙。
想象一下,我们就像是一群好奇的探险家,要去探索石灰这个神秘世界里的秘密。
有效氧化钙和氧化镁在石灰里可重要啦,它们决定着石灰的质量和性能呢。
那怎么去找到它们呢?嘿嘿,这就需要一些特别的方法啦。
就好像我们找宝藏一样,得有特定的线索和工具。
我们通过一些化学反应,让石灰里的有效氧化钙和氧化镁现形。
这可不是随随便便就能做到的哦,得小心翼翼地操作,就跟呵护宝贝似的。
比如说,我们把石灰和一些特定的试剂混合在一起,然后观察发生的变化。
这就好像是一场精彩的表演,石灰和试剂就是舞台上的主角,它们的互动会给我们带来惊喜。
要是操作不当,那可就看不到这场精彩表演啦!这可不像做饭,盐放多了下次少放点就行。
这得全神贯注,不能有一丝马虎。
而且啊,这个过程中还得有耐心,不能着急。
就跟钓鱼似的,得等着鱼儿上钩,可不能这边刚下钩那边就想拉起来。
咱再想想,要是没有这个简易测定,那我们怎么知道石灰好不好用呢?那不就跟闭着眼睛走路一样,容易摔跟头呀!所以说呀,这个石灰有效氧化钙和氧化镁简易测定可太重要啦!它能帮我们把关石灰的质量,让我们在使用石灰的时候心里有底。
咱可别小看了这个小小的测定,它背后蕴含着大大的学问呢!就像一颗小小的星星,也能在夜空中闪闪发光。
通过这个简易测定,我们能更好地了解石灰,更好地利用它。
这就像是给我们的建筑、工程等领域加上了一把可靠的锁,让一切都更加稳固、可靠。
总之呢,石灰有效氧化钙和氧化镁简易测定就是我们探索石灰世界的重要途径,是我们保证石灰质量的有力武器。
我们一定要好好掌握这个方法,让石灰为我们的生活和工作带来更多的便利和好处呀!原创不易,请尊重原创,谢谢!。
测定石灰有效氧化钙镁含量及灰剂量1、概述众所周知,石灰能改善土的工程性质,便于施工,也易达到规范要求,并且成本低,故越来越广泛地被应用于公路工程中。
掺灰后土的工程性能大大改观,土的塑性降低,含水量降低,提高了土的强度和稳定性,并大大地缩短了施工周期。
为了有效地控制灰土的质量,就必须能准确地对石灰的有效钙、镁含量和灰剂量进行测定。
2、测试原理及方法由于测定石灰有效钙镁含量和灰剂量的试验方法很多,现仅对〈〈公路工程无机结合料稳定材料试验规程》中的几个常用试验加以剖析。
2.1有效氧化钙的测定(T08011-94)2.1.1测试原理:利用石灰中的氧化钙能溶于蔗糖中,并能与盐酸反应生成蔗糖钙,而氧化镁则与蔗糖反应缓慢的原理,来测定氧化钙的含量。
2.1.2测试的关键点:对0.5N的盐酸标准溶液的配制和标定1 )其标定过程可用以下化学反应式表示NaCO 3+2HCL2NaCL+2O+C212)盐酸标准溶液的当量浓度的计算公式的由来:由以上化学方程式可知:1摩尔的碳酸钠要消耗2摩尔的盐酸,而碳酸钠的麾尔数为Q/0.106,故盐酸的麾尔数Q/0.053,则其当量也为:Q/0.053c 故其当量浓度N=Q/0.053V (V一为盐酸的消耗的体积)3 )若计算后N>0.5,则需添加蒸馆水,其量可按下式计算:△ V 水=V(N/0.5-1)1.将石灰试样粉碎,通过1毫米筛孔,用四分法缩分为200克,再用研钵磨细通过0.15毫米筛孔,用四分法缩分为10克左右。
2.将试样在105〜110C的烘箱中烘十1小时然后移于十燥器中冷却。
3.用称量瓶按减量法称取试样约0.2克(准确至1毫克)置于锥形瓶中,迅即加入蔗糖约5在盖于试样表面(以减少试样与空气接触)同时加入玻璃珠约10粒。
接着即加入新煮沸并已冷却的蒸僻水50毫升,立即加盖瓶塞,并强烈摇荡15分钟(注意时间不宜过短)。
4.播荡后开启瓶塞,加入酚猷指示剂2〜3滴,溶液即呈现粉红色,然后用盐酸标准溶液滴定。
石灰中氧化钙氧化镁的测定
发布时间:2011-4-18
石灰中氧化钙氧化镁的测定
1、方法提要:
样品经酸溶后用三乙醇胺掩蔽铁(Ⅲ)、铝(Ⅲ)不分离可直接测定。
2、试剂:
2.1 盐酸浓,(1+1)。
2.2 三乙醇胺溶液(1+1)。
2.3 氢氧化钾溶液(200g/L)。
2.4 K-B指示剂:称0.5g酸性铬蓝K和0.5g萘酚绿B,分别用
(1+1)三乙醇铵溶解并定容到50mL容量瓶中,摇匀备用,然后按1(K)∶2(B)的体积混合摇匀即可,或用0.34g酸性铬蓝K与0.66g 萘酚绿B于烧杯中用100mL三乙醇铵(1+1)溶解摇匀。
2.5 氨水-氯化铵缓冲液(PH=10)用67.5g氯化铵溶于200mL水中,再加570mL氨水加水至1L,混匀。
2.6 Na2EDTA标准溶液。
3、分析步骤:
准确称取0.5000g试样于250mL烧杯中,加入盐酸20mL加热蒸至5mL 小体积后,取下冷却,转入250mL容量瓶中,以水定容,摇匀。
分取50mL上清液于300mL烧杯中,加5mL 三乙醇胺溶液(1+1)放置
5min,加入氢氧化钾溶液20mL,滴加3滴K-B指示剂,用
0.025mol/LNa2EDTA标准溶液滴至溶液由红色变为蓝色为终点即完成对钙的滴定,然后用HCl(1+1)调溶液由蓝-红-蓝-至酒红色后加入氨水-氯化铵缓冲溶液(PH=10)20mL用0.025mol/LNa2EDTA标准溶液滴至溶液由酒红色变成纯蓝色为终点。
计算参见分类文章耐火材料中石灰石、石灰及白云石的测定。
石灰氧化镁测定方法嘿,咱今儿就来聊聊石灰氧化镁测定方法这档子事儿!你说这石灰氧化镁,那可是在好多领域都有着重要地位呢。
要想测定它,咱得先准备好各种家伙什儿。
就好像你要去打仗,不得先把刀枪棍棒准备齐全了呀!那得有精确的仪器、试剂啥的。
首先呢,咱得把样本取好,这就好比做菜得选好食材,要是食材不行,那做出来的菜能好吃吗?样本可得有代表性,不能随随便便就弄一点。
然后就是具体的测定过程啦。
这就像是走迷宫,得一步一步来,不能着急。
得按照规定的步骤,小心翼翼地操作,稍有不慎可能就前功尽弃啦!你想想,要是走迷宫的时候乱走一气,那能走出去吗?在这个过程中,温度、时间这些因素都得把握好,就跟炒菜掌握火候一样重要。
温度高了不行,低了也不行,时间长了不行,短了也不行。
有时候我就想啊,这测定石灰氧化镁就像是一场精细的表演,每个动作都得恰到好处。
稍有偏差,那结果可能就差之千里咯!这可不是闹着玩的呀。
而且啊,这个过程还得特别细心,不能有一点儿马虎。
就好像你缝衣服,线要是没缝好,那衣服不就散架啦?咱再说说这测定方法的准确性,那可真是太重要啦!要是不准确,那得出的数据还有啥用呢?这就好比你拿着一把不准的尺子去量东西,那能量对吗?咱平常生活中也有很多类似的事情呀,你做一件事就得认真对待,不能敷衍了事。
就像考试,你不认真答题能考出好成绩吗?总之呢,石灰氧化镁测定方法可不是那么简单的,需要我们认真对待,细心操作。
只有这样,才能得到准确可靠的结果。
这可关系到很多工程、实验的成败呢!咱可不能小瞧了它。
大家都要好好记住这些要点,在实际操作中千万别马虎呀!。
简易法仅供地方道路或工程量不大的工程采用。
标准法,石灰有效氧化钙含量分析天平0.0001g精度,滴定管50ml0.1ml精度,干燥箱,电炉,干燥器,三角瓶,研钵,表面皿,玻璃珠,漏斗,棕色广口瓶,托架天平0。
1g,大肚移液管,玻璃棒,洗耳球,试剂勺.试剂蔗糖,酚酞指试剂,0.1%甲基橙水溶液,0.5N盐酸标准溶液,碳酸钠。
称取0。
800—1。
000g在180℃烘干2h的碳酸钠,置于250ml三角瓶加100ml水完全溶解,加2-3滴甲基橙指示剂,用盐酸标准溶液滴定至黄色变为橙红色。
当量浓度N=Q/(V*0.053)NN为盐酸当量,Q为碳酸钠质量,V滴定消耗盐酸体积ml。
0.5g准确至0。
0005g,放入干燥具塞三角瓶,取5g蔗糖,投入15粒玻璃珠,迅速加入新煮沸并冷却的蒸馏水50ml,震荡15min,用水冲洗瓶颈及瓶塞,加入2—3滴酚酞指示剂,以0。
5N盐酸滴定,每秒2-3滴为宜,至粉红色消失,30s不复现.有效氧化钙百分含量Xi=(0。
028*V*N/G)*1000.028氧化钙毫克当量,V消耗盐酸体积,N盐酸当量浓度,G试样质量.对同一石灰样品至少应做两次测定,平均值代表最终结果。
结果在30%之内时平行误差0.40%,30%—50%时平行误差0.50%,大于50%时平行误差0.60%。
标准法,石灰有效氧化镁含量试剂:盐酸,氢氧化铵,氯化铵,酸性铬蓝K,萘酚绿B,硝酸钾,EDTA二钠标,碳酸钙,氢氧化钠,钙试剂羟酸钠,硫酸钾,酒石酸钾钠,三乙醇胺。
1:10盐酸将1体积盐酸密度1。
19,以10体积蒸馏水稀释。
氢氧化铵—氯化铵缓冲剂:67。
5g氯化铵溶于300ml无二氧化碳蒸馏水加浓氨水(0.90)570ml,用水稀释至1000ml。
酸性铬蓝K-萘酚绿B(1:2)混合指示剂:称取0.3g酸性铬蓝K 和0。
75g萘酚绿B与50g已在105℃烘干的硝酸银混合研细,并保存于棕色广口瓶。
EDTA二钠标准溶液:10gEDTA二钠溶于温热蒸馏水,稀释至1000ml。
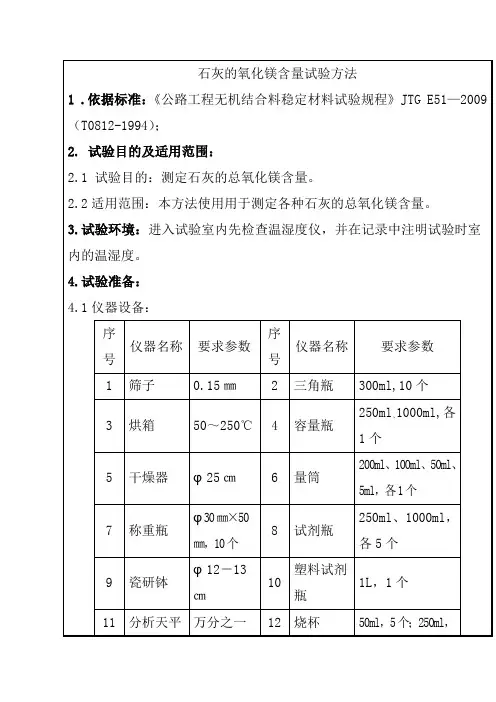
石灰氧化镁测定方法
1适用范围
本方法适用于测定各种石灰的总氧化镁含量。
2 仪器设备
(1)方孔筛:0.15mm,1个。
(2)烘箱:50~250℃,1台。
(3 )干燥器:25cm,1个。
(4)称量瓶:?30mm ×50mm,10个。
(5)瓷研钵:12~13cm,1??个。
(6)分析天平:量程不小于50g,感量0.0001g,1台。
(7)天子天平:量程不小于500g,感量0.01g,1台。
(8)电炉:1500W,1个。
(9)石棉网:20cm×20cm,1块。
(10)玻璃珠:3mm,1袋?(0.25kg)。
(11 )具塞三角瓶:250mL,20个。
(12)漏斗:短颈,3个。
(13)塑料洗瓶:1个。
(14)塑料桶:20L,1个。
(15)下口蒸馏水瓶:5000mL,1个。
(16)三角瓶:300mL,10个。
(17)
容量瓶:250mL、1000mL,各1个。
(18)量筒:200mL、100mL、50mL、5mL,各1个。
(19)试剂瓶:250mL、1000mL,各5个。
(20)塑料试剂瓶:1L,1个。
(21)烧杯:50mL,5个;250mL(或300mL),10个。
(22)棕色广口瓶:60mL,4个;250mL,5个。
(23)滴瓶:60mL,3个。
(24)酸1各:滴定台及滴定管夹)25。
(支2,50mL:滴定管.
套。
(26)大肚移液管:25mL、50mL,各1支。
(27)表面皿:7cm,10块。
(28)玻璃棒:8mm×250mm及4mm×180mm,各10支。
(29)试剂勺:5个。
(30)吸水管:8mm×150mm,5支。
(31)洗耳球:大、小各1个。
3 试剂
(1)1﹕10盐酸:将1体积盐酸(相对密度1.19)以10体积蒸馏水稀释。
(2)氢氧化铵—氯化铵缓冲溶液:将67.5g 氯化铵溶于300mL无二氧
相对密度为)((氨水化碳蒸馏水中,加浓氢氧化铵K)酸性铬兰然后用水稀释至1000mL。
(30.90)570mL,和K称取0.3g酸性铬兰﹕(12.5)混合指示剂:萘酚绿—B,℃烘干的硝酸钾混合研细105萘酚绿B与50g已在0.75g将:准标溶液钠EDTA4。
瓶色于保存棕广口中()二待全部溶解并冷却,蒸馏水中℃40~50二钠溶于10gEDTA.
:)氧化钙标准溶液1000mL。
(5至室温后,用水稀释至优
级的碳酸钙((2h)精确称取1.7848g在105℃烘干1从杯嘴缓慢滴加盖上表面皿烧杯中,,纯),置于250mL入移却后,解,待溶液冷﹕10盐酸100mL,加热溶用新煮沸冷却后的蒸馏水稀释至刻度,1000mL的容量瓶中2+2+Ca1mg氧化钙的摇匀。
此溶液每毫升的Ca含量相当于氢氧化钠溶于20g:将。
(6)20%的氢氧化钠溶液含量。
80mL蒸馏水中烘℃已在105将0.2g钙试剂羧酸钠和20g(7)钙指示剂:酒)10%,保存于棕色广口瓶中。
(8干的硫酸钾混合研细蒸馏水中。
将10g酒石酸钾钠溶于90mL石酸钾钠溶液:体积体积三乙醇胺以2:将1三乙醇胺(1﹕2)溶液(9)。
蒸馏水稀释摇匀二钠标准溶液与氧化钙和氧化镁关系的标定4 EDTA精确吸取)(1三角300mLmL氧化钙标准溶液放于
50V?1然后加入钙指示剂约,100mL左右瓶中,用水稀释至,20%以氢氧化钠溶液调整溶液碱度到出现酒红色0.2g,至溶
液二钠标准溶液滴定,3~4mL,然后以EDTA再过量加二钠标准溶液体积记录EDTA由酒红色变成纯蓝色时为止,T ()EDTA二钠标准溶液对氧化钙的滴定度按式。
(2V2。
)计算0812-1 )0812-1T (VCVT?21CaO.式中:——EDTA二钠标准溶液对氧化钙的滴定度,即
T CaO1mLEDTA二钠标准溶液相当于氧化钙的毫克数;
——1mL氧化钙标准溶液含有氧化钙的毫克数,C
等于1;
mL);——吸取氧化钙标准溶液的体积(V1)。
二钠标准溶液的体积(mL——消耗EDTA V2(二钠标准溶液对氧化镁的滴定度EDTA3()),T MgO按式,1mLEDTA二钠标准溶液相当于氧化镁的毫克数即计算。
T 0812-2()40.31 0812-2)(T T??TT?0.72CaOMgOCaO56.08准备试样5
使颗粒不大于,:将生石灰样品打碎)(1生石灰试样放入瓷,拌和均匀后用四分法缩减至。
200g左右1.18mm研磨所得石灰样。
左右20g再经四分法缩减至。
研钵中研细.
品,通过0.15mm(方孔筛)的筛。
从此细样中均匀挑取10余克,置于称量瓶中在105℃烘箱内烘至衡量,储于干燥器中,供试验用。
(2)消石灰试样:将消石灰样品用四分法缩减至10余克。
如有大颗粒存在,须在瓷研钵中磨细至无不均匀颗粒存在为止。
置于称量瓶中在105℃烘箱内烘至衡量,储于干燥器中,供试验用。
6 试验步骤
(1)称取约0.5g(精确至0.0001g)石灰试样,并记录试样质量,放入250mL烧杯中,用水湿润,加1﹕10盐m酸30mL,用表面皿盖住烧杯,加热至微沸,并保持微沸
8~10min。
(2)用水把表面皿洗净,冷却后把烧杯内的沉淀及溶液移入250mL容量瓶中,加水至刻度摇匀。
(3)待溶液沉淀后,用移液管吸取25mL溶液,放入250mL三角瓶中,加50mL 水稀释后,加酒石酸钾钠溶液1mL、三乙醇胺溶液5mL,再加入铵—铵缓冲溶液10mL(此时待测溶液的pH=10)、酸性铬兰K—萘酚绿B指示剂约0.1g。
记录滴定管中初始EDTA 二钠标准溶液体积,用EDTA二钠标准溶液V5滴定,至溶液由酒红色变为纯蓝色时即为终点,
的差值、EDTA二钠标准溶液的体积。
记录滴定管中VVV656)4
二钠标准溶液的消耗量。
(即为滴定钙镁合量的EDTA V3置于溶液,,)的容量瓶中用移液管吸取25mL再从(2加三乙醇胺溶液稀释后,三角瓶中,加水150mL300mL≥pH5mL(此时待测溶液的20%5mL及氢氧化钠溶液二钠EDTA。
记录滴定管中初始),12放入约0.2g钙指示剂至溶液由酒二钠标准溶液滴定,标准溶液体积,用EDTA V7二钠标准溶液EDTA红色变为蓝色即为终点,记录滴定管中二钠标准EDTA、。
的体积的差值即为滴定钙离子的VVV878。
溶液的消耗量V4。