九年级化学表示物质组成的化学式
- 格式:pdf
- 大小:1.22 MB
- 文档页数:10

九年级上册化学式 化学式是⽤元素符号表⽰纯净物组成及原⼦个数的式⼦。
分⼦晶体的化学式叫做分⼦式,可以表⽰这种物质的分⼦构成。
以下是九年级上册化学式,欢迎阅读。
1.元素符号: H He C N O F Ne Na Mg Al Si P S Cl 氢氦碳氮氧氟氖钠镁铝硅磷硫氯 Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I 氩钾钙锰铁铜锌银钡铂⾦汞碘 2.常见离⼦和化合物中元素的化合价: H+ Na+K+ Ag+ NH4++1价氢离⼦钠离⼦钾离⼦银离⼦铵根离⼦ Ca2+ Mg2+ Cu2+Ba2+Zn2+Fe2+ +2价钙离⼦镁离⼦铜离⼦钡离⼦锌离⼦亚铁离⼦ Fe3+ Al3+ +3价铁离⼦铝离⼦ Cl-OH- NO3--1价氯离⼦氢氧根离⼦硝酸根离⼦ O2-SO42-CO32- -2价氧离⼦硫酸根离⼦碳酸根离⼦ 3.常见物质的化学式与名称:单质: C:碳S:硫P:磷 Fe:铁 Mg:镁 Al:铝Hg:汞 Zn:锌 Cu:铜 Ag:银 O2:氧⽓ H2:氧⽓ N2:氮⽓ O3:臭氧氧化物: CO:⼀氧化碳 CO2:⼆氧化碳 SO2:⼆氧化硫MnO2:⼆氧化锰SO3:三氧化硫 H2O2:过氧化氢 CuO:氧化铜 CaO:氧化钙 MgO:氧化镁HgOFe2O3:氧化铁Al2O3:氧化铝 H2O:⽔ P2O5:五氧化⼆磷 Fe3O4:四氧化三铁酸: HCl:盐酸H2SO4:硫酸HNO3:硝酸H2CO3:碳酸 H2S亚硫酸CH3COOH:醋酸碱: NaOH:氢氧化钠 Ca(OH)2:氢氧化钙 KOH:氢氧化钾Mg(OH)2:氢氧化镁 Cu(OH)2:氢氧化铜 NH3 .H2O氨⽔Fe(OH)3:氢氧化铁Al(OH)3:氢氧化铁盐酸盐: KCl:氯化钾 NaCl:氯化钠 KCl:氯化钾AgCl:氯化银 CuCl2:氯化铜CaCl2:氯化钙MgCl2:氯化镁 ZnCl2:氯化锌BaCl2:氯化钡FeCl2:氯化亚铁AlCl3:氯化铝 FeCl3:氯化铁碳酸盐: CaCO3:碳酸钙 Na2CO3:碳酸钠 NaHCO3:碳酸氢钠 BaCO3:碳酸钡 K2CO3:碳酸钾NH4HCO3:碳酸氢铵硫酸盐: Na2SO4:硫酸钠 ZnSO4:硫酸锌MgSO4:硫酸镁 CaSO4:硫酸钙 CuSO4:硫酸铜 BaSO4:硫酸钡 FeSO4:硫酸亚铁Fe2(SO4)3:硫酸铁Al2(SO4)3:硫酸铝 (NH4)2SO4:硫酸铵 Na2SO3:亚硫酸钠硝酸盐: AgNO3:硝酸银 NaNO3:硝酸钠 Cu(NO3)2:硝酸铜 KNO3:硝酸钾NH4NO3:硝酸铵 NaNO2:亚硝酸钠钾盐: KMnO4:⾼锰酸钾K2MnO4:锰酸钾 KClO3:氯酸钾有机化合物: C2H5OH:⼄醇C6H12O6:葡萄糖 CH4:甲烷 九年级化学⽅程式分类: 1.碳充分燃烧: C+O2 2.碳不充分燃烧:2C+O 3.⼀氧化碳燃烧:2CO+O2 4.产⽣⼀氧化碳:C+CO 5.硫燃烧:S+O2 6.红磷燃烧: 4P+5O2O5 7.氢⽓燃烧: 2H2+O2点燃2O 8.铁燃烧:3Fe+2O3O4 9.镁燃烧:2Mg+O 10.铝燃烧: 4Al+3O2O3 11.甲烷燃烧:CH4+2O2+2H2O 12.酒精燃烧:C2H5OH+3O2点燃2+3H2O 13.呼吸原理:C6H12O6+6O26CO2+6H2O 14.⾼锰酸钾制氧⽓: 2KMnO2MnO4+MnO2+O2↑ 15.氯酸钾制氧⽓: 2KClO3MnO2KCl+3O2↑△ 16.过氧化氢制氧⽓: 2H2O2 MnO2 2O +O2↑ 17.⽔通电分解: 2H2O2H2↑+O2↑ 19.实验室制氢⽓的原理:Zn+H2SO4=ZnSO4+H2↑ 20.镁或硫酸性质:Mg+H2SO4=MgSO4+H2↑ 21.铁或硫酸性质:Fe+H2SO4=FeSO4+H2↑ 22.铝或硫酸性质:2Al+3H2SO4=Al2(SO4)3+H2↑ 23.镁或盐酸性质:Mg+2HCl=MgCl2+H2↑ 24.锌或盐酸性质:Zn+2HCl=ZnCl2+H2↑ 25.铁或盐酸性质:Fe+2HCl=FeCl2+H2↑ 26.铝或盐酸性质:2Al+6HCl=2AlCl3+3H2↑ 27.酸或碱的性质:NaOH+HCl=NaCl+H2O 28.酸或碱的性质:Ca(OH)2+2HCl=CaCl2+H2O 29.酸或碱的性质:2NaOH+H2SO4=Na2SO4+2H2O 30.酸或碱的性质:Ca(OH)2+H2SO4=CaSO4+2H2O 31.制取CO2或CaCO3 作补钙药剂:CaCO3+2HCl=CaCl2+CO2↑+H2O 32.碳酸盐或酸的性质:Na2CO3+2HCl=2NaCl+CO2↑+H2O 33.治疗胃酸过多症的原理:NaHCO3 +HCl=NaCl+CO2↑+H2O 34.氯化钠与硝酸银反应产⽣⽩⾊沉淀:NaCl+AgNO3=NaNO3+AgCl↓ 35.制取氢氧化钠的原理:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 36.氢氧化钠与硫酸铜反应产⽣蓝⾊沉淀:2NaOH+CuSO4=Na2SO4+Cu(OH)2 37.制取⽔煤⽓的'原理:C+H2O2+CO 38.氢⽓还原氧化铜:H2+2O 39.碳还原氧化铜:C+2CuO2↑ 40.⼀氧化碳还原氧化铜:2 41.氢⽓还原氧化铁:Fe2O3+3H2O 42.碳还原氧化铁:2Fe2O3+3C2↑ 43.⼯业炼铁的原理:Fe2O3+3CO2 44.铁置换硫酸铜中的铜:Fe+CuSO4=Cu+FeSO4 45.铜置换硝酸银中的银:Cu+2AgNO3=2Ag+Cu(NO3)2 46.铝置换硫酸铜中的铜:2Al+3CuSO4=3Cu+Al2(SO4)3 47.⽣⽯灰制熟⽯灰:H2O+CaO=Ca(OH)2 48.碳酸不稳定:H2CO3=H2O+CO2↑ 49.⼯业制⽣⽯灰的原理:CaCO2↑ 50.检验CO2或澄清⽯灰⽔变浑浊原理:CO2+Ca(OH)2=CaCO3↓+H2O 51.烧碱变质的原理:CO2+2NaOH=Na2CO3+H2O 52.碱与⾮⾦属氧化物的性质: SO2+2NaOH=Na2SO3+H2O SO3+2NaOH=Na2SO4+H2O 53.⾮⾦属氧化物的性质: H2O+CO2 =H2CO3 H2O+SO2 =H2SO3 H2O+SO3 =H2SO4 54.除铁锈的原理或⾦属氧化物与酸的性质:Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 【九年级上册化学式】。



化学式大全初三化学化学式大全化学式是描述化合物化学组成的一种化学标记方法,是化学反应和计算化学物质的重要工具。
初三化学学习中,我们常常需要掌握常见化合物的化学式,下面介绍一些基础的化学式大全。
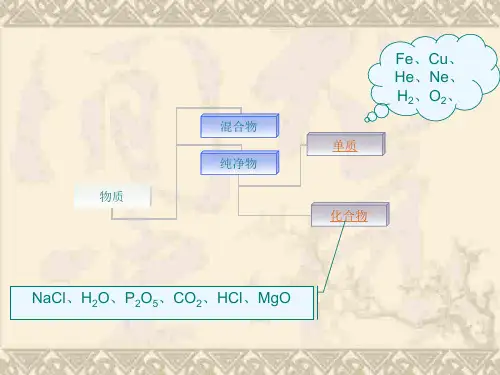
一、单质的化学式单质是只含有一种原子的物质,常见的单质有氧气(O2)、氮气(N2)、碳(C)、氢气(H2)、氦气(He)等。
二、水的化学式水是最常见最重要的化合物之一,其化学式为H2O,其中“H”表示氢原子,“O”表示氧原子。
水是由两个氢原子和一个氧原子通过共价键相连而形成的。
三、酸的化学式酸是指在水溶液中能放出氢离子(H+)的化合物,常见的酸有硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)、亚硝酸(HNO2)等。
其中,硫酸化学式为H2SO4,盐酸化学式为HCl,硝酸化学式为HNO3,亚硝酸化学式为HNO2。
四、碱的化学式碱是指在水溶液中能放出羟根离子(OH-)的化合物,常见的碱有氢氧化钠(NaOH)、氢氧化钾(KOH)、氨(NH3)等。
其中,氢氧化钠化学式为NaOH,氢氧化钾化学式为KOH,氨化学式为NH3。
五、盐的化学式盐是指由阳离子和阴离子通过离子键相连合而成的化合物,常见的盐有氯化钠(NaCl)、硫酸铜(CuSO4)、碘化铅(PbI2)、碳酸钙(CaCO3)等。
其中,氯化钠化学式为NaCl,硫酸铜化学式为CuSO4,碘化铅化学式为PbI2,碳酸钙化学式为CaCO3。
六、二元化合物的化学式在化学式中只包含两种元素的化合物称为二元化合物。
常见的二元化合物有硫化氢(H2S)、氯化氢(HCl)、氧化亚氮(NO)、氧化氮(N2O)等。
其中,硫化氢化学式为H2S,氯化氢化学式为HCl,氧化亚氮化学式为NO,氧化氮化学式为N2O。
七、水合物的化学式水合物是指在化合物分子中含有一定数量的结晶水的化合物。
常见的水合物有硫酸铜(II)五水合物(CuSO4·5H2O)、硫酸铜(II)七水合物(CuSO4·7H2O)、氯化铜二水合物(CuCl2·2H2O)等。
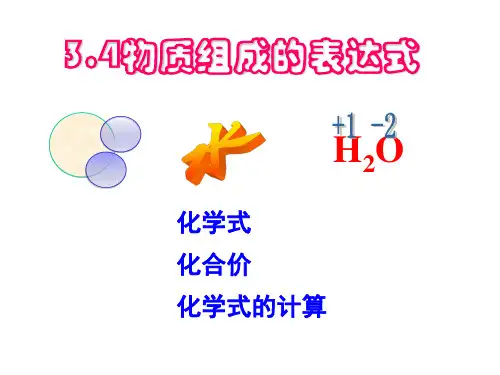




化学式的写法和意义•概念:用元素符号和数字的组合表示物质组成的式子,叫做化学式。
如可用O2,H2O,MgO分别表示氧气、水、氧化镁的化学式。
对概念的理解:(1)混合物不能用化学式表示,只有纯净物才能用化学式表示。
(2)每一种纯净物只有一个化学式,但一个化学式有可能用来表示不同的物质。
如氧气的化学式是O2,没有别的式子再能表示氧气;P既是红磷的化学式,也是白磷的化学式。
(3)纯净物的化学式不能臆造,化学式可通过以下途径确定:①科学家通过进行精确的定量实验,测定纯净物中各元素的质量比,再经计算得出。
②已经确定存在的物质可根据化合价写出。
书写规则:1.单质化学式的写法:首先写出组成单质的元素符号,再在元素符号右下角用数字写出构成一个单质分子的原子个数。
稀有气体是由原子直接构成的,通常就用元素符号来表示它们的化学式。
金属单质和固态非金属单质的结构比较复杂,习惯上也用元素符号来表示它们的化学式。
2.化合物化学式的写法:首先按正前负后的顺序写出组成化合物的所有元素符号,然后在每种元素符号的右下角用数字写出每个化合物分子中该元素的原子个数。
一定顺序通常是指:氧元素与另一元素组成的化合物,一般要把氧元素符号写在右边;氢元素与另一元素组成的化合物,一般要把氢元素符号写在左边;金属元素、氢元素与非金属元素组成的化合物,一般要把非金属元素符号写在右边。
直接由离子构成的化合物,其化学式常用其离子最简单整数比表示。
化学式的读法:一般是从右向左叫做“某化某”,如“CuO”叫氧化铜。
当一个分子中原子个数不止一个时,还要指出一个分子里元素的原子个数,如“P2O5”叫五氧化二磷。
有带酸的原子团要读成“某酸某”如“CuSO4”叫硫酸铜,还有的要读“氢氧化某”,如“NaOH”叫氢氧化钠。
“氢氧化某”是碱类物质,电离出来的负电荷只有氢氧根离子。
•化学式的意义:(1)由分子构成的物质100%=11.1%•(2)由原子构成的物质(以Cu为例)宏观:表示该物质:铜表示该物质由什么元素组成:铜由铜元素组成微观:表示该物质的一个原子—一个铜原子。