九年级化学常见化学式人教版
- 格式:docx
- 大小:226.11 KB
- 文档页数:3
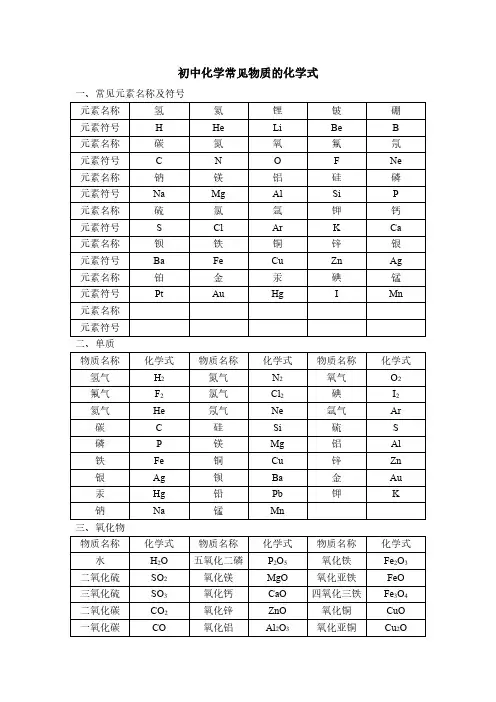
初中化学常见物质的化学式一、常见元素名称及符号元素名称氢氦锂铍硼元素符号H He Li Be B元素名称碳氮氧氟氖元素符号C N O F Ne 元素名称钠镁铝硅磷元素符号Na Mg Al Si P元素名称硫氯氩钾钙元素符号S Cl Ar K Ca 元素名称钡铁铜锌银元素符号Ba Fe Cu Zn Ag 元素名称铂金汞碘锰元素符号Pt Au Hg I Mn 元素名称元素符号二、单质物质名称化学式物质名称化学式物质名称化学式氢气H2氮气N2氧气O2氟气F2氯气Cl2碘I2氦气He氖气Ne氩气Ar 碳C硅Si硫S 磷P镁Mg铝Al 铁Fe铜Cu锌Zn 银Ag钡Ba金Au 汞Hg铅Pb钾K 钠Na锰Mn三、氧化物物质名称化学式物质名称化学式物质名称化学式水H2O五氧化二磷P2O5氧化铁Fe2O3二氧化硫SO2氧化镁MgO氧化亚铁FeO 三氧化硫SO3氧化钙CaO四氧化三铁Fe3O4二氧化碳CO2氧化锌ZnO氧化铜CuO 一氧化碳CO氧化铝Al2O3氧化亚铜Cu2O四、酸物质名称化学式物质名称化学式物质名称化学式盐酸HCl硫酸H2SO4碳酸H2CO3硝酸HNO3磷酸H3PO4五、碱物质名称化学式物质名称化学式物质名称化学式氢氧化钠NaOH氢氧化镁Mg(OH)2氢氧化铜Cu(OH)2氢氧化钾KOH氢氧化铝Al(OH)3氨水NH3·H2O 氢氧化钙Ca(OH)2氢氧化铁Fe(OH)3氢氧化钡Ba(OH)2氢氧化亚铁Fe(OH)2六、盐物质名称化学式物质名称化学式物质名称化学式硝酸钾KNO3氯化钾KCl硫酸钾K2SO4硝酸钠NaNO3氯化钠NaCl硫酸钠Na2SO4硝酸钡Ba(NO3)2氯化钡BaCl2硫酸钡BaSO4硝酸钙Ca(NO3)2氯化钙CaCl2硫酸钙CaSO4硝酸镁Mg(NO3)2氯化镁MgCl2硫酸镁MgSO4硝酸铝Al(NO3)3氯化铝AlCl3硫酸铝Al2(SO4)3硝酸锌Zn(NO3)2氯化锌ZnCl2硫酸锌ZnSO4硝酸铁Fe(NO3)3氯化铁FeCl3硫酸铁Fe2(SO4)3硝酸亚铁Fe(NO3)2氯化亚铁FeCl2硫酸亚铁FeSO4硝酸铜Cu(NO3)2氯化铜CuCl2硫酸铜CuSO4硝酸银AgNO3氯化银AgCl硫酸银Ag2SO4硝酸铵NH4NO3氯化铵NH4Cl硫酸铵(NH4)2SO4碳酸钾K2CO3碳酸钠Na2CO3碳酸钡BaCO3碳酸钙CaCO3碳酸镁MgCO3碳酸锌ZnCO3碳酸亚铁FeCO3碳酸银Ag2CO3碳酸铵(NH4)2CO3碳酸氢钠NaHCO3硫酸氢钠NaHSO4碳酸氢钙Ca(HCO3)2高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3。
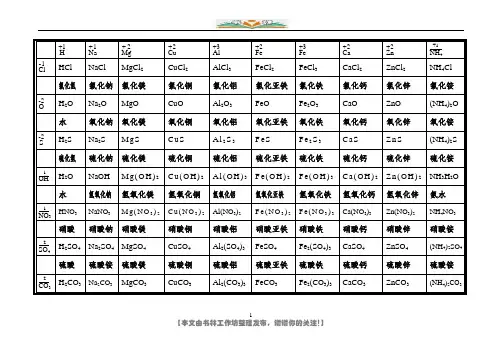
1H +1Na +1Mg +2Cu +2Al +3Fe +2Fe +3Ca +2Zn +2+1NH 4Cl -1HCl NaCl MgCl 2 CuCl 2 AlCl 3 FeCl 2 FeCl 3 CaCl 2 ZnCl 2 NH 4Cl氯化氢 氯化钠 氯化镁 氯化铜 氯化铝 氯化亚铁 氯化铁 氯化钙 氯化锌 氯化铵 O -2H 2O Na 2OMgOCuO Al 2O 3 FeO Fe 2O 3 CaO ZnO (NH 4)2O水 氧化钠 氧化镁 氧化铜 氧化铝 氧化亚铁 氧化铁 氧化钙 氧化锌 氧化铵 S -2H 2S Na 2SM gSC uS A l 2S 3 F e S F e 2S 3 C aS Zn S (NH 4)2S硫化氢 硫化钠 硫化镁 硫化铜硫化铝硫化亚铁硫化铁硫化钙硫化锌硫化铵-1OHH 2O NaOH M g(O H )2 C u (O H )2 A l (OH )3 F e (O H )2 F e (O H )3 C a (OH )2 Zn (O H )2 NH 3H 2O水氢氧化钠氢氧化镁氢氧化铜氢氧化铝氢氧化亚铁氢氧化铁氢氧化钙氢氧化锌氨水-1NO 3 HNO 3NaNO 3M g(N O 3)2 C u (N O 3)2 Al(NO 3)2 F e (N O 3)2 F e (N O 3)3 Ca(NO 3)3Zn(NO 3)2NH 4NO 3硝酸 硝酸钠 硝酸镁 硝酸铜 硝酸铝 硝酸亚铁 硝酸铁 硝酸钙 硝酸锌 硝酸铵-2SO 4 H 2SO 4 Na 2SO 4 MgSO 4CuSO 4 Al 2(SO 4)3 FeSO 4 Fe 2(SO 4)3 CaSO 4 ZnSO 4 (NH 4)2SO 4硫酸 硫酸铵 硫酸镁 硫酸铜 硫酸铝硫酸亚铁硫酸铁 硫酸钙 硫酸锌 硫酸铵-2CO 3 H 2CO 3 Na 2CO 3 MgCO 3CuCO 3Al 2(CO 3)3 FeCO 3Fe 2(CO 3)3CaCO 3ZnCO 3(NH 4)2CO 32碳酸碳酸钠 碳酸镁碳酸铜碳酸铝碳酸亚铁碳酸铁碳酸钙碳酸锌碳酸铵H +1Na +1Mg +2Cu +2Al +3Fe +2Fe +3Ca +2Zn +2+1NH 4Cl -1氯化氢 氯化钠 氯化镁 氯化铜 氯化铝 氯化亚铁 氯化铁 氯化钙 氯化锌 氯化铵 O -2水 氧化钠 氧化镁 氧化铜 氧化铝 氧化亚铁 氧化铁 氧化钙 氧化锌 氧化铵 S -2硫化氢 硫化钠 硫化镁 硫化铜 硫化铝 硫化亚铁 硫化铁 硫化钙 硫化锌 硫化铵 -1OH水氢氧化钠氢氧化镁氢氧化铜氢氧化铝氢氧化亚铁氢氧化铁氢氧化钙氢氧化锌氨水-1NO 3硝酸 硝酸钠 硝酸镁 硝酸铜 硝酸铝 硝酸亚铁 硝酸铁 硝酸钙 硝酸锌 硝酸铵-2SO 4硫酸 硫酸铵 硫酸镁 硫酸铜硫酸铝硫酸亚铁硫酸铁硫酸钙硫酸锌硫酸铵3-2CO 3碳酸碳酸钠 碳酸镁碳酸铜碳酸铝碳酸亚铁碳酸铁碳酸钙碳酸锌碳酸铵H +1Na +1Mg +2Cu +2Al +3Fe +2Fe +3Ca +2Zn +2+1NH 4Cl -1HCl NaCl MgCl 2 CuCl 2 AlCl 3 FeCl 2 FeCl 3 CaCl 2 ZnCl 2 NH 4ClO -2H 2O Na 2O MgO CuO Al 2O 3 FeO Fe 2O 3 CaO ZnO (NH 4)2OS -2H 2S Na 2S M gS C uS A l 2S 3 F e S F e 2S 3 C aS Zn S (NH 4)2S-1OHH 2O NaOH M g(O H )2 C u (O H )2 A l (OH )3 F e (O H )2 F e (O H )3 C a (OH )2 Zn (O H )2 NH 3H 2O-1NO 3 HNO 3NaNO 3M g(N O 3)2 C u (N O 3)2 Al(NO 3)2 F e (N O 3)2 F e (N O 3)3 Ca(NO 3)3Zn(NO 3)2NH 4NO 3-2SO 4 H 2SO 4 Na 2SO 4 MgSO 4CuSO 4Al 2(SO 4)3FeSO 4Fe 2(SO 4)3CaSO 4ZnSO 4(NH 4)2SO 4-2H2CO3Na2CO3MgCO3CuCO3Al2(CO3)3FeCO3Fe2(CO3)3CaCO3ZnCO3(NH4)2CO3 CO34。

班级 九 化学式 姓名1化学常用物质化学式归纳一、单质:由一种元素组成。
1、金 属:Fe (铁) Cu (铜) Al (铝) Na (钠) K (钾) Mg (镁) Zn (锌) Ag (银) Au (金) Ca (钙)2、非金属固体:S (硫) P (磷) C (碳) Si (硅)3、非金属气体:O 2(氧气) O 3(臭氧) N 2(氮气) H 2(氢气) Cl 2(氯气)二、化合物:由两种或两种以上元素组成的。
(氧化物/一般化合物)1、氧化物:由两种元素组成,其中一种是氧元素。
H 2O (水) H 2O 2(过氧化氢/双氧水) CO (一氧化碳) CO 2(二氧化碳) SO 2(二氧化硫) P 2O 5(五氧化二磷) CaO (氧化钙) MgO (氧化镁) Fe 3O 4(四氧化三铁)Fe 2O 3(三氧化二铁/氧化铁/赤铁矿) FeO (氧化亚铁) MnO 2(二氧化锰) CuO (氧化铜) HgO (氧化汞) Al 2O 3(三氧化二铝/氧化铝)2、一般化合物:KMnO 4(高锰酸钾) K 2MnO 4(锰酸钾) KClO 3(氯酸钾) KCl (氯化钾) CaCl 2 (氯化钙) CuCl 2 (氯化铜) NaOH (氢氧化钠) Ca(OH)2(氢氧化钙/熟石灰/澄清石灰水主要成分) Na 2CO 3(碳酸钠) CaCO 3(碳酸钙/石灰石和大理石的主要成分) NaHCO 3(碳酸氢钠)CuSO 4(硫酸铜) ZnSO 4(硫酸锌) FeSO 4(硫酸亚铁)Fe 2(SO)3(硫酸铁) Na 2SO 4(硫酸钠) Cu(OH)2(氢氧化铜) C 2H 5OH (酒精/乙醇) CH 4(甲烷/天然气和沼气的主要成分) C 2H 5OH (酒精/乙醇) CH 3COOH (醋酸) H 2SO 4 (硫酸) H 2CO 3(碳酸) HNO 3 (硝酸) HCl (盐酸)Cu 2(OH)2CO 3(碱式碳酸铜/铜绿)注:Ca 2+(钙离子)Na +(钠离子)Cl -(氯离子)Fe 2+(亚铁离子)Fe 3+(铁离子)文字表达式2 点燃 点燃 点燃 点燃点燃 加热加热 二氧化锰二氧化锰通 电点燃点燃一、化合反应(2——6)(氧化反应1——6):1、石蜡+氧气 二氧化碳+水(放出热量,生成CO 2和HO 2)[氧化反应]2、红磷+氧气 五氧化二磷(冒出大量白烟,放出热量,生成白色固体P 2O 5)3、硫+氧气 二氧化硫(在空气中的现象,和在氧气中的现象不同。

九年级必背化学式化学是一门研究物质组成、结构、性质以及变化的科学。
在九年级的学习中,我们需要掌握一些重要的化学式,这些化学式对于我们理解化学原理和应用具有重要意义。
下面是九年级必背的一些化学式。
一、离子式离子式描述了化合物中的离子种类和数量。
其中,阳离子带正电荷,阴离子带负电荷。
离子式的书写原则是:阳离子写在前面,阴离子写在后面。
例如,氯化钠的离子式为NaCl,其中Na+为钠离子,Cl-为氯离子。
氯化钠是一种常见的食盐。
二、分子式分子式描述了化合物中原子的种类和数量。
分子式的书写原则是:先写元素符号,再写下标。
例如,水的分子式为H2O,其中H表示氢原子,O表示氧原子。
水是生命中不可或缺的物质。
三、化学反应式化学反应式描述了化学反应中反应物和生成物的种类和数量。
化学反应式的书写原则是:反应物写在箭头的左边,生成物写在箭头的右边。
例如,氧化铁的化学反应式为4Fe + 3O2 → 2Fe2O3,其中4Fe表示4个铁原子,3O2表示3个氧分子,2Fe2O3表示2个氧化铁分子。
四、摩尔质量摩尔质量是物质一摩尔的质量,单位是克/摩尔。
可以通过元素的相对原子质量计算出化合物的摩尔质量。
例如,氧化铁Fe2O3的摩尔质量可以通过计算得到:2×55.85 + 3×16 = 159.7 g/mol。
五、摩尔比摩尔比是化学反应中反应物和生成物的摩尔数量之间的比例关系。
可以通过化学反应式中的系数来确定摩尔比。
例如,对于反应式4Fe + 3O2 → 2Fe2O3,摩尔比为4:3:2,即 4 mol的铁反应产生3 mol的氧气,生成2 mol的氧化铁。
以上是九年级必背的一些化学式,这些化学式对于我们理解化学原理和应用非常重要。
通过掌握这些化学式,我们可以更好地理解化学现象和实验结果,为将来的学习和研究打下坚实的基础。
希望大家能够努力记忆和理解这些化学式,探索化学的奥秘,为人类的进步做出贡献。

人教版初三化学需要背诵的化学式一、介绍化学式是化学元素或化合物的符号表示法,是化学中的基本概念之一。
在初中化学学习中,掌握化学式是非常重要的,不仅是理论学习的基础,也是实验操作的必备知识。
人教版初三化学需要背诵的化学式,涉及到元素的符号、化合物的组成以及化学反应等内容。
二、常见元素的化学式1. 氢:H2. 氦:He3. 铍:Be4. 碳:C5. 氮:N6. 氧:O7. 氟:F8. 钠:Na9. 镁:Mg10. 铝:Al11. 锌:Zn12. 铁:Fe13. 铜:Cu三、常见化合物的化学式1. 氨气:NH32. 氯化钠:NaCl3. 氧化铜:Cu2O4. 二氧化碳:CO25. 一氧化碳:CO6. 亚硝酸盐:NO2-7. 硫酸:H2SO48. 碳酸钠:Na2CO39. 铝矾:Al2(SO4)310. 硫化氢:H2S11. 过氧化氢:H2O212. 白砷:As2O3四、化学反应中的化学式1. 直接组成反应:例如氢气与氧气的反应生成水,化学式为2H2 + O2 → 2H2O2. 分解反应:例如过氧化氢分解成水和氧气,化学式为2H2O2 → 2H2O + O23. 单一置换反应:例如锌与盐酸生成氢气和氯化锌,化学式为Zn + 2HCl → ZnCl2 + H24. 双置换反应:例如氯化钠与硫酸反应生成盐酸和硫酸钠,化学式为NaCl + H2SO4 → HCl + Na2SO45. 酸碱中和反应:例如氢氧化钠与硫酸反应生成水和硫酸钠,化学式为2NaOH + H2SO4 → 2H2O + Na2SO4五、总结人教版初三化学需要背诵的化学式,包括常见元素的化学式、常见化合物的化学式以及化学反应中的化学式。
通过背诵这些化学式,可以帮助学生牢固掌握这些基本的化学知识,为进一步深入学习化学打下坚实的基础。
在日常的学习中,可以通过多种方式来背诵和巩固这些化学式,如制作化学式卡片、做化学式练习题等。
希望学生们能够重视化学式的背诵,从而在化学学习中取得更好的成绩。

九年级上册化学常见物质的化学式和名称九年级上册化学常见物质的化学式和名称化学是一门研究物质性质、组成和变化的科学。
在九年级的化学课程中,我们将学习许多常见物质的化学式和名称。
下面是一些常见物质和它们的化学式、名称以及一些相关性质的简要介绍。
1.水(H2O)水是人们日常生活中最常见的物质之一。
它的化学式是H2O,由两个氢原子和一个氧原子组成。
水是无色、无味、无臭的液体,是许多生物体所需的基本物质。
2.氧气(O2)氧气是空气中的主要成分之一。
它的化学式是O2,由两个氧原子组成。
氧气是无色、无味、无臭的气体,是许多生物体进行呼吸所需的重要物质。
3.二氧化碳(CO2)二氧化碳是一种常见的无机化合物。
它的化学式是CO2,由一个碳原子和两个氧原子组成。
二氧化碳是无色、无味的气体,在许多自然界中的过程中产生,比如动植物的呼吸和燃烧过程。
4.盐(NaCl)盐是一种常见的无机化合物,也是人们日常生活中常用的调味品。
它的化学式是NaCl,由一个钠离子和一个氯离子组成。
盐是白色晶体,可溶于水,常用于调味、腌制和防腐等用途。
5.铁(Fe)铁是一种常见的金属元素。
它的化学符号是Fe,原子序数为26。
铁是坚硬、有延展性和导电性的金属,广泛用于制造机械、建筑材料和电子设备等领域。
6.铜(Cu)铜也是一种常见的金属元素。
它的化学符号是Cu,原子序数为29。
铜是红褐色的金属,具有良好的导电性和导热性,常用于制造电线、管材和电子器件等。
7.铝(Al)铝是一种常见的轻质金属元素。
它的化学符号是Al,原子序数为13。
铝具有轻质、优良的导电性和导热性的特点,广泛用于制造飞机、汽车和建筑材料等。
8.纳(Na)纳是一种常见的金属元素。
它的化学符号是Na,原子序数为11。
纳是一种银白色的金属,具有很强的化学活性。
纳在化合物中常以正离子的形式存在,比如在盐中的钠离子。
9.氧(O)氧是一种常见的非金属元素。
它的化学符号是O,原子序数为8。
氧是无色、无味的气体,是许多燃烧和呼吸过程中必需的。

九年级化学全部化学方程式(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O43. 铜在空气中受热:2Cu + O2 =加热= 2CuO4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O35. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O57. 硫粉在空气中燃烧: S + O2 =点燃= SO28. 碳在氧气中充分燃烧:C + O2 =点燃= CO29. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO(2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 =点燃=CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO =加热= H g+ O2 ↑14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 (MnO2催化剂)=2H2O+ O2 ↑(实验室制氧气原理2)KClo3(二氧化锰加热)=KCl+O2二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O =通电= 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律: [/b]19.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO =加热= Cu + H2O22. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO四、碳和碳的氧化物碳的化学性质23. 碳在氧气中充分燃烧:C + O2 =点燃= CO224.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 =高温= 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 =点燃= CO227.煤炉的中层:CO2 + C =高温= 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3=高温= CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质: 34.一氧化碳还原氧化铜:CO+ CuO =加热= Cu + CO2 35.一氧化碳的可燃性:2CO + O2 =点燃= 2CO2其它反应: 36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用: 37.甲烷在空气中燃烧:CH4 + 2O2 =点燃= CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O六、金属1)金属与氧气反应: 40.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO 41.铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O442. 铜在空气中受热:2Cu + O2 =加热=2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理: 55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应) [/i][/b]60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4+2NaOH=Na2SO4+H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.酒精的燃烧:C2H5OH(酒精)+O2=CO2+H2O。

九年级化学全部化学方程式(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 =点燃= 2MgO2. 铁在氧气中燃烧:3Fe + 2O2=点燃= Fe3O43. 铜在空气中受热:2Cu + O2 =加热= 2CuO4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O35. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 =点燃= 2P2O57. 硫粉在空气中燃烧: S + O2 =点燃= SO28. 碳在氧气中充分燃烧:C + O2 =点燃= CO29. 碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO(2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 =点燃=CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO =加热= Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 (MnO2催化剂)=2H2O+ O2 ↑(实验室制氧气原理2)KClo3(二氧化锰加热)=KCl+O2二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O =通电= 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律: [/b]19.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO =加热= Cu + H2O22. 镁还原氧化铜:Mg + CuO =加热= Cu + MgO四、碳和碳的氧化物碳的化学性质23. 碳在氧气中充分燃烧:C + O2 =点燃= CO224.木炭还原氧化铜:C+ 2CuO =高温=2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 =高温= 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 =点燃= CO227.煤炉的中层:CO2 + C =高温= 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3=高温= CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO =加热= Cu + CO2 35.一氧化碳的可燃性:2CO + O2 =点燃= 2CO2其它反应: 36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2Na Cl + H2O + CO2↑五、燃料及其利用: 37.甲烷在空气中燃烧:CH4 + 2O2 =点燃= CO2 + 2H2O 38.酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O六、金属1)金属与氧气反应: 40.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO 41.铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O442. 铜在空气中受热:2Cu + O2 =加热=2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理: 55.3CO+ 2Fe2O3 高温4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应) [/i][/b]60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4+2NaOH=Na2SO4+H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.酒精的燃烧:C2H5OH(酒精)+O2=CO2+H2O。
化学式化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O2 2P2O52、氢气在空气中燃烧生成水:2H2 + O22H2O3、硫磺在空气(或氧气)中燃烧:S +O2 SO24、镁条在空气(或氧气)中燃烧:2Mg + O22MgO5、铁丝在氧气中燃烧:3Fe + 2O2 Fe3O46、木炭在空气(或氧气)中完全燃烧:C + O2 CO27、木炭不充分燃烧:2C + O22CO8、一氧化碳燃烧:2CO + O22CO29、二氧化碳和水反应生成碳酸:CO2+ H2O== H2CO310、二氧化碳通过灼热的炭层:CO2+ C 2CO11、氧化钙与水反应:CaO+ H2O == Ca(OH)212、铝与氧气反应:4Al + 3O2== 2Al2O3二、分解反应13、高锰酸钾制氧气:2KMnO4 K2MnO4+ MnO2+ O2↑14、氯酸钾制氧气:2KClO3 2KCl + 3O2↑15、双氧水制氧气:2H2O22H2O + O2↑16、电解水:2H2O 2H2↑+ O2↑17、碳酸分解:H2CO3H2O + CO2↑18、高温煅烧石灰石:CaCO3CaO+CO2↑三、置换反应19、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag + Cu(NO3)220、铜和硝酸汞溶液反应:Cu + 2HgNO3 == 2Hg + Cu(NO3)221、锌和硫酸铜溶液反应:Zn +CuSO4 == Cu + ZnSO422、锌和氯化铜溶液反应:Zn + CuCl2== Cu + ZnCl223、铁和氯化铜溶液反应:Fe + CuCl2== Cu+ FeCl224、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO425、铝和硫酸铜溶液反应:2Al + 3CuSO4==Cu +Al2(SO4)326、锌和稀硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑27、铁和稀硫酸反应制取氢气:Fe + H2SO4== FeSO4+ H2↑28、镁和稀硫酸反应制取氢气:Mg + H2SO4== MgSO4+ H2↑29、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑30、锌和稀盐酸反应制取氢气:Zn + 2HCl== ZnCl2+ H2↑31、铁和稀盐酸反应制取氢气:Fe + 2HCl==FeCl2+ H2↑32、镁和稀盐酸反应制取氢气:Mg + 2HCl== MgCl2+ H2↑33、铝和稀盐酸反应:2Al +6HCl == 2AlCl3+ 3H2↑34、木炭还原氧化铜:C+2CuO 2Cu +CO2↑35、木炭还原氧化铁:3C + 2Fe2O34Fe+ 3CO2↑36、木炭还原四氧化三铁:2C+ FeO 3Fe + 2CO2↑37、氢气还原氧化铜:H2+ CuO Cu + H2O↑点燃点燃点燃点燃点燃点燃点燃△MnO2△MnO2通电高温高温高温CuS高温高温点燃点燃--四、复分解反应(一)酸 + 碱→盐+水38、氢氧化钠与盐酸反应:NaOH + HCl== NaCl+ H2O39、氢氧化钠与硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O40、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O41、氢氧化镁与硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O42、氢氧化钙与硫酸反应:Ca(OH)2+H2SO4== CaSO4+ 2H2O43、氢氧化钙与盐酸反应:Ca(OH)2 +2HCl == CaCl2+ 2H2O44、氢氧化铜与硫酸反应:Cu(OH)2+ H2SO4== CuSO4+ 2H2O45、氢氧化铜与盐酸反应:Cu(OH)2+ 2HCl == CuCl2+ 2H2O46、氢氧化铁与盐酸反应:Fe(OH)3 + 3HCl == FeCl3+ 3H2O47、氢氧化铁与硫酸反应:Fe(OH)3 + 3H2SO4== Fe2(SO4)3+ 3H2O(二)酸+盐→另一种酸+ 另一种盐48、盐酸与硝酸银溶液反应:HCl + AgNO3 == AgCl↓+ HNO349、氯化钡溶液与硫酸溶液反应:BaCl2+ H2SO4== BaSO4↓+2HCl50、硝酸钡溶液与硫酸溶液反应:Ba(NO3)2+ H2SO4== BaSO4↓+2HNO351、碳酸钠与稀盐酸:Na2CO3+ 2HCl == 2NaCl+ H2O + CO2↑52、碳酸钠与稀硫酸:Na2CO3+ H2SO4== Na2SO4+ H2O +CO2↑53、碳酸氢钠与稀盐酸:NaHCO3 + HCl == NaCl+ H2O + CO2↑54、碳酸氢钠与稀硫酸:2NaHCO3+ H2SO4==Na2SO4+2H2O +2CO2↑55、石灰石与稀盐酸反应制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑56、碳酸钾与稀盐酸:K2CO3+ 2HCl == 2KCl+ H2O + CO2↑57、碳酸钾与稀硫酸:K2CO3+ H2SO4== K2SO4+ H2O+CO2↑(三)碱 + 盐→另一种碱 + 另一种盐58、硫酸铜溶液和氢氧化钠溶液:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓59、氯化铜溶液和氢氧化钠溶液:CuCl2+2NaOH = 2NaCl+Cu(OH)2↓60、氯化铁溶液和氢氧化钠溶液:FeCl3+3NaOH==Fe(OH)3↓+3NaCl61、硫酸铁和氢氧化钠溶液:Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO462、碳酸钠溶液与氢氧化钙溶液:Na2CO3+ Ca(OH)2== CaCO3↓+2NaOH63、碳酸钠溶液与氢氧化钡溶液:Na2CO3+ Ba(OH)2==BaCO3↓+2NaOH64、硫酸铜和氢氧化钡溶液:CuSO4+ Ba(OH)2== BaSO4↓+ Cu(OH)2↓(四)盐 + 盐→两种新盐65、硝酸银溶液与氯化钠溶液反应:AgNO3+ NaCl== AgCl↓+ NaNO366、氯化钡溶液与硫酸钠溶液反应:BaCl2+ Na2SO4=BaSO4↓+2NaCl67、氯化钙溶液与碳酸钠溶液反应:CaCl2+ Na2CO3= CaCO3↓+2NaCl68、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl--五、其他反应类型(一)金属氧化物+酸→盐 + 水69、稀盐酸清洗铁锈:6HCl + Fe2O3== 2FeCl3+ 3H2O70、稀硫酸清洗铁锈:3H2SO4+ Fe2O3== Fe2(SO4)3+ 3H2O71、氧化铜与稀硫酸反应:CuO +H2SO4== CuSO4+ H2O72、氧化铜与稀盐酸反应:CuO + 2HCl== CuCl2+ H2O73、氧化钙与稀硫酸反应:CaO + H2SO4== CaSO4+ H2O74、氧化钙与稀盐酸反应:CaO +2HCl==CaCl2+ H2O(二)非金属氧化物+碱→盐+ 水75、二氧化碳通入澄清石灰水中:CO2+ Ca(OH)2== CaCO3↓+ H2O76、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O77、澄清石灰水吸收二氧化硫:SO2 + Ca(OH)2== CaSO3↓+ H2O78、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH = Na2SO3+ H2O79、氢氧化钠溶液与三氧化硫:SO3 + 2NaOH = Na2SO4+ H2O(三)其它80、一氧化碳还原氧化铜:CO + CuO Cu + CO281、冶铁原理(赤铁矿):3CO + Fe2O32Fe +3 CO282、冶铁原理(磁铁矿):4CO + Fe3O43Fe +4CO283、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O84、甲烷燃烧:CH4 + 2O2CO2+ 2H2O85、葡萄糖氧化:C6H12O6+ 6O26H2O +6CO2△点燃点燃△△酶--。
九年级化学常见的化学式和方程式1.元素符号:H He C N O F Ne Na Mg Al Si P S Cl氢氦碳氮氧氟氖钠镁铝硅磷硫氯Ar K Ca Mn Fe Cu Zn Ag Ba Pt Au Hg I氩钾钙锰铁铜锌银钡铂金汞碘2.常见离子和化合物中元素的化合价:H+ Na+ K+ Ag+ NH4+ +1价氢离子钠离子钾离子银离子铵根离子Ca2+ Mg2+ Cu2+ Ba2+ Zn2+ Fe2+ +2价钙离子镁离子铜离子钡离子锌离子亚铁离子Fe3+ Al3+ +3价铁离子铝离子Cl- OH- NO3- -1价氯离子氢氧根离子硝酸根离子O2- SO42- CO32- -2价氧离子硫酸根离子碳酸根离子3.常见物质的化学式与名称:(1)单质:C:碳 S:硫 P:磷 Fe:铁Mg:镁 Al:铝 Hg:汞 Zn:锌Cu:铜 Ag:银 O2:氧气 H2:氧气 N2:氮气 O3:臭氧(2)氧化物:CO:一氧化碳 CO2:二氧化碳 SO2:二氧化硫 MnO2:二氧化锰SO3:三氧化硫 H2O2:过氧化氢CuO:氧化铜 CaO:氧化钙MgO:氧化镁 HgO:氧化汞 Fe2O3:氧化铁 Al2O3:氧化铝H2O:水 P2O5:五氧化二磷 Fe3O4:四氧化三铁(3)酸:HCl:盐酸 H2SO4:硫酸 HNO3:硝酸 H2CO3:碳酸H2S亚硫酸CH3COOH:醋酸(4)碱:NaOH:氢氧化钠 Ca(OH)2:氢氧化钙KOH:氢氧化钾 Mg(OH)2:氢氧化镁Cu(OH)2:氢氧化铜NH3 .H2O氨水 Fe(OH)3:氢氧化铁 Al(OH)3:氢氧化铁(5)盐酸盐:KCl:氯化钾 NaCl:氯化钠 KCl:氯化钾 AgCl:氯化银CuCl2:氯化铜 CaCl2:氯化钙 MgCl2:氯化镁 ZnCl2:氯化锌BaCl2:氯化钡 FeCl2:氯化亚铁 AlCl3:氯化铝 FeCl3:氯化铁(6)碳酸盐:CaCO3:碳酸钙 Na2CO3:碳酸钠 NaHCO3:碳酸氢钠BaCO3:碳酸钡 K2CO3:碳酸钾 NH4HCO3:碳酸氢铵(7)硫酸盐:Na2SO4:硫酸钠 ZnSO4:硫酸锌 MgSO4:硫酸镁CaSO4:硫酸钙 CuSO4:硫酸铜 BaSO4:硫酸钡FeSO4:硫酸亚铁 Fe2(SO4)3:硫酸铁 Al2(SO4)3:硫酸铝(NH4)2SO4:硫酸铵 Na2SO3:亚硫酸钠(8)硝酸盐:AgNO3:硝酸银 NaNO3:硝酸钠 Cu(NO3)2:硝酸铜KNO3:硝酸钾 NH4NO3:硝酸铵 NaNO2:亚硝酸钠(9)钾盐:KMnO4:高锰酸钾 K2MnO4:锰酸钾 KClO3:氯酸钾(10)有机化合物:C2H5OH:乙醇 C6H12O6:葡萄糖 CH4:甲烷4.九年级化学方程式分类:1.碳充分燃烧: C+O点燃CO22.碳不充分燃烧: 2C+O点燃2CO3.一氧化碳燃烧: 2CO+O点燃2CO24.产生一氧化碳: C+CO高温2CO5.硫燃烧: S+O点燃SO26.红磷燃烧: 4P+5O点燃2P2O57.氢气燃烧: 2H2+O点燃2H2O8.铁燃烧: 3Fe+2O点燃Fe3O49.镁燃烧: 2Mg+O点燃2MgO10.铝燃烧: 4Al+3O点燃2Al2O311.甲烷燃烧: CH4+2O点燃CO2+2H2O12.酒精燃烧: C2H5OH+3O点燃2CO2+3H2O13.呼吸原理: C6H12O6+6O2酶6CO2+6H2O14.高锰酸钾制氧气: 2KMnO4△K2MnO4+MnO2+O2↑15.氯酸钾制氧气: 2KClO3MnO22KCl+3O2↑△16.过氧化氢制氧气: 2H2O2 MnO2 2H2O +O2↑17.水通电分解: 2H2O通电2H2↑+O2↑18.氧化汞分解: 2HgO△2Hg+O2↑19.实验室制氢气的原理:Zn+H2SO4=ZnSO4+H2↑20.镁或硫酸性质:Mg+H2SO4=MgSO4+H2↑21.铁或硫酸性质:Fe+H2SO4=FeSO4+H2↑22.铝或硫酸性质:2Al+3H2SO4=Al2(SO4)3+H2↑23.镁或盐酸性质:Mg+2HCl=MgCl2+H2↑24.锌或盐酸性质:Zn+2HCl=ZnCl2+H2↑25.铁或盐酸性质:Fe+2HCl=FeCl2+H2↑26.铝或盐酸性质:2Al+6HCl=2AlCl3+3H2↑27.酸或碱的性质:NaOH+HCl=NaCl+H2O28.酸或碱的性质:Ca(OH)2+2HCl=CaCl2+H2O29.酸或碱的性质:2NaOH+H2SO4=Na2SO4+2H2O30.酸或碱的性质:Ca(OH)2+H2SO4=CaSO4+2H2O30.除铁锈的原理或金属氧化物与酸的性质:Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O31.制取CO2或CaCO3 作补钙药剂:CaCO3+2HCl=CaCl2+CO2↑+H2O32.碳酸盐或酸的性质:Na2CO3+2HCl=2NaCl+CO2↑+H2O33.治疗胃酸过多症的原理:NaHCO3 +HCl=NaCl+CO2↑+H2O34.氯化钠与硝酸银反应产生白色沉淀:NaCl+AgNO3=NaNO3+AgCl↓35.制取氢氧化钠的原理:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH36.氢氧化钠与硫酸铜反应产生蓝色沉淀:2NaOH+CuSO4=Na2SO4+Cu(OH)237.制取水煤气的原理:C+H2O高温H2+CO38.氢气还原氧化铜:H2+CuO△Cu+H2O39.碳还原氧化铜:C+2CuO高温2Cu+CO2↑40.一氧化碳还原氧化铜:CO+CuO△Cu+CO241.氢气还原氧化铁:Fe2O3+3H高温2Fe+3H2O42.碳还原氧化铁:2Fe2O3+3C高温4Fe+3CO2↑43.工业炼铁的原理:Fe2O3+3CO高温2Fe+3CO244.铁置换硫酸铜中的铜:Fe+CuSO4=Cu+FeSO445.铜置换硝酸银中的银:Cu+2AgNO3=2Ag+Cu(NO3)246.铝置换硫酸铜中的铜:2Al+3CuSO4=3Cu+Al2(SO4)347.生石灰制熟石灰:H2O+CaO=Ca(OH)248.碳酸不稳定:H2CO3=H2O+CO2↑49.工业制生石灰的原理:CaCO高温CaO+CO2↑50.检验CO2或澄清石灰水变浑浊原理:CO2+Ca(OH)2=CaCO3↓+H2O51.烧碱变质的原理:CO2+2NaOH=Na2CO3+H2O52.碱与非金属氧化物的性质:SO2+2NaOH=Na2SO3+H2O SO3+2NaOH=Na2SO4+H2O53.非金属氧化物的性质:H2O+CO2 =H2CO3 H2O+SO2 =H2SO3 H2O+SO3 =H2SO4。
常见物质的化学式单质氢气H2氦气He 氧气O2氮气N2碳(石墨、金刚石)C 氖气Ne 钠Na 硅Si 铝Al 镁Mg 硫S 氯气Cl2钾K 氩气Ar 红磷、白磷P 钛Ti 铁Fe 铜Cu 锌Zn 汞Hg 氪气Kr 银Ag 镉Cd 锡Sn 铅Pb 氙气Xe 钡Ba 铂Pt 金Au 钙Ca 硒Se 碘I2臭氧O3化合物氧化物水H2O过氧化氢H2O2一氧化碳CO二氧化碳CO2一氧化氮NO二氧化氮NO2氧化钠Na2O 氧化镁MgO氧化铝Al2O3二氧化硅SiO2五氧化二磷P2O5二氧化硫SO2三氧化硫SO3二氧化氯ClO2氧化钙CaO二氧化锰MnO2氧化亚铁FeO 氧化铁Fe2O3四氧化三铁Fe3O4氧化铜CuO氧化银Ag2O 氧化汞HgO 一氧化二N2O氮酸硝酸HNO3盐酸HCl 硫酸H2SO4亚硫酸H2SO3碳酸H2CO3氢氟酸HF氢硫酸H2S 乙酸(醋酸)CH3COOH碱氨水NH3·H2O 氢氧化钾KOH 氢氧化钠NaOH 氢氧化钡Ba(OH)2氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化铜Cu(OH)2氢氧化铁Fe(OH)3盐NO3-Cl-SO42-CO32-NH4+NH4NO3硝酸铵NH4Cl 氯化铵(NH4)2SO4硫酸铵(NH4)2CO3碳酸铵K+KNO3硝酸钾KCl 氯化钾K2SO4硫酸钾K2CO3碳酸钾Na+NaNO3硝酸钠NaCl 氯化钠Na2SO4硫酸钠Na2CO3碳酸钠Ba2+Ba(NO3)2硝酸钡BaCl2氯化钡BaSO4硫酸钡BaCO3碳酸钡Ca2+Ca(NO3)2硝酸钙CaCl2氯化钙CaSO4硫酸钙CaCO3碳酸钙Mg2+Mg(NO3)2硝酸镁MgCl2氯化镁MgSO4硫酸镁MgCO3碳酸镁Al3+Al(NO3)3硝酸铝AlCl3氯化铝Al2(SO4)3硫酸铝Zn2+Zn(NO3)2硝酸锌ZnCl2氯化锌ZnSO4硫酸锌ZnCO3碳酸锌Fe2+Fe(NO3)2硝酸亚铁FeCl2氯化亚铁FeSO4硫酸亚铁FeCO3碳酸亚铁Fe3+Fe(NO3)3硝酸铁FeCl3氯化铁Fe2(SO4)3硫酸铁Cu2+Cu(NO3)2硝酸铜CuCl2氯化铜CuSO4硫酸铜Ag+AgNO3硝酸银AgCl 氯化银Ag2SO4硫酸银Ag2CO3碳酸银高锰酸钾KMnO4氯酸钾KClO3锰酸钾K2MnO4碳酸氢钙Ca(HCO3)2硫酸铜晶体CuSO4·5H2O碳酸钠晶体Na2CO3·10H2O碳酸氢铵NH4HCO3磷酸钙Ca3(PO4)2磷酸二氢钙Ca(H2PO4)2碳酸氢钠NaHCO3亚硝酸钠NaNO2磷酸二氢铵NH4H2PO4磷酸氢二铵(NH4)2HPO4羟基磷酸钙Ca10(PO4)6(OH)2有机物甲烷CH4乙醇(酒精)C2H5OH乙酸(醋酸)CH3COOH 淀粉(C6H10O5)n葡萄糖C6H12O6蔗糖C12H22O11尿素CO(NH2)2其他:氨气NH3。
人教版初三化学上册化学方程式总结文字表达式及现象第一二章化合反应为1分解反应为2点燃点燃1.4P+5O2P2O5磷+氧气五氧化二磷1现象:黄白色火焰,产生大量白烟点燃点燃2.S+O2SO2硫+氧气二氧化硫1现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生成有刺激性气味的气体。
点燃点燃3.3Fe+2O2Fe3O4铁+氧气四氧化三铁1现象:剧烈燃烧、火星四射、放出热量,生成黑色的固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底点燃点燃4.C+O2CO2碳+氧气二氧化碳1现象:生成能够让纯净的石灰水浑浊的气体制取氧气MnO2二氧化锰5.2H2O22H2O+O2↑过氧化氢水+氧气2现象:溶液里冒出大量的气泡MnO26.2KClO32KCl+3O2↑△二氧化锰氯酸钾氯化钾+氧气2加热现象:生成能让带火星的木条复燃的气体7.2KMnO4K2MnO4+MnO2+O2↑加热高锰酸钾锰酸钾+二氧化锰+氧气2现象:同上加热8.汞+氧气2HgO1氧化汞2Hg+O2现象:一部分银白色的液态汞变成了红色粉末9.氧化汞汞+氧气2HgO加热2Hg+O2↑2现象:生成银白色的液体金属点燃石蜡+氧气二氧化碳+水10.点燃CxHy+O2CO2+H2O第三四章点燃1.2H2+O22H2O点燃氢气前要验纯1点燃氢气+氧气水现象:淡蓝色的火焰烧杯壁上有小液滴通电通电2.2H2O2H2↑+O2↑水氢气+氧气2现象:正极上产生使带火星的木条复燃的气体负极上产生点燃是淡蓝色火焰的气体第五六七章1.Fe+CuSO4FeSO4+Cu铁+硫酸铜铜+硫酸亚铁现象:铁溶解生成红色金属蓝色溶液变为淡绿色点燃点燃2.2Mg+O22MgO.镁+氧气氧化镁1现象:燃烧、放出大量的热、同时放出耀眼的白光生成白色粉末3.Na2CO3+2HCl2NaCl+H2O+CO2↑碳酸钠+盐酸氯化钠+二氧化碳+水现象:生成能使澄清石灰水变浑浊的气体(泡沫灭火器原理)4.H2+CuOCu+H2O 现象:由黑色的固体变成红色的,同时有水珠生成2.CuSO4+2NaOHCu(OH)2↓+Na2SO4现象:生成蓝色沉淀,溶液由蓝色变无色。
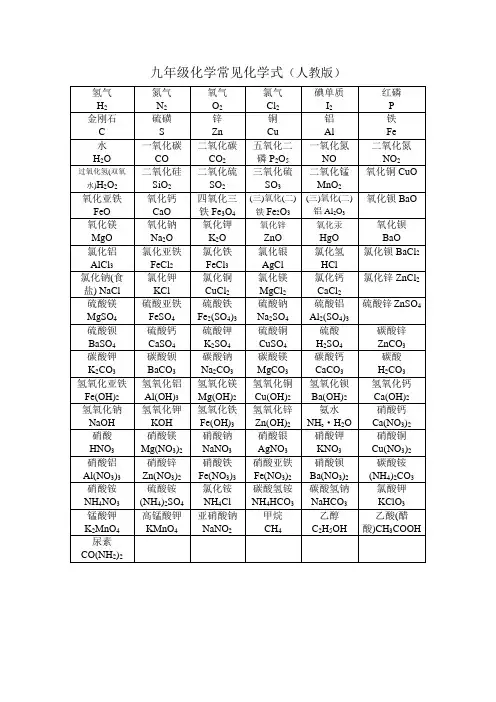
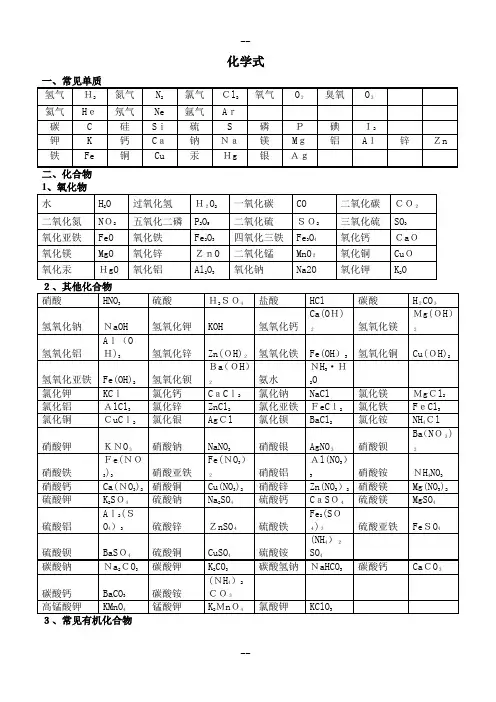
人教版九年级化学常用化学式氢气H 2; 氮气N 2; 氧气O 2; 氯气Cl 2; 碘I 2; 红磷 P ; 金刚石C ;硫磺S ; 锌Zn ; 铜Cu ; 铝Al ; 铁Fe ; 水H 2O ; 过氧化氢双氧水H 2O 2 二氧化碳CO 2; 一氧化碳CO ; 一氧化氮NO ; 二氧化氮NO 2; 五氧化二磷P 2O 5; 二氧化硅SiO 2; 二氧化硫SO 2;三氧化硫SO 3; 二氧化锰MnO 2; 氧化铜CuO ; 氧化亚铁FeO ;三氧化二铁Fe 2O 3; 四氧化三铁Fe 3O 4; 氧化钙CaO ; 氧化钡BaO ; 三氧化二铝Al 2O 3; 氧化镁MgO ; 氧化钠Na 2O ; 氧化钾K 2O ; 氧化锌ZnO ; 氧化汞HgO ; 氧化钡BaO ; 氯化钡BaCl 2; 氧化铝AlCl 3; 氯化亚铁FeCl 2; 氯化铁FeCl 3; 氯化银AgCl ;氯化氢HCl ; 氯化钾KCl ; 氯化钠食盐 NaCl ; 氯化铜CuCl 2; 氯化镁MgCl 2; 氯化钙CaCl 2; 氯化锌ZnCl 2; 硫化氢H 2S ; 硫化锌ZnS ; 硫化钠Na 2S ; 硫酸镁MgSO 4; 硫酸亚铁FeSO 4; 硫酸铁Fe 2SO 43; 硫酸钠Na 2SO 4; 硫酸铝Al 2SO 43; 硫酸锌ZnSO 4; 硫酸H 2SO 4; 硫酸钾K 2SO 4; 硫酸钙CaSO 4; 硫酸钡BaSO 4; 硫酸铜CuSO 4; 碳酸锌ZnCO 3; 碳酸钾K 2CO 3; 碳酸钡BaCO 3; 碳酸H 2CO 3; 碳酸钠Na 2CO 3; 碳酸镁MgCO 3; 碳酸钙CaCO 3; 氢氧化亚铁FeOH 2; 氢氧化钠NaOH ; 氢氧化镁MgOH 2;氢氧化铜CuOH 2; 氢氧化钡BaOH 2; 氢氧化钙CaOH 2; 氢氧化铝AlOH 3; 氢氧化钾KOH ; 氢氧化铁FeOH 3; 氢氧化锌ZnOH 2; 氨水NH 3·H 2O ; 硝酸HNO 3; 硝酸钙CaNO 32; 硝酸镁MgNO 32; 硝酸钠NaNO 3; 硝酸银AgNO 3; 硝酸钾KNO 3; 硝酸铜CuNO 32; 硝酸铝AlNO 33; 硝酸锌ZnNO 32; 硝酸铁FeNO 33; 硝酸亚铁FeNO 32; 硝酸钡BaNO 32; 碳酸铵NH 42CO 3; 硝酸铵NH 4NO 3; 氯化铵NH 4Cl ; 硫酸铵NH 42SO 4; 氨气NH 3; 碳酸氢铵NH 4HCO 3; 碳酸氢钠NaHCO 3; 氯酸钾KClO 3; 锰酸钾K 2MnO 4 高锰酸钾 KMnO 4; 亚硝酸钠NaNO 2; 胆矾CuSO 4·5H 2O ; 甲烷CH 4 乙醇C 2H 5OH ; 乙酸醋酸CH 3COOH ; 尿素CONH 22;。
化学式化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O2 2P2O52、氢气在空气中燃烧生成水:2H2 + O22H2O3、硫磺在空气(或氧气)中燃烧:S + O2 SO24、镁条在空气(或氧气)中燃烧:2Mg + O22MgO5、铁丝在氧气中燃烧:3Fe + 2O2 Fe3O46、木炭在空气(或氧气)中完全燃烧:C + O2 CO27、木炭不充分燃烧:2C + O22CO8、一氧化碳燃烧:2CO + O22CO29、二氧化碳和水反应生成碳酸:CO2+ H2O == H2CO310、二氧化碳通过灼热炭层:CO2+ C 2CO11、氧化钙及水反应:CaO+ H2O == Ca(OH)212、铝及氧气反应:4Al + 3O2== 2Al2O3二、分解反应13、高锰酸钾制氧气:2KMnO4 K2MnO4+ MnO2+ O2↑14、氯酸钾制氧气:2KClO3 2KCl + 3O2↑15、双氧水制氧气:2H2O22H2O + O2↑16、电解水:2H2O 2H2↑+ O2↑17、碳酸分解:H2CO3H2O + CO2↑18、高温煅烧石灰石:CaCO3CaO +CO2↑三、置换反应19、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag + Cu(NO3)220、铜和硝酸汞溶液反应:Cu + 2HgNO3 == 2Hg + Cu(NO3)221、锌和硫酸铜溶液反应:Zn + CuSO4 == Cu + ZnSO422、锌和氯化铜溶液反应:Zn + CuCl2== Cu + ZnCl223、铁和氯化铜溶液反应:Fe + CuCl2 == Cu + FeCl224、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO425、铝和硫酸铜溶液反应:2Al + 3CuSO4 == Cu +Al2(SO4)326、锌和稀硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑27、铁和稀硫酸反应制取氢气:Fe + H2SO4== FeSO4+ H2↑28、镁和稀硫酸反应制取氢气:Mg + H2SO4== MgSO4+ H2↑29、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑30、锌和稀盐酸反应制取氢气:Zn + 2HCl== ZnCl2+ H2↑31、铁和稀盐酸反应制取氢气:Fe + 2HCl== FeCl2+ H2↑32、镁和稀盐酸反应制取氢气:Mg + 2HCl== MgCl2+ H2↑33、铝和稀盐酸反应:2Al + 6HCl == 2AlCl3+ 3H2↑34、木炭还原氧化铜:C + 2CuO 2Cu + CO2↑35、木炭还原氧化铁:3C + 2Fe2O34Fe + 3CO2↑36、木炭还原四氧化三铁:2C + Fe3O43Fe + 2CO2↑37、氢气还原氧化铜:H2+ CuO Cu + H2O↑点燃点燃点燃点燃点燃点燃点燃△MnO2△MnO2通电高温高温高温CuS高温高温点燃点燃3 / 4四、复分解反应(一)酸 + 碱→盐 + 水38、氢氧化钠及盐酸反应:NaOH + HCl == NaCl + H2O39、氢氧化钠及硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O40、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O41、氢氧化镁及硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O42、氢氧化钙及硫酸反应:Ca(OH)2 + H2SO4== CaSO4+ 2H2O43、氢氧化钙及盐酸反应:Ca(OH)2 +2HCl == CaCl2+ 2H2O44、氢氧化铜及硫酸反应:Cu(OH)2 + H2SO4== CuSO4+ 2H2O45、氢氧化铜及盐酸反应:Cu(OH)2 + 2HCl == CuCl2+ 2H2O46、氢氧化铁及盐酸反应:Fe(OH)3 + 3HCl == FeCl3+ 3H2O47、氢氧化铁及硫酸反应:Fe(OH)3 + 3H2SO4== Fe2(SO4)3+ 3H2O(二)酸 + 盐→另一种酸 + 另一种盐48、盐酸及硝酸银溶液反应:HCl + AgNO3 == AgCl↓+ HNO349、氯化钡溶液及硫酸溶液反应:BaCl2 + H2SO4== BaSO4↓+ 2HCl50、硝酸钡溶液及硫酸溶液反应:Ba(NO3)2+ H2SO4== BaSO4↓+2HNO351、碳酸钠及稀盐酸:Na2CO3+ 2HCl == 2NaCl+ H2O + CO2↑52、碳酸钠及稀硫酸:Na2CO3+ H2SO4== Na2SO4+ H2O + CO2↑53、碳酸氢钠及稀盐酸:NaHCO3 + HCl == NaCl+ H2O + CO2↑54、碳酸氢钠及稀硫酸:2NaHCO3+ H2SO4== Na2SO4+ 2H2O + 2CO2↑55、石灰石及稀盐酸反应制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO2↑56、碳酸钾及稀盐酸:K2CO3+ 2HCl == 2KCl+ H2O + CO2↑57、碳酸钾及稀硫酸:K2CO3+ H2SO4== K2SO4+ H2O + CO2↑(三)碱 + 盐→另一种碱 + 另一种盐58、硫酸铜溶液和氢氧化钠溶液:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓59、氯化铜溶液和氢氧化钠溶液:CuCl2+2NaOH = 2NaCl+Cu(OH)2↓60、氯化铁溶液和氢氧化钠溶液:FeCl3+3NaOH==Fe(OH)3↓+3NaCl61、硫酸铁和氢氧化钠溶液:Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO462、碳酸钠溶液及氢氧化钙溶液:Na2CO3+ Ca(OH)2== CaCO3↓+2NaOH63、碳酸钠溶液及氢氧化钡溶液:Na2CO3+ Ba(OH)2== BaCO3↓+2NaOH64、硫酸铜和氢氧化钡溶液:CuSO4+ Ba(OH)2== BaSO4↓+ Cu(OH)2↓(四)盐 + 盐→两种新盐65、硝酸银溶液及氯化钠溶液反应:AgNO3+ NaCl == AgCl↓+ NaNO366、氯化钡溶液及硫酸钠溶液反应:BaCl2+ Na2SO4= BaSO4↓+ 2NaCl67、氯化钙溶液及碳酸钠溶液反应:CaCl2+ Na2CO3= CaCO3↓+ 2NaCl68、氯化钡溶液及碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl五、其他反应类型(一)金属氧化物 + 酸→盐 + 水69、稀盐酸清洗铁锈:6HCl + Fe2O3== 2FeCl3+ 3H2O70、稀硫酸清洗铁锈:3H2SO4+ Fe2O3== Fe2(SO4)3+ 3H2O71、氧化铜及稀硫酸反应:CuO + H2SO4== CuSO4+ H2O72、氧化铜及稀盐酸反应:CuO + 2HCl== CuCl2+ H2O73、氧化钙及稀硫酸反应:CaO + H2SO4== CaSO4+ H2O74、氧化钙及稀盐酸反应:CaO + 2HCl== CaCl2+ H2O(二)非金属氧化物 + 碱→盐 + 水75、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2== CaCO3↓+ H2O76、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O77、澄清石灰水吸收二氧化硫:SO2+ Ca(OH)2== CaSO3↓+ H2O78、氢氧化钠溶液吸收二氧化硫:SO2+ 2NaOH = Na2SO3+ H2O79、氢氧化钠溶液及三氧化硫:SO3+ 2NaOH = Na2SO4+ H2O(三)其它80、一氧化碳还原氧化铜:CO + CuO Cu + CO281、冶铁原理(赤铁矿):3CO + Fe2O32Fe +3 CO282、冶铁原理(磁铁矿):4CO + Fe3O43Fe +4CO283、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O84、甲烷燃烧:CH4+ 2O2CO2+ 2H2O85、葡萄糖氧化:C6H12O6+ 6O26H2O +6CO2△点燃点燃△△酶4 / 4。
大全 九年级化学要背的所有文字表达式、化学式、元素符号化合反应1、镁在空气中燃烧:2Mg + O 22MgO 2、铁在氧气中燃烧:3Fe + 2O 2Fe 3O 43、铝在空气中燃烧:4Al + 3O 22Al 2O 3 4、氢气在空气中燃烧:2H 2 + O 2 2H 2O 5、红磷在空气中燃烧:4P + 5O 22P 2O 56、硫粉在空气中燃烧: S + O 2SO 27、碳在氧气中充分燃烧:C + O 2CO 28、碳在氧气中不充分燃烧:2C + O 22CO 9、二氧化碳通过灼热碳层: C + CO 22CO 10、一氧化碳在氧气中燃烧:2CO + O 22CO 211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO 2 + H 2OH 2CO 3 12、生石灰溶于水:CaO + H 2O Ca(OH)213、无水硫酸铜作干燥剂:CuSO 4 + 5H 2O CuSO 4·5H 2O14、钠在氯气中燃烧:2Na + Cl 22NaCl分解反应点燃 点燃点燃 点燃 点燃 点燃 点燃 点燃 点燃点燃 点燃大全 15、实验室用双氧水制氧气:2H 2O 22H 2O +O 2↑ 16、加热高锰酸钾:2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑17、水在直流电的作用下分解:2H 2O2↑+ O 2 ↑18、碳酸不稳定而分解:H 2CO 3 H 2O + CO 2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO 3CaO + CO 2↑置换反应20、铁和硫酸铜溶液反应:Fe + CuSO 4 FeSO 4 + Cu21、锌和稀硫酸反应(实验室制氢气):Zn + H 2SO 4 ZnSO 4 + H 2↑22、镁和稀盐酸反应:Mg + 2HCl MgCl 2 + H 2↑23、氢气还原氧化铜:H 2 + CuOCu + H 2O 24、木炭还原氧化铜:C + 2CuO 2Cu + CO 2↑25、甲烷在空气中燃烧:CH 4 + 2O 22 + 2H 2O 26、水蒸气通过灼热碳层:H 2O + C2 + CO 27、焦炭还原氧化铁:3C + 2Fe 2O 32↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO 4Cu(OH)2↓ + Na 2SO 4 29、甲烷在空气中燃烧:CH 4 + 2O 22 + 2H 2O点燃 高温 高温 点燃 高温 高温高温通电△MnO 2大全30、酒精在空气中燃烧:C 2H 5OH + 3O22CO 2 + 3H 2O 31、一氧化碳还原氧化铜:CO + CuO2 32、一氧化碳还原氧化铁:3CO + Fe 2O 32 33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO 2 CaCO3 ↓+ H 2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO 2 Na 2CO 3 + H 2O35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO 3 + 2HCl CaCl 2 + H 2O + CO 2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理):Na 2CO 3 + 2HCl 2NaCl + H 2O + CO 2↑一. 物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg + O 22MgO2. 铁在氧气中燃烧:3Fe + 2O 2Fe 3O 43. 铜在空气中受热:2Cu + O 22CuO4. 铝在空气中燃烧:4Al + 3O 22Al 2O 35. 氢气中空气中燃烧:2H 2 + O 22H 2O6. 红磷在空气中燃烧:4P + 5O 22P 2O 57. 硫粉在空气中燃烧: S + O 2SO 2点燃点燃 点燃点燃点燃点燃点燃高温 加热 点燃大全8. 碳在氧气中充分燃烧:C + O2CO 29. 碳在氧气中不充分燃烧:2C + O 2(2)化合物与氧气的反应: 10. 一氧化碳在氧气中燃烧:2CO + O 22 11. 甲烷在空气中燃烧:CH 4 + 2O 22 + 2H 2O12. 酒精在空气中燃烧:C 2H 5OH + 3O 22CO 2 + 3H 2O二.几个分解反应:13. 水在直流电的作用下分解:2H 2O2↑+ O 2 ↑ 14. 加热碱式碳酸铜:Cu 2(OH)2CO 32O + CO 2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO 32 ↑ 16. 加热高锰酸钾:2KMnO 42MnO 4 + MnO 2 + O 2↑17. 碳酸不稳定而分解:H 2CO 3 H 2O + CO 2↑18. 高温煅烧石灰石:CaCO 32↑三.几个氧化还原反应:19. 氢气还原氧化铜:H 2 + CuOCu + H 2O 20. 木炭还原氧化铜:C + 2CuO 2Cu + CO 2↑ 21. 焦炭还原氧化铁:3C + 2Fe 2O 32↑ 高温高温加热 高温 加热 MnO 2 加热 加热 电解 点燃 点燃 点燃 点燃 点燃大全22. 焦炭还原四氧化三铁:2C + Fe 3O43Fe + 2CO 2↑ 23. 一氧化碳还原氧化铜:CO + CuO 224. 一氧化碳还原氧化铁:3CO + Fe 2O 32Fe + 3CO 225. 一氧化碳还原四氧化三铁:4CO + Fe 3O 42四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)26. 锌和稀硫酸Zn + H 2SO 4 = ZnSO 4 + H 2↑27. 铁和稀硫酸Fe + H 2SO 4 = FeSO 4 + H 2↑28. 镁和稀硫酸Mg + H 2SO 4 = MgSO 4 + H 2↑29. 铝和稀硫酸2Al +3H 2SO 4 = Al 2(SO 4)3 +3H 2↑30. 锌和稀盐酸Zn + 2HCl ZnCl 2 + H 2↑31. 铁和稀盐酸Fe + 2HCl FeCl 2 + H 2↑32. 镁和稀盐酸Mg + 2HCl MgCl 2 + H 2↑33. 铝和稀盐酸2Al + 6HCl 2AlCl 3 + 3H 2↑(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐34. 铁和硫酸铜溶液反应:Fe + CuSO 4 FeSO 4 + Cu35. 锌和硫酸铜溶液反应:Zn + CuSO 4 ZnSO 4 + Cu36. 铜和硝酸汞溶液反应:Cu + Hg(NO 3)2 Cu(NO 3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37. 氧化铁和稀盐酸反应:Fe 2O 3 + 6HCl 2FeCl 3 + 3H 2O38. 氧化铁和稀硫酸反应:Fe 2O 3 + 3H 2SO 4 Fe 2(SO 4)3 + 3H 2O 加热 高温高温 高温39. 氧化铜和稀盐酸反应:CuO + 2HCl CuCl2 + H2O40. 氧化铜和稀硫酸反应:CuO + H2SO4CuSO4 + H2O41. 氧化镁和稀硫酸反应:MgO + H2SO4MgSO4 + H2O42. 氧化钙和稀盐酸反应:CaO + 2HCl CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠暴露在空气中变质:2NaOH + CO2Na2CO3 + H2O44.苛性钠吸收二氧化硫气体:2NaOH + SO2Na2SO3 + H2O45.苛性钠吸收三氧化硫气体:2NaOH + SO3Na2SO4 + H2O46.消石灰放在空气中变质:Ca(OH)2 + CO2CaCO3↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水48.盐酸和烧碱起反应:HCl + NaOH NaCl +H2O49. 盐酸和氢氧化钾反应:HCl + KOH KCl +H2O50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2CuCl2 + 2H2O51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2CaCl2 + 2H2O52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3AlCl3 + 3H2O54.硫酸和烧碱反应:H2SO4+ 2NaOH Na2SO4 + 2H2O55.硫酸和氢氧化钾反应:H2SO4+ 2KOH K2SO4 + 2H2O56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2CuSO4 + 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3Fe2(SO4)3 + 6H2O58. 硝酸和烧碱反应:HNO3+NaOH NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反应:CaCO3+ 2HCl CaCl2 + H2O + CO2↑大全大全 60.碳酸钠与稀盐酸反应: Na 2CO 3+ 2HCl 2NaCl + H 2O + CO 2↑61.碳酸镁与稀盐酸反应: MgCO 3+ 2HCl MgCl 2 + H 2O + CO 2↑62.盐酸和硝酸银溶液反应:HCl + AgNO 3AgCl ↓ + HNO 363.硫酸和碳酸钠反应:Na 2CO 3 + H 2SO 4Na 2SO 4 + H 2O + CO 2↑64.硫酸和氯化钡溶液反应:H 2SO 4 + BaCl 2BaSO 4 ↓+ 2HCl(7)碱 + 盐 -------- 另一种碱 + 另一种盐65.氢氧化钠与硫酸铜:2NaOH + CuSO 4Cu(OH)2↓ + Na 2SO 466.氢氧化钠与氯化铁:3NaOH + FeCl 3Fe(OH)3↓ + 3NaCl67.氢氧化钠与氯化镁:2NaOH + MgCl 2Mg(OH)2↓ + 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl 2Cu(OH)2↓ + 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na 2CO 3CaCO 3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl + AgNO 3AgCl ↓ + NaNO 371.硫酸钠和氯化钡:Na 2SO 4 + BaCl 2BaSO 4↓ + 2NaCl五.其它反应:72.二氧化碳溶解于水:CO 2 + H 2O H 2CO 373.生石灰溶于水:CaO + H 2O Ca(OH)274.氧化钠溶于水:Na 2O + H 2O 2NaOH75.三氧化硫溶于水:SO 3 + H 2O H 2SO 476.硫酸铜晶体受热分解:CuSO 4·5H 2O CuSO 4 + 5H 2O77.无水硫酸铜作干燥剂:CuSO 4 + 5H 2O CuSO 4·5H 2化学方程式 反应现象 应用2Mg+O 22MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹点燃或Δ加热大全 2Hg+O 22HgO 银白液体、生成红色固体 拉瓦锡实验 2Cu+O 22CuO 红色金属变为黑色固体 4Al+3O 22Al 2O 3 银白金属变为白色固体 3Fe+2O 23O 4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O 2高温2Fe 2O 3 C+O 2CO 2 剧烈燃烧、白光、放热、使石灰水变浑浊 S+O 2 SO 2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 2H 2+O 22O 淡蓝火焰、放热、生成使无水CuSO 4变蓝的液体(水) 高能燃料 4P+5O 22P 2O 5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量 CH 4+2O 22O+CO 2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO 4变蓝的液体(水) 甲烷和天然气的燃烧 2C 2H 2+5O 22H 2O+4CO 2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO 4变蓝的液体(水) 氧炔焰、焊接切割金属 2KClO 32KCl +3O 2↑ 生成使带火星的木条复燃的气体 实验室制备氧气 2KMnO 42MnO 4+MnO 2+O 2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧气 2HgO 2Hg+O 2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验 2H 2O 2H 2↑+O 2↑ 水通电分解为氢气和氧气 电解水Cu 2(OH)2CO 32O+CO 2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热 △ 电解△ △ △ MnO 2 点燃点燃 点燃 点燃 点燃点燃 点燃 点燃或Δ 点燃或Δ 点燃或Δ。
九年级化学常见化学式人
教版
The latest revision on November 22, 2020
人教版九年级化学常用化学式
氢气H
2;氮气N
2
;氧气O
2
;氯气Cl
2
;碘I
2
;红磷 P;金刚石C;
硫磺S;锌Zn;铜Cu;铝Al;铁Fe;水H
2
O;
过氧化氢(双氧水)H
2O
2
二氧化碳CO
2
;一氧化碳CO;一氧化氮NO;
二氧化氮NO
2;五氧化二磷P
2
O
5
;二氧化硅SiO
2
;二氧化硫
SO
2
;
三氧化硫SO
3;二氧化锰MnO
2
;氧化铜CuO;氧化亚铁FeO;
(三)氧化(二)铁Fe
2O
3
;四氧化三铁Fe
3
O
4
;氧化钙CaO;氧化钡BaO;
(三)氧化(二)铝Al
2O
3
;氧化镁MgO;氧化钠Na
2
O;氧化钾K
2
O;
氧化锌ZnO;氧化汞HgO;氧化钡BaO;氯化钡BaCl
2
;
氧化铝AlCl
3;氯化亚铁FeCl
2
;氯化铁FeCl
3
;氯化银
AgCl;
氯化氢HCl;氯化钾KCl;氯化钠(食盐) NaCl;氯化铜CuCl
2
;
氯化镁MgCl
2;氯化钙CaCl
2
;氯化锌ZnCl
2
;硫化氢H
2
S;
硫化锌ZnS;硫化钠Na
2S;硫酸镁MgSO
4
;硫酸亚铁FeSO
4
;
硫酸铁Fe
2(SO
4
)
3
;硫酸钠Na
2
SO
4
;硫酸铝Al
2
(SO
4
)
3
;硫酸锌ZnSO
4
;
硫酸H
2SO
4
;硫酸钾K
2
SO
4
;硫酸钙CaSO
4
;硫酸钡BaSO
4
;
硫酸铜CuSO
4;碳酸锌ZnCO
3
;碳酸钾K
2
CO
3
;碳酸钡BaCO
3
;
碳酸H
2CO
3
;碳酸钠Na
2
CO
3
;碳酸镁MgCO
3
;碳酸钙CaCO
3
;
氢氧化亚铁Fe(OH)
2;氢氧化钠NaOH;氢氧化镁Mg(OH)
2
;
氢氧化铜Cu(OH)
2;氢氧化钡Ba(OH)
2
;氢氧化钙Ca(OH)
2
;
氢氧化铝Al(OH)
3;氢氧化钾KOH;氢氧化铁Fe(OH)
3
;
氢氧化锌Zn(OH)
2;氨水NH
3
·H
2
O;硝酸HNO
3
;
硝酸钙Ca(NO
3)
2
;硝酸镁Mg(NO
3
)
2
;硝酸钠NaNO
3
;
硝酸银AgNO
3;硝酸钾KNO
3
;硝酸铜Cu(NO
3
)
2
;
硝酸铝Al(NO
3)
3
;硝酸锌Zn(NO
3
)
2
;硝酸铁Fe(NO
3
)
3
;
硝酸亚铁Fe(NO
3)
2
;硝酸钡Ba(NO
3
)
2
;碳酸铵(NH
4
)
2
CO
3
;
硝酸铵NH
4NO
3
;氯化铵NH
4
Cl;硫酸铵(NH
4
)
2
SO
4
;氨气NH
3
;
碳酸氢铵NH
4HCO
3
;碳酸氢钠NaHCO
3
;氯酸钾KClO
3
;锰酸钾K
2
MnO
4
高锰酸钾 KMnO
4;亚硝酸钠NaNO
2
;胆矾CuSO
4
·5H
2
O;甲烷CH
4
乙醇C
2H
5
OH;乙酸(醋酸)CH
3
COOH;尿素CO(NH
2
)
2
;。