两种脲酶活性定性测定方法及比较
- 格式:pdf
- 大小:13.94 KB
- 文档页数:3

一、脲酶测定(比色法)脲酶是对尿素转化起关键作用的酶,它的酶促反应产物是可供植物利用的氮源,它的活性可以用来表示土壤供氮能力。
1、试剂配制:(1)pH6。
7柠檬酸盐溶液:取368g柠檬酸溶于600mL蒸馏水中,另取295g氢氧化钾溶于水,再将两种溶液合并,用1N氢氧化钠将pH调至6.7,并用水稀释至2L。
(2)苯酚钠溶液:称取62.5g苯酚溶于少量乙醇中,加2mL甲醇和18.5mL 丙酮,后用乙醇稀释至100mL(A液),保存再冰箱中。
称取27g氢氧化钠溶于100mL水中(B液),保存于冰箱中.使用前,取A、B两液各20mL混和,并用蒸馏水稀释至100mL备用。
(3)次氯酸钠溶液:用水稀释制剂至活性氯的浓度为0.9%,(1。
9g次氯酸钠溶于1L水中)溶液稳定。
(4)10%尿素溶液:10g尿素溶于100mL水中。
(5)N的标准溶液:精确称取0。
4717g硫酸铵溶于水稀释至1L,则得1mL 含0。
1mgN的标液,再将此液稀释10倍制成氮工作液(0.01mg/mL)。
2、操作步骤称取5g土置于50mL容量瓶中,加1mL甲苯处理,加塞塞紧轻摇15min;往瓶中加入5mL10%尿素液和10mL的柠檬酸盐缓冲液(pH6.7),仔细混匀.在37℃恒温箱中培养24h。
然后用热至38℃的蒸馏水稀释至刻度(甲苯应浮在刻度以上),摇荡,将悬液过滤.取滤液1mL置于50mL容量瓶中,用蒸馏水稀释至10mL,然后加入4mL苯酚钠溶液,并立即加入3mL次氯酸钠溶液,加入每一试剂后,立即将混合物摇匀,20min后,将混合物稀释至刻度,在波长578nm处测定吸光值.脲酶活性以样品所得的吸光值减去对照样品吸光值之差,根据标准曲线求出氨态氮量。
标准曲线绘制:分别取0、1、3、5、7、9、11、13mL氮工作液置于50mL容量瓶中,加蒸馏水至20mL,再加4mL苯酚钠溶液和3mL次氯酸钠溶液,随加随摇匀,20min后显色,定容。
1h内再分光光度计上于578nm处比色。


大豆制品中脲酶活性的测定定性法:酚红法一、原理:酚红指示剂在pH 6.4-8.2时由黄变红,大豆制品中所含的尿素酶在pH=7.0,T=30℃时可将尿素水解产生氨,释放的氨可使酚红指示剂变红,根据变红的时间长短来判断脲酶活性的大小。
二、仪器和试剂:粉碎机:粉碎时不产生强烈发热;分析天平;25ml纳式比色管;恒温水浴锅;0.1%酚红指示剂:0.1g苯酚红溶于100ml 95%乙醇溶液;结晶尿素;三、方法:将试样粉碎,准确称取0.05±0.001g试样于25ml纳式比色管,加入0.2g结晶尿素及5滴酚红指示剂,加入25ml蒸馏水,摇动10s,立即置于30±0.5℃水浴锅中,开始计时,观察溶液颜色变化, 5min 后,取出比色管,摇匀,观察溶液颜色。
空白试验:不加尿素,其他同上。
品质判定:如果溶液为明显的粉红色,则认为该大豆制品脲酶活性超标,为不合格产品。
•0-1min变红,活性非常强(>1.0);•1-2min变红,活性大概0.5-1.0;•2-5min变红,活性大概0.3-0.5。
四、注意事项:1.粉碎样品时,不应产生大量热,否则会影响结果判定;2.称量样品时,一定要将样品混合均匀,否则会造成试验误差;3.试样和空白试验同时操作,过程要迅速,防止时间影响。
尿素-酚红法一、原理:酚红指示剂在pH 6.4-8.2时由黄变红,大豆制品中所含的尿素酶可将尿素水解产生氨,释放的氨可使酚红指示剂变红,根据变红样品占所有样品的比例来判断脲酶活性的大小。
二、仪器和试剂:表面皿;0.2N氢氧化钠溶液:称取0.8g氢氧化钠溶于100ml蒸馏水;1.0N硫酸溶液:移取7.0ml浓硫酸溶于500ml蒸馏水;尿素-酚红试剂:用500ml烧杯将0.8g酚红溶于20ml 0.2N氢氧化钠溶液,用蒸馏水稀释至约300ml,加入60g尿素,并溶解之,转移至2L容量瓶,冲洗烧杯数次,加蒸馏水至约1.5L,加入9.4ml 1.0N 硫酸溶液,用蒸馏水定容至2L;此时溶液应具有明亮的琥珀色;(过段时间溶液会变为深橘红色,可滴入稀硫酸溶液搅拌之,直至溶液再次变为琥珀色)三、方法:将一满匙样品放入表面皿中,摊平,将以调好的尿素-酚红试剂滴入表面皿中的样品上,直至完全浸湿,停留5min,观察样品的颜色反应。


脲酶的测定方法一、脲酶测定(比色法)脲酶是对尿素转化起关键作用的酶,它的酶促反应产物是可供植物利用的氮源,它的活性可以用来表示土壤供氮能力。
1、试剂配制:(1)pH6.7柠檬酸盐溶液:取368g柠檬酸溶于600mL蒸馏水中,另取295g 氢氧化钾溶于水,再将两种溶液合并,用1N氢氧化钠将pH调至6.7,并用水稀释至2L。
(2)苯酚钠溶液:称取62.5g苯酚溶于少量乙醇中,加2mL甲醇和18.5mL 丙酮,后用乙醇稀释至100mL(A液),保存再冰箱中。
称取27g氢氧化钠溶于100mL水中(B液),保存于冰箱中。
使用前,取A、B两液各20mL混和,并用蒸馏水稀释至100mL备用。
(3)次氯酸钠溶液:用水稀释制剂至活性氯的浓度为0.9%,(1.9g次氯酸钠溶于1L水中)溶液稳定。
(4)10%尿素溶液:10g尿素溶于100mL水中。
(5)N的标准溶液:精确称取0.4717g硫酸铵溶于水稀释至1L,则得1mL 含0.1mgN的标液,再将此液稀释10倍制成氮工作液(0.01mg/mL)。
2、操作步骤称取5g土置于50mL容量瓶中,加1mL甲苯处理,加塞塞紧轻摇15min;往瓶中加入5mL10%尿素液和10mL的柠檬酸盐缓冲液(pH6.7),仔细混匀。
在37℃恒温箱中培养24h。
然后用热至38℃的蒸馏水稀释至刻度(甲苯应浮在刻度以上),摇荡,将悬液过滤。
取滤液1mL置于50mL容量瓶中,用蒸馏水稀释至10mL,然后加入4mL苯酚钠溶液,并立即加入3mL次氯酸钠溶液,加入每一试剂后,立即将混合物摇匀,20min后,将混合物稀释至刻度,在波长578nm处测定吸光值。
脲酶活性以样品所得的吸光值减去对照样品吸光值之差,根据标准曲线求出氨态氮量。
标准曲线绘制:分别取0、1、3、5、7、9、11、13mL氮工作液置于50mL容量瓶中,加蒸馏水至20mL,再加4mL苯酚钠溶液和3mL次氯酸钠溶液,随加随摇匀,20min后显色,定容。
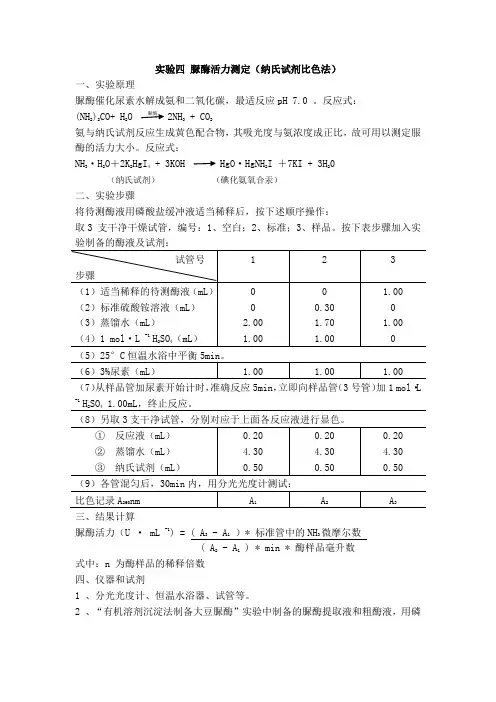
实验四 脲酶活力测定(纳氏试剂比色法)一、实验原理脲酶催化尿素水解成氨和二氧化碳,最适反应pH 7.0 。
反应式: (NH 2)2CO+ H 2O 脲酶2NH 3 + CO 2氨与纳氏试剂反应生成黄色配合物,其吸光度与氨浓度成正比,故可用以测定服酶的活力大小。
反应式:NH 3·H 2O +2K 2HgI 4 + 3KOH HgO ·HgNH 2I +7KI + 3H 20 (纳氏试剂) (碘化氨氧合汞) 二、实验步骤将待测酶液用磷酸盐缓冲液适当稀释后,按下述顺序操作:取3 支干净干燥试管,编号:1、空白;2、标准;3、样品。
按下表步骤加入实(7)从样品管加尿素开始计时,准确反应5min ,立即向样品管(3号管)加1 mol ·L -1H 2SO 4 1.00mL ,终止反应。
三、结果计算脲酶活力(U · mL -1) = ( A 3 - A 1 )* 标准管中的NH 3微摩尔数 ( A 2 - A 1 ) * min * 酶样品毫升数 式中:n 为酶样品的稀释倍数 四、仪器和试剂1 、分光光度计、恒温水浴器、试管等。
2 、“有机溶剂沉淀法制备大豆脲酶”实验中制备的脲酶提取液和粗酶液,用磷酸盐缓冲液适当稀释。
3 、3 %尿素底物溶液:3g 高纯尿素用磷酸盐缓冲液溶解,并定容至100mL 。
4 、磷酸盐缓冲液(pH7.0):6.70 g Na2HPO4 ·2 H2O , 3.25 g KH2PO4 ,溶于蒸馏水并定容至100 mL 。
5 、1 mol·L -1 H2SO4溶液:56mL 浓硫酸,缓慢加入盛有约600 mL 蒸馏水的容量瓶中,冷却后加水定容至1000mL。
6 、硫酸铵标准溶液:称取在60°C干燥至恒重的分析纯硫酸铵1.322g,蒸馏水溶解,并定容至100mL 。
此溶液含NH3为40μmol·mL-1。
7 、纳氏试剂:分别溶解3 . 5g 氯化高汞(HgCl2)于20mL热蒸馏水,10g碘化钾于5 mL水中,再将前者慢慢倒入碘化钾溶液中,不断搅拌,直至出现微红色的少量沉淀为止。

不同方法测定大豆脲酶活性的比较研究杨奇慧舒璐钟剑锋摘要:用滴定法和增值法测定大豆粉在85℃和140℃下分别热处理0、45、90、135、180min的脲酶活性,并用0.2%KOH溶解法测定大豆粉在不同热处理下的蛋白质溶解度。
结果表明:在85℃条件下,处理0~180min 大豆粉的脲酶活性和蛋白质溶解度随着时间延长无明显变化;而在140℃条件下,大豆粉的脲酶活性和蛋白质溶解度随着处理时间的延长显著降低。
通过测定结果可见,同一样品用滴定法和增值法测得的脲酶活性在数值上不相等,不能互用,但蛋白质溶解度更能反映大豆粉受热过度的程度。
关键词:大豆粉;脲酶活性;蛋白质溶解度;pH增值法;滴定法众所周知,大豆含有较丰富的蛋白质、脂肪、碳水化合物等,是饲料生产中主要的植物蛋白质源之一,具有较高营养价值。
但是,大豆中含有多种抗营养因子,如蛋白酶抑制因子、植物凝集素、胃肠胀气因子、抗维生素因子、抗原蛋白等,这些抗营养因子阻碍营养物质在动物体内的利用,尤其是胰蛋白酶抑制因子的存在不仅会降低饲料营养成分的消化率和适口性,而且也会影响动物对蛋白质的消化吸收,对动物生长发育也产生不良的影响。
但是,胰蛋白酶抑制因子的测定较困难,而豆粕中脲酶活性与胰蛋白酶抑制因子活性呈正相关,所以通常通过测定脲酶活性来反映蛋白酶抑制因子的活性。
目前,脲酶活性的测定方法有滴定法(国标法)、pH增值法等,目前,对脲酶活性不同测定方法差异性的研究较少,本文拟对两种方法进行研究,以比较不同方法对测定结果的影响,为实际生产和理论研究提供依据和参考。
1 材料和方法1.1 实验材料大豆粉:将生大豆粉碎,过60目标准筛。
在85℃和140℃下分别处理0、45、90、135和180min冷却后装入封口袋保存备用。
1.2 化学试剂本实验所用试剂均为分析纯(AR),实验用水为蒸馏水。
1.3 测定方法1.3.1 pH增值法实验原理:将研细的试样与尿素缓冲液混合,尿素在尿素酶作用下水解产生氨,使溶液pH 值改变,改变的程度与脲酶活性大小相关,因此可以用其与空白溶液的差值表示脲酶活性高低,单位为△pH值。

随着膨化技术在饲料工业中推广普及,越来越多的饲料生产商在配方中使用膨化大豆粉,与其它蛋白资源一样,大豆的适度熟化非常重要,熟化程度低会含抗胰蛋白酶等营养抑制因子,熟化度过高又会导致氨基酸利用率低。
判断膨化大豆粉是否合格的主要指标是脲酶活性。
脲酶活性是指:在30±5℃和PH值等于7的条件下,每分钟每克膨化大豆分解尿素所释放的氨态氮的毫克数。
脲酶本身无营养意义,但它与抗胰蛋白酶的含量接近,并且遇热变性失活的程度与抗胰蛋白酶相似,因此,尿酶活性用来作为膨化大豆加热是否合适的间接估测指标。
脲酶活性没有负值,最低为0。
在我国现行的国标推荐值为0.3,在美国一般认为以不超过0.2为宜,并且针对日粮中有尿素的反刍动物而言不得超过0.12,当然对于家禽和猪0.3或稍高都可以接受。
国内很多大企业一般均采用0.2。
实验室定量测定脲酶活性的方法较复杂,有滴定法和pH增值法两种,已有研究表明两者对同一样品测得的数值也不相等。
目前国内绝大部分企业都采用快速而简单的简易判定方法定性地估测脲酶活性,一般来说,主要有如下两种方法。
一.液态法1.原理:大豆制品中的脲酶可使尿素分解成氨,会使酚红指示剂改变颜色。
2.试剂2.1尿素:GB696,分析纯。
2.2酚红指示剂2.2.1称取0.1g酚红,加1.43mL0.1mol/L氢氧化钠溶液,在研钵中研磨以促溶解;2.2.2转移至250mL定量瓶中,加蒸馏水至刻度,摇匀备用。
3.操作方法3.1取0.2g粉末样品,置于25mL比色管中。
3.2加0.02g尿素,加酚红指示剂2滴,再加水20mL,充分摇匀15s。
3.3记录粉红色出现时间,并根据时间判断尿酶活性,颜色出现时间应少于15min。
颜色出现时间脲酶活性1min 极强1~5min 强5~15min 稍有15min 无同时作空白对照试验。
样品空白(不加尿素)及试剂空白(不加样品),只有上述空白正常时,即酚红指示剂不改变颜色,试验结果才是可靠的。


脲酶测定方法(参考土壤脲酶活性两种测定方法的比较)比色法标准曲线:以尿素为基质,根据脲酶酶促产物氨在碱性介质中,与苯酚一次氯酸钠作用(在碱性溶液中及在亚硝基铁氰化钠催化剂存在下)生成蓝色的靛酚来分析脲酶活性[6]。
精确称取0.471 7 g硫酸铵溶于水并稀释至1 000mL,则得含氮0.1 mg/mL的标准液。
绘制标准曲线时可再将此液稀释10倍供用。
吸取稀释的标准液1、3、5、7、9、11、13 mL,移于50 mL容量瓶中,加蒸馏水至20 mL,再加4 mL 苯酚钠溶液和3 mL次氯酸钠溶液,随加随摇匀。
20 min后显色、定容。
1 h内在分光光度计上波长578 nm处比色。
以光密度值为纵坐标、以氨的浓度为横坐标绘制标准曲线。
步骤:取5 g风干土盛于50 mL三角瓶中,加入1 mL甲苯。
15 min 后加10 mL 10%尿素溶液和20 mL pH值6.7的柠檬酸盐缓冲液,摇匀,在37℃恒温箱中培养24 h。
过滤后取3 mL滤液注入50 mL容量瓶中,加蒸馏水至20 mL。
再加4 mL苯酚钠溶液和3 mL次氯酸钠溶液,随加随摇匀,20 min后显色、定容。
l h内在分光光度计上波长578 nm处比色。
脲酶活性:以24 h后1 g土壤中含NH3一N的毫克数表示。
NH3一N(mg)=2a (1)式中:a为从标准曲线查得的NH3一N毫克数;2为换算成1 g土的系数。
脱氢酶活性测定(1)TPF标准曲线的绘制(2)与干净的20mL据塞试管中,依次加入2mL0.5MTris-HCL缓冲液(pH=7.6)、2mL蒸馏水和2mL不同浓度的TTC标准溶液(2、4、8、12、16、20、24mg/mL),然后加入0.1g低亚硫酸钠(保险粉),振荡摇匀。
待充分显色后,加入5mL甲苯,振荡萃取TPF,上清液于485nm处测定吸光度值。
以TPF的浓度为横坐标,以OD485值为纵坐标绘制标准曲线。
(3)操作步骤称取5g土壤样品,置于干净具塞试管中,每支试管加入2mL1%的TTC溶液,2mL蒸馏水,充分混匀。

脲酶定性的实验随着膨化技术在饲料工业中推广普及,越来越多的饲料生产商在配方中使用膨化大豆粉,与其它蛋白资源一样,大豆的适度熟化非常重要,熟化程度低会含抗胰蛋白酶等营养抑制因子,熟化度过高又会导致氨基酸利用率低.判断膨化大豆粉是否合格的主要指标是脲酶活性.脲酶活性是指:在30±5℃和PH值等于7的条件下,每分钟每克膨化大豆分解尿素所释放的氨态氮的毫克数.脲酶本身无营养意义,但它与抗胰蛋白酶的含量接近,并且遇热变性失活的程度与抗胰蛋白酶相似,因此,尿酶活性用来作为膨化大豆加热是否合适的间接估测指标.脲酶活性没有负值,最低为0.在我国现行的国标推荐值为0.3,在美国一般认为以不超过0.2为宜,并且针对日粮中有尿素的反刍动物而言不得超过0.12,当然对于家禽和猪0.3或稍高都可以接受.国内很多大企业一般均采用0.2.实验室定量测定脲酶活性的方法较复杂,有滴定法和pH增值法两种,已有研究表明两者对同一样品测得的数值也不相等.目前国内绝大部分企业都采用快速而简单的简易判定方法定性地估测脲酶活性,一般来说,主要有如下两种方法.一.液态法1.原理:大豆制品中的脲酶可使尿素分解成氨,会使酚红指示剂改变颜色.2.试剂2.1尿素:GB696,分析纯.2.2酚红指示剂2.2.1称取0.1g酚红,加1.43mL0.1mol/L氢氧化钠溶液,在研钵中研磨以促溶解;2.2.2转移至250mL定量瓶中,加蒸馏水至刻度,摇匀备用.3.操作方法3.1取0.2g粉末样品,置于25mL比色管中.3.2加0.02g尿素,加酚红指示剂2滴,再加水20mL,充分摇匀15s.3.3记录粉红色出现时间,并根据时间判断尿酶活性,颜色出现时间应少于15min. 颜色出现时间脲酶活性1min 极强1~5min 强5~15min 稍有15min 无同时作空白对照试验.样品空白(不加尿素)及试剂空白(不加样品),只有上述空白正常时,即酚红指示剂不改变颜色,试验结果才是可靠的.一般企业认为7、8分钟变色较为合适.二、半固态法1.原理:大豆制品中的脲酶可使尿素分解成氨,会使酚红指示剂改变颜色.2.试剂2.1稀硫酸(H2SO4)0.2N.2.2尿素一酚红试剂2.2.1将1.2克酚红溶解于30ml0.2N的NaOH中;2.2.2用蒸馏水将之稀释至约300mL;2.2.3加入90g尿素(分析纯)并溶解之;2.2.4用蒸馏水稀释至2L;2.2.5加入14mL 1.0N的H2SO4或70mL o.2N的H2SO4;2.2.6用蒸馏水稀释至最后体积3L;2.2.7溶液应具明亮的琥珀色.3.操作方法3.1在一个150ml的烧杯中倒入少量试剂,注意溶液必须呈明亮的琥珀色.若溶液已转变为深桔红色,滴人稀硫酸溶液并搅拌之,直至溶液再度呈琥珀色.3.2量一匙粉末样品,放置于培养皿中.3.在样品上加入两匙试剂,轻轻搅拌,将样品平铺于培养皿中.若仍有干样品斑点,则再加入试剂,直至将样品浸湿.4.放置5分钟后观察:a. 没有任何红点出现:再任其放置25分钟,若仍无红点出现,说明大豆粉过熟.b. 有少量红点:少量尿素酶活性,可用.c. 样品表面约有25%为红点覆盖:少量尿素酶活性,可用.d. 豆饼表面约有50%为红点覆盖:尿素酶活性较高,不可以使用.e. 豆饼表面的75%-100%为红点覆盖:尿素酶活性很高,样品过生,不能使用. 以上两种简易脲酶活性估测方法在国内各饲料厂被广泛采用,尤其是后者在膨化大豆粉生产的在线检测上很普遍.尽管这两种方法原理一样,但是,因其操作过程差异,所以对膨化大豆粉品质的反映内容也不尽相同.三、液态法和半固态法之比较首先需要说明的是,这两种脲酶活性快速检测方法没有行业约定俗成的名称,笔者接触过的企业均只采用其中的一种方法,对前者可以称之为“试管法”,后者称之为“表面皿法”,根据其实施的过程及样品的状态,笔者将其区分为“液态法”和“半固态法”.从实施方法来看,液态法是过程检测,从开始一直到规定时间段结束,而半固态法属于断点检测,是5分钟后看结果;液态法通过控制各个体合格,总体自然合格,而半固态法要求的是总体符合统计学上的合格,即允许部分个体不合格.简单地说,液态法要求每一个微粒的熟化程度均要满足5分钟以内不变色,如果一个不合格,整个批次为不合格;而半固态法允许部分微粒在5分钟内变色,部分不合格,总体可以是合格的.从这点上来说,液态法对膨化大豆粉的品质要求更高,控制更严格,不仅要求熟化,而且要均匀熟化.举例说明,如果在熟化完全的大豆粉样品中掺入微量(可以是一粒)生大豆粉,液态法会立即变色从而判定为不合格,而半固态法只是增加了一个变色点,总体上仍是合格的.从上可以看出,这两种检测方法对膨化大豆粉品质的反映内容是不一样的.半固态法反映的是产品符合统计学上的合格,而液态法反映的是完全合格.这两种不同检测方法对膨化设备的要求也是有差别的,液态法要求设备能均匀熟化,而半固态法允许产品出现部分不合格,只要总体上符合就可以,对膨化设备的要求自然要低. 可能会有人疑问,膨化大豆粉出来的不都应该是均匀一致的吗?其实不然,物料在膨化机内受到湿、热、机械剪切的共同作用从而熟化,机械剪切对膨化大豆粉所起的作用大约能占三成多,如果结构设计上缺陷或部件磨损,就会导致熟化不均匀.目前湿法膨化大豆粉的出料温度大都在135度左右(对家禽和猪要求可能低点),六年前,笔者曾遇到过膨化大豆粉出料温度在170度,用液态法检测仍不合格,出来的料有熟的,有褐变的,还有少许夹生的,如果用半固态法检测,估计就合格了.次年,一膨化厂使用某企业膨化机生产膨化大豆粉,因不熟被退货六十吨,根据大部分企业采用半固态法检测的情况,将其以一定比例掺入熟化料中,最终符合统计学上的合格.上述事件,大概就是这两种不同测定方法的实践意义吧.脲酶urease(水解酶):脲酶试验原理:存在于大多数细菌、真菌和高等植物里.它是一种酰胺酶、能酶促有机物质分子中酶键的水解.脲酶的作用是极为专性的,它仅能水解尿素,水解的最终产物是氨和碳酸.土壤脲酶活性,与土壤的微生物数量、有机物质含量、全氮和速效磷含量呈正相关.根际土壤脲酶活性较高,中性土壤脲酶活性大于碱性土壤.人们常用土壤脲酶活性表征土壤的氮素状况.土壤中脲酶活性的测定是以脲素为基质经酶促反应后测定生成的氨量,也可以通过测定未水解的尿素量来求得.本方法是测定生成的氨量.试剂:1)甲苯2)10%尿素:称取10g尿素,用水溶至100ml.3)柠檬酸盐缓冲液(PH6.7):184克柠檬酸和147.5克氢氧化钾溶于蒸馏水.将两溶液合并,用1mol/LNaOH将PH调至6.7,用水稀释至1000毫升.4)苯酚钠溶液(1.35mol/L):62.5克苯酚溶于少量乙醇,加2毫升甲醇和18.5毫升丙酮,用乙醇稀释至100毫升(A),存于冰箱中;27克NaOH溶于100毫升水(B).将AB溶液保存在冰箱中.使用前将2溶液各20毫升混合,用蒸馏水稀释至100毫升.5)次氯酸钠溶液:用水稀释试剂,至活性氯的浓度为0.9%,溶液稳定.6)氮的标准溶液:a 精确称取0.4717克硫酸铵溶于水并稀释至1000ml,得到1ml 含有0.1mg氮的标准液标准曲线绘制:吸取配置好的氮溶液10ml,定容至100ml,即稀释了10倍,吸取1,3,5,7,9,11,13ml移至50ml容量瓶,加水至20ml,再加入4ml苯酚钠,仔细混合,加入3ml次氯酸钠,充分摇荡,放置20分钟,用水稀释至刻度.将着色液在紫外分光光度计上于578nm处进行比色测定,以标准溶液浓度为横坐标,以光密度值为纵坐标绘制曲线图.取新鲜土壤7份,每份30g,装于棕色广口瓶中,先将1,3-二氯丙烯溶于丙酮(定量),6份分别加入不同浓度均为1.5ml的1,3-二氯丙烯,使之在土壤中的浓度分别为1、10、50、100、200、500µg/g,另1份相应加入1.5ml的丙酮作为对照,然后调节土壤的含水量至最大田间持水量的60%(记录此时重量,以便补充水分).放置于25℃恒温培养箱,培养后第0d、1d,5d,10d(前10d密封,后来测定的敞口)、20d,30d,40d,50d分别取土样检测脲酶的活性.取样前,反复旋转广口瓶,混匀土样,一个处理随机取3个重复.1) 称取5g过1mm筛的风干土样于100ml容量瓶中.2) 向容量瓶中加入1ml甲苯(以能全部使土样湿润为度)并放置15分钟3) 之后加入10ml 10%尿素溶液和20ml柠檬酸缓冲液(PH6.7),并仔细混合4) 将容量瓶放入37摄氏度恒温箱中,培养24h5) 培养结束后,用热至38摄氏度水稀释至刻度,仔细摇荡,并将悬液用致密滤纸过滤于三角瓶中.6) 显色:吸取3ml滤液于50ml容量瓶中,加入10ml蒸馏水,充分震荡,然后加入4ml苯酚钠,仔细混合,再加入3ml次氯酸钠,充分摇荡,放置20分钟,用水稀释至刻度,溶液呈现(青定)酚的蓝色.7) 1h内在((青定)酚的蓝色在1h内保持稳定)在分光光度计上用1cm液槽,于578nm处将显色液进行比色测定.8) 无土对照:不加土样,其他操作与样品实验相同.以检验试剂纯度,整个实验设置一个对照9)无基质对照:以等体积的水代替基质,其他操作与样品实验相同.每个土样都设此对照.结果计算:土壤脲酶活性以24小时后100g土壤中NH3-N的毫克数表示.M=(X样品-X无土-X无基质)*100*10式中:M-土壤脲酶活性值X样品――样品实验的光密度值在标准曲线上对应的NH3-N毫克数X无土――无土对照实验中的光密度值在标准曲线上对应的NH3-N毫克数X无基质――无基质对照实验中的光密度值在标准曲线上对应的NH3-N毫克数100 ――样品定容的体积与测定时吸取量的比值10 ――酶活性单位的土重与样品土重之比值注意事项:当脲酶活性为3-80微克NH3-N时,本法能获得可靠结果.当脲酶活性小于3微克NH3-N,培养时间需增至24小时(已经24h了)(计算时应考虑这一点)计算:脲酶活性以24h后1g土壤中NH3-N的mg数表示.NH3-N(mg)=a*2A:从标准曲线查得NH3-N毫克数2 :换算成1k土的系数.。
一、实验目的1. 了解脲酶的催化特性,掌握脲酶催化反应的原理;2. 掌握脲酶定性实验的操作方法;3. 通过实验观察脲酶催化反应的现象,验证脲酶的催化活性。
二、实验原理脲酶是一种催化脲水解的酶,其催化反应的化学方程式为:脲+ H2O → CO2 + NH3在本实验中,我们利用脲酶催化脲水解产生CO2和NH3的特性,通过观察溶液pH 的变化来验证脲酶的催化活性。
当脲酶催化脲水解时,生成的NH3会与溶液中的酸反应,使溶液pH值升高,当溶液pH值达到一定范围时,指示剂会发生颜色变化,从而验证脲酶的催化活性。
三、实验材料与仪器1. 实验材料:(1)脲酶试剂;(2)脲标准溶液;(3)NaOH标准溶液;(4)酚酞指示剂;(5)pH计;(6)锥形瓶;(7)移液管;(8)烧杯。
2. 实验仪器:(1)分析天平;(2)滴定管;(3)水浴锅;(4)磁力搅拌器。
四、实验步骤1. 配制脲酶溶液:将脲酶试剂溶解于适量的去离子水中,配制成一定浓度的脲酶溶液。
2. 配制脲标准溶液:准确称取一定量的脲,溶解于去离子水中,配制成一定浓度的脲标准溶液。
3. pH计校准:将pH计置于水浴锅中,加入去离子水,用pH计测量水的pH值,根据测量结果校准pH计。
4. 取锥形瓶,加入一定量的脲标准溶液。
5. 用移液管加入一定量的脲酶溶液,使脲酶与脲反应。
6. 将锥形瓶放入水浴锅中,保持一定的温度,使反应进行。
7. 在反应过程中,用pH计测量溶液的pH值,观察pH值的变化。
8. 当溶液pH值达到一定范围时,加入酚酞指示剂,观察溶液颜色变化。
9. 记录实验数据,包括脲酶溶液浓度、脲标准溶液浓度、反应时间、溶液pH值等。
五、实验结果与分析1. 实验现象:在脲酶催化下,脲水解产生CO2和NH3,使溶液pH值升高,当溶液pH值达到一定范围时,加入酚酞指示剂,溶液颜色由无色变为粉红色。
2. 结果分析:通过实验观察到,脲酶催化脲水解反应具有明显的催化活性,能够使溶液pH值发生变化,且加入酚酞指示剂后溶液颜色发生变化,进一步验证了脲酶的催化活性。
两种脲酶活性定性测定方法及比较随着膨化技术在饲料工业中推广普及,越来越多的饲料生产商在配方中使用膨化大豆粉,与其它蛋白资源一样,大豆的适度熟化非常重要,熟化程度低会含抗胰蛋白酶等营养抑制因子,熟化度过高又会导致氨基酸利用率低。
判断膨化大豆粉是否合格的主要指标是脲酶活性。
脲酶活性是指:在30±5℃和PH值等于7的条件下,每分钟每克膨化大豆分解尿素所释放的氨态氮的毫克数。
脲酶本身无营养意义,但它与抗胰蛋白酶的含量接近,并且遇热变性失活的程度与抗胰蛋白酶相似,因此,尿酶活性用来作为膨化大豆加热是否合适的间接估测指标。
脲酶活性没有负值,最低为0。
在我国现行的国标推荐值为0.3,在美国一般认为以不超过0.2为宜,并且针对日粮中有尿素的反刍动物而言不得超过0.12,当然对于家禽和猪0.3或稍高都可以接受。
国内很多大企业一般均采用0.2。
实验室定量测定脲酶活性的方法较复杂,有滴定法和pH增值法两种,已有研究表明两者对同一样品测得的数值也不相等。
目前国内绝大部分企业都采用快速而简单的简易判定方法定性地估测脲酶活性,一般来说,主要有如下两种方法。
一.液态法1.原理:大豆制品中的脲酶可使尿素分解成氨,会使酚红指示剂改变颜色。
2.试剂2.1尿素:GB696,分析纯。
2.2酚红指示剂2.2.1称取0.1g酚红,加1.43mL0.1mol/L氢氧化钠溶液,在研钵中研磨以促溶解;2.2.2转移至250mL定量瓶中,加蒸馏水至刻度,摇匀备用。
3.操作方法3.1取0.2g粉末样品,置于25mL比色管中。
3.2加0.02g尿素,加酚红指示剂2滴,再加水20mL,充分摇匀15s。
3.3记录粉红色出现时间,并根据时间判断尿酶活性,颜色出现时间应少于15min。
颜色出现时间脲酶活性1min 极强1~5min 强5~15min 稍有15min 无同时作空白对照试验。
样品空白(不加尿素)及试剂空白(不加样品),只有上述空白正常时,即酚红指示剂不改变颜色,试验结果才是可靠的。
土壤脲酶活性两种测定方法的比较丰 骁1,段建平2,蒲小鹏1,邹 雨1,李春荣1(1.甘肃农业大学草业学院,甘肃兰州 730070;2.清水县农牧局,甘肃天水 741400) 摘要:利用比色法和扩散法对金强河地区和甘肃农业大学校园内的土壤脲酶活性进行了分析。
结果表明:比色法和扩散法测定的土壤脲酶活性平均值分别为(0.531±0.207)mg/g和(0.446±0.204) mg/g,两种测定方法的结果和变异系数差异均不显著(P>0.05)。
但从试验操作方面考虑,扩散法操作比较简单、所用药品种类少、时间短,是一种比较可行的土壤脲酶活性测定方法。
关键词:脲酶活性;比色法;扩散法 中图分类号:S154.2 文献标识码:A 文章编号:100925500(2008)022******* 土壤酶是存在于土壤中的生物催化剂,土壤中所进行的一切生物化学过程都要经过酶的催化才能完成。
脲酶作用是极为专性的,它能水解土壤中的尿素,生成氨,二氧化碳和水[1-7],因此,脲酶测定可为退化草地生态评价提供参考。
土壤脲酶活泩的测定方法较多[6],常用的方法有比色法,扩散法和电极法等,根据试验仪器的普遍性和易操作性,分别用比色法和扩散法对土壤样品脲酶活性进行了对比分析。
1 材料和方法1.1 试验地概况 土壤采样地点2个,甘肃农业大学天祝高山草原定位试验站(样地Ⅰ)和甘肃农业大学牧草引种圃(样地Ⅱ)。
2007年4月中旬,分别在2个样地采集土样。
用五点混合采样法采集土样,均为0~20cm处表层土壤,采集后风干,弃去砂石和植物残体,过1mm筛后放在通风、干燥处待测。
1.1.1 甘肃农业大学天祝高山草原试验站概况 该试验站地处E102°23′~102°29′,N37°11′~37°13′,海拔2950~4300m;年均温-0.1℃,年降水量416 mm,年蒸发量1592mm,常发生春旱;无绝对无霜期; 收稿日期:2007209221;修回日期:2007211205 基金项目:草业生态系统教育部省部共建重点实验室项目资助 作者简介:丰骁(19822),男,江苏南通人,在读硕士。
两种脲酶活性定性测定方法及比较
随着膨化技术在饲料工业中推广普及,越来越多的饲料生产商在配方中使用膨化大豆粉,与其它蛋白资源一样,大豆的适度熟化非常重要,熟化程度低会含抗胰蛋白酶等营养抑制因子,熟化度过高又会导致氨基酸利用率低。
判断膨化大豆粉是否合格的主要指标是脲酶活性。
脲酶活性是指:在30±5℃和PH值等于7的条件下,每分钟每克膨化大豆分解尿素所释放的氨态氮的毫克数。
脲酶本身无营养意义,但它与抗胰蛋白酶的含量接近,并且遇热变性失活的程度与抗胰蛋白酶相似,因此,尿酶活性用来作为膨化大豆加热是否合适的间接估测指标。
脲酶活性没有负值,最低为0。
在我国现行的国标推荐值为0.3,在美国一般认为以不超过0.2为宜,并且针对日粮中有尿素的反刍动物而言不得超过0.12,当然对于家禽和猪0.3或稍高都可以接受。
国内很多大企业一般均采用0.2。
实验室定量测定脲酶活性的方法较复杂,有滴定法和pH增值法两种,已有研究表明两者对同一样品测得的数值也不相等。
目前国内绝大部分企业都采用快速而简单的简易判定方法定性地估测脲酶活性,一般来说,主要有如下两种方法。
一.液态法
1.原理:大豆制品中的脲酶可使尿素分解成氨,会使酚红指示剂改变颜色。
2.试剂
2.1尿素:GB696,分析纯。
2.2酚红指示剂
2.2.1称取0.1g酚红,加1.43mL0.1mol/L氢氧化钠溶液,在研钵中研磨以促溶解;
2.2.2转移至250mL定量瓶中,加蒸馏水至刻度,摇匀备用。
3.操作方法
3.1取0.2g粉末样品,置于25mL比色管中。
3.2加0.02g尿素,加酚红指示剂2滴,再加水20mL,充分摇匀15s。
3.3记录粉红色出现时间,并根据时间判断尿酶活性,颜色出现时间应少于15min。
颜色出现时间脲酶活性
1min 极强
1~5min 强
5~15min 稍有
15min 无
同时作空白对照试验。
样品空白(不加尿素)及试剂空白(不加样品),只有上述空白正常时,即酚红指示剂不改变颜色,试验结果才是可靠的。
一般企业认为7、8分钟变色较为合适。
二、半固态法
1.原理:大豆制品中的脲酶可使尿素分解成氨,会使酚红指示剂改变颜色。
2.试剂
2.1稀硫酸(H2SO4)0.2N。
2.2尿素一酚红试剂
2.2.1将1.2克酚红溶解于30ml0.2N的NaOH中;
2.2.2用蒸馏水将之稀释至约300mL;
2.2.3加入90g尿素(分析纯)并溶解之;
2.2.4用蒸馏水稀释至2L;
2.2.5加入14mL 1.0N的H2SO4或70mL o.2N的H2SO4;
2.2.6用蒸馏水稀释至最后体积3L;
2.2.7溶液应具明亮的琥珀色。
3.操作方法
3.1在一个150ml的烧杯中倒入少量试剂,注意溶液必须呈明亮的琥珀色。
若溶液已转变为深桔红色,滴人稀硫酸溶液并搅拌之,直至溶液再度呈琥珀色。
3.2量一匙粉末样品,放置于培养皿中。
3.在样品上加入两匙试剂,轻轻搅拌,将样品平铺于培养皿中。
若仍有干样品斑点,则再加入试剂,直至将样品浸湿。
4.放置5分钟后观察:
a.没有任何红点出现:再任其放置25分钟,若仍无红点出现,说明大豆粉过熟。
b.有少量红点:少量尿素酶活性,可用。
c.样品表面约有25%为红点覆盖:少量尿素酶活性,可用。
d.豆饼表面约有50%为红点覆盖:尿素酶活性较高,不可以使用。
e.豆饼表面的75%-100%为红点覆盖:尿素酶活性很高,样品过生,不能使用。
以上两种简易脲酶活性估测方法在国内各饲料厂被广泛采用,尤其是后者在膨化大豆
粉生产的在线检测上很普遍。
尽管这两种方法原理一样,但是,因其操作过程差异,所以对膨化大豆粉品质的反映内容也不尽相同。
三、液态法和半固态法之比较
首先需要说明的是,这两种脲酶活性快速检测方法没有行业约定俗成的名称,笔者接触过的企业均只采用其中的一种方法,对前者可以称之为“试管法”,后者称之为“表面皿法”,根据其实施的过程及样品的状态,笔者将其区分为“液态法”和“半固态法”。
从实施方法来看,液态法是过程检测,从开始一直到规定时间段结束,而半固态法属于断点检测,是5分钟后看结果;液态法通过控制各个体合格,总体自然合格,而半固态法要求的是总体符合统计学上的合格,即允许部分个体不合格。
简单地说,液态法要求每一个微粒的熟化程度均要满足5分钟以内不变色,如果一个不合格,整个批次为不合格;而半固态法允许部分微粒在5分钟内变色,部分不合格,总体可以是合格的。
从这点上来说,液态法对膨化大豆粉的品质要求更高,控制更严格,不仅要求熟化,而且要均匀熟化。
举例说明,如果在熟化完全的大豆粉样品中掺入微量(可以是一粒)生大豆粉,液态法会立即变色从而判定为不合格,而半固态法只是增加了一个变色点,总体上仍是合格的。
从上可以看出,这两种检测方法对膨化大豆粉品质的反映内容是不一样的。
半固态法反映的是产品符合统计学上的合格,而液态法反映的是完全合格。
这两种不同检测方法对膨化设备的要求也是有差别的,液态法要求设备能均匀熟化,而半固态法允许产品出现部分不合格,只要总体上符合就可以,对膨化设备的要求自然要低。
可能会有人疑问,膨化大豆粉出来的不都应该是均匀一致的吗?其实不然,物料在膨化机内受到湿、热、机械剪切的共同作用从而熟化,机械剪切对膨化大豆粉所起的作用大约能占三成多,如果结构设计上缺陷或部件磨损,就会导致熟化不均匀。
目前湿法膨化大豆粉的出料温度大都在135度左右(对家禽和猪要求可能低点),2001年,笔者曾遇到过膨化大豆粉出料温度在170度,用液态法检测仍不合格,出来的料有熟的,有褐变的,还有少许夹生的,如果用半固态法检测,估计就合格了。
次年,一膨化厂使用某企业膨化机生产膨化大豆粉,因不熟被退货六十吨,根据大部分企业采用半固态法检测的情况,将其以一定比例掺入熟化料中,最终符合统计学上的合格。
上述事件,大概就是这两种不同测定方法的实践意义吧。