动物大脑病理切片
- 格式:docx
- 大小:9.07 MB
- 文档页数:11

摘自:《萱草根素对家兔中枢神经损害的病理学研究》6.2.1 大脑染色观察结果6.2.1.1 大脑 HE 染色结果正常对照组家兔大脑皮质结构清晰,神经细胞结构完整,无炎性细胞浸润。
白质部神经纤维染色均匀,为淡粉红色,排列整齐纹理清晰(图 6-1)。
试验开始后第 4 天,即可发现试验组家兔白质部神经纤维脱髄鞘,神经纤维排列紊乱,结构疏松,此时神经细胞未见明显病变(图 6-2),第 7 天,脱髄鞘进一步加强,髄鞘间的空隙进一步加大,胶质细胞核有所减少,第 10 天,神经细胞胞体固缩,染色较深,有的细胞固缩呈三角形,胞核染色深,结构模糊,核仁不明显(图 6-3),13 d 后,坏死细胞进一步增多,有时胞核和深染的胞质不易区分开来,神经细胞变性、坏死,被胶质细胞吞噬,有明显的“噬神经”现象,胶质细胞增生,有的形成结节(图 6-4),16 d、19 d,细胞坏死普遍,毛细血管扩张,周围有淋巴细胞为主的炎性细胞浸润,白质部神经纤维脱髄鞘,神经纤维排列紊乱,结构疏松,呈丝瓜络样变,胶质细胞核减少(图 6-5)。
6.2.1.2 大脑甲苯胺蓝染色结果正常对照组家兔神经细胞结构清晰,胞核大而圆,核仁粗大清晰可见,胞桨内含有丰富蓝色呈块状的尼氏体,白质中胶质细胞核分布密集(图 6-6),试验组家兔 4 d、7 d未见神经细胞的明显变化,10d,神经细胞固缩,呈三角形或长椭圆形,染色深,胞核结构消失,与胞桨一起染成深蓝色,尼氏体溶解、消失(图 6-7),13 d、16 d、19 d,坏死细胞进一步增多,视野中可见多个坏死的细胞,呈深染的团块状(图 6-8)。
6.2.1.3 大脑透射电镜结果试验组家兔有髄神经纤维髄鞘板层结构疏松,出现较大的空隙,严重的髄鞘断裂(图6-9)。
大脑神经细胞胞膜溶解消失,失去细胞界限,胞桨内细胞器出现严重病变,数目减少,粗面内质网和高尔基体发生扩张,结构不清,线粒体肿胀,嵴断裂、溶解、消失,呈空泡状,有的神经细胞出现明显的细胞内染色体边集现象,核膜消失,粗面内质网扩张,有的神经细胞染色质浓缩,核周间隙扩张,细胞坏死,坏死细胞被胶质细胞黏附和围绕,呈现“噬神经现象”(图 6-10, 6-11, 6-12)。
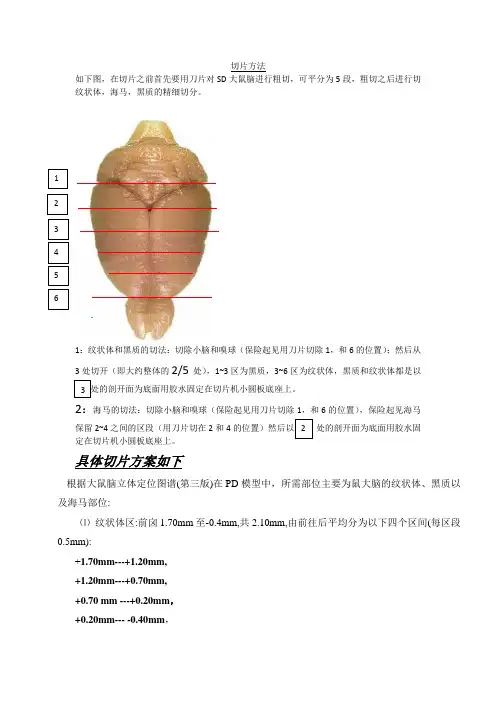
切片方法 如下图,在切片之前首先要用刀片对SD 大鼠脑进行粗切,可平分为5段,粗切之后进行切纹状体,海马,黑质的精细切分。
1:纹状体和黑质的切法:切除小脑和嗅球(保险起见用刀片切除1,和6的位置);然后从3处切开(即大约整体的2/5处),1~3区为黑质,3~6区为纹状体,黑质和纹状体都是以3处处的剖开面为底面用胶水固定在切片机小圆板底座上。
2:海马的切法:切除小脑和嗅球(保险起见用刀片切除1,和6的位置),保险起见海马保留2~4之间的区段(用刀片切在2和4的位置)然后以 处的剖开面为底面用胶水固定在切片机小圆板底座上。
具体切片方案如下根据大鼠脑立体定位图谱(第三版)在PD 模型中,所需部位主要为鼠大脑的纹状体、黑质以及海马部位:⑴ 纹状体区:前囟1.70mm 至-0.4mm,共2.10mm,由前往后平均分为以下四个区间(每区段0.5mm):+1.70mm---+1.20mm,+1.20mm---+0.70mm,+0.70 mm ---+0.20mm ,+0.20mm--- -0.40mm ,12336452+1.70mm---+1.20mm,+1.70mm---+1.20mm, +1.20mm---+0.70mm, +0.70 mm ---+0.20mm,+0.20mm--- -0.40mm,可分为四个小瓶来装片,于10ml 的棕色玻璃瓶中( 内盛6ml的0.01mM PBS,pH7.4配制的5%多聚甲醛溶液),每个区段长度为0.50mm,理论上可切30μm的脑片16张,实际保留时至少保证12张脑片。
并从前到后标明区段1(+1.70mm-+1.20mm),区段2(+1.20mm-+0.70mm),区段3(+0.70mm-+0.2mm),区段4(+0.2mm-- -0.4mm).⑵黑质区:前囟-4.52mm至-6.04mm,共1.52mm,理论上一共可切56张30μm的脑片。
进入脑区-4.16mm后,先连续切100μm的脑片共3片,接着切30μm的脑片共2张,均不保存,理论上此时已到-4.52mm的脑区位置。


动物病理解剖学实验教程动物病理解剖学实验教程是动物医学专业中一门重要的实践课程,旨在通过实验操作,加深学生对动物病理学的理解,提高其病理诊断能力。
以下是一些常见的动物病理解剖学实验教程:1. 实验一:动物病理切片的制作与观察实验目的:通过制作动物病理切片,观察病变部位的组织学变化,学习病理学的基本概念和诊断方法。
实验材料:动物病理组织块、显微镜、切片刀、染色剂等。
实验步骤:(1)将病理组织块放入包埋盒中,用石蜡或树脂等材料进行包埋。
(2)将包埋好的组织块进行切片,制作成病理切片。
(3)将切片放在显微镜下观察,记录病变部位的组织学变化。
(4)对病变部位进行病理诊断,并与正常组织进行对比分析。
2. 实验二:动物尸体剖检与病理诊断实验目的:通过动物尸体剖检,观察动物内脏器官的病理变化,学习病理诊断的方法和技巧。
实验材料:动物尸体、手术刀、手套、器官固定液等。
实验步骤:(1)进行动物尸体剖检前的准备工作,如穿戴手套等。
(2)按照规定的剖检程序,对动物内脏器官进行观察和检查。
(3)记录内脏器官的病理变化,并进行病理诊断。
(4)对病变器官进行组织取样,制作成病理切片,进一步观察病变。
3. 实验三:肿瘤的病理诊断与鉴别实验目的:通过观察动物肿瘤的病理切片,学习肿瘤的分类、分级和鉴别诊断方法。
实验材料:动物肿瘤病理切片、显微镜、染色剂等。
实验步骤:(1)将肿瘤病理切片放在显微镜下观察,记录肿瘤的组织学特征。
(2)根据肿瘤的组织学特征,对肿瘤进行分类和分级。
(3)学习不同类型肿瘤的鉴别诊断方法,对比正常组织与肿瘤组织的差异。
4. 实验四:呼吸系统病理诊断实验目的:通过观察动物呼吸系统的病理变化,学习呼吸系统疾病的诊断方法和技巧。
实验材料:动物呼吸系统病理切片、显微镜、染色剂等。
实验步骤:(1)将呼吸系统病理切片放在显微镜下观察,记录病变部位的组织学变化。
(2)学习呼吸系统疾病的诊断标准和方法,如肺炎、支气管炎等。

动物病理切片观察识别总结
动物病理切片观察识别是一种广泛应用于动物医学和病理学研究领域的技术。
通过对动物组织标本进行切片、染色和显微镜观察,可以识别出不同病变的特征,从而帮助诊断和治疗动物疾病。
在动物病理切片观察识别过程中,首先需要对标本进行固定、包埋和切片处理。
常用的固定剂有福尔马林、乙醛和缓冲液等,固定后的组织样本通常需要进行脱水、清洁和浸渍等步骤,然后通过旋转切片机或冷冻切片机制备成薄片。
接下来,对切片进行染色。
常用的染色方法包括常规组织染色、免疫组织化学染色和特殊染色等。
常规组织染色如血液和组织学染色可以提供组织结构和细胞形态的信息,而免疫组织化学染色则可以检测特定蛋白质的表达情况,帮助确定病变类型。
最后,通过显微镜观察切片,识别出病变的特征。
常见的病变类型包括炎症、肿瘤、退行性变、感染等。
炎症通常表现为组织充血、细胞浸润和炎性细胞的聚集,肿瘤则可见异型细胞、增生结构和核分裂等变化。
退行性变可表现为细胞萎缩、坏死和沉积物的积聚,而感染则可见细菌、寄生虫或病毒的存在。
动物病理切片观察识别在动物疾病的诊断和研究中起着重要作用。
通过观察和分析病理切片,可以准确确定病变类型和程度,指导合理的治疗方案。
此外,病理切片观察识别还可以帮助揭示疾病发生发展的机制,为新药研发和疾病预防提供
科学依据。
总之,动物病理切片观察识别是一项重要的技术,对于动物医学和病理学的发展具有重要意义。
通过对动物组织标本的切片、染色和显微镜观察,可以准确诊断和研究动物疾病,为动物健康提供有效的保障。



小鼠脑组织冰冻切片步骤
嘿,朋友们!今天咱就来讲讲小鼠脑组织冰冻切片那些事儿!这可是个技术活儿呢!
首先啊,你得把小鼠那小脑袋准备好呀。
就像厨师要准备好食材才能做出美味佳肴一样,咱得把小鼠的脑组织小心地取出来。
这可不是随随便便就能搞定的,得轻点儿、柔点儿,别把脑组织给弄坏喽。
然后呢,把脑组织放到专门的冰冻模具里。
这就好比给脑组织找了个小窝,让它舒舒服服地待着。
接下来,把模具放进液氮里速冻,那速度,可快啦,就像闪电一样!
速冻好了,就该切片啦!这就像是在给脑组织做造型呢,不过可得小心别切坏了。
切片机就像是个神奇的魔法工具,能把脑组织切成薄薄的一片片。
想象一下,那薄得像纸一样的切片,多神奇呀!
切好片后,把它们放到载玻片上。
这就像是给这些小切片找到了它们的舞台,准备开始它们的表演啦。
然后再进行一些处理,让这些切片能更好地展示出它们的秘密。
在这个过程中,每一步都得细心细心再细心,就像走钢丝一样,不能有一点儿马虎。
要是不小心出了差错,那可就前功尽弃啦!你说是不是?
哎呀,这小鼠脑组织冰冻切片可真是个有趣又有挑战的活儿呀!每一步都充满了奥秘和技巧。
只有用心去做,才能做出漂亮的切片,才能更好地去研究那些隐藏在脑组织里的秘密。
所以呀,朋友们,要是你们也对这个感兴趣,可得好好记住这些步骤,大胆地去尝试哦!相信你们一定能做出让自己满意的切片,去探索那些神奇的科学世界!这可不是开玩笑的哟,这是实实在在的技术活呢!加油吧!。

如何制作鼠脑切片,并进行免疫荧光组织化学染色?1.组织准备1) 灌注固定:用 100 mg/kg的戊巴比妥溶液腹膜腔注射,使动物深度麻醉;同用心脏灌注的方法,将动物的心脏完全暴露,将灌注的尖针插入动物的左心室,先用约20 ml 的生理盐水冲去体内血液,而后用含 4%(w/v)多聚甲醛的 0.1 M PB 溶液 50 ml 进行灌注固定;2) 取材、后固定、脱水:去除颅骨后将小鼠全脑完整取出,放入上述 4%的多聚甲醛固定液中后固定,4℃后固定 6 -24h,而后将脑组织浸泡于 30%蔗糖溶液中,4℃至组织沉底(72 h左右);3) 包埋切片:分别将脑组织用 OCT 包埋后,用恒冷箱切片机做冠状切片,片厚为40 μm,放入 0.01 M PBS 中,漂洗 3 次后进行后续的组织化学染色。
2. 免疫荧光组织化学染色1) 封闭非特异性抗原:将上述漂洗后的切片用含 1% 山羊血清0.01 M PBS 室温下孵育封闭 40min-1 h;2) 孵育一抗:将封闭后的切片直接放入用抗体稀释液稀释的一抗混合液中,4°摇床孵育过夜;3) 孵育二抗:孵育完一抗的切片用 0.01 M PBS 漂洗后,移入二抗混合液中;室温下孵育 2-5 小时(避光);4) 孵育 FITC 结合的 avidin:最后一组切片用 0.01 M PBS 漂洗后,加入用 0.01 M PBS 稀释的 FITC 结合的 avidin(1: 1, 000),室温下孵育 2 小时;如果抗体带荧光,省略该步骤。
5) 裱片、封片:步骤 3)和步骤 4)中的切片用 0.01 M PBS 漂洗后,在避光环境下裱到干净的载玻片上,晾干后用上述的含抗淬灭剂的荧光封片剂封片(如果抗体带荧光则使用普通载玻片),4℃避光保存。
6)显微镜观察。
一、实验目的本次实验旨在通过观察脑切片,了解大脑的结构和功能,加深对神经科学基础知识的认识。
二、实验原理脑切片观察实验是神经科学实验中常用的方法之一,通过显微镜观察脑切片,可以直观地看到大脑的结构和神经元形态。
实验过程中,需要掌握切片制作、染色和显微镜观察等基本技能。
三、实验材料与仪器1. 实验材料:小鼠大脑、酒精、盐酸、蒸馏水、苏木精、伊红等。
2. 实验仪器:显微镜、切片机、切片盒、载玻片、盖玻片、酒精灯、酒精灯、烧杯、滴管等。
四、实验步骤1. 制备脑切片(1)取新鲜小鼠大脑,置于酒精中固定24小时。
(2)将固定好的大脑放入盐酸中煮沸,使组织蛋白变性,便于切片。
(3)将煮沸后的大脑取出,用蒸馏水冲洗干净。
(4)将冲洗干净的大脑放入切片机中,切成5μm厚的切片。
(5)将切片置于载玻片上,滴加苏木精染色液,染色时间为10分钟。
(6)用蒸馏水冲洗切片,滴加伊红染色液,染色时间为2分钟。
(7)用蒸馏水冲洗切片,滴加中性树胶封片。
2. 显微镜观察(1)将染色后的切片放置于显微镜载物台上。
(2)调整显微镜的焦距,观察大脑皮质、白质和神经元等结构。
(3)观察神经元形态,包括细胞体、树突和轴突等。
(4)观察神经元之间的连接,了解神经元的网络结构。
五、实验结果与分析1. 大脑皮质:大脑皮质是大脑最外层的灰质层,主要由神经元细胞体和突起组成。
在显微镜下,可以看到大脑皮质呈现出复杂的层次结构,神经元细胞体较大,形态多样。
2. 白质:白质位于大脑皮质下方,主要由神经纤维组成。
在显微镜下,可以看到白质呈现出致密的纤维状结构,神经纤维呈束状排列。
3. 神经元:神经元是大脑的基本功能单元,包括细胞体、树突和轴突。
在显微镜下,可以观察到神经元细胞体的形态、树突的分支和轴突的走向。
4. 神经元连接:神经元之间通过突触连接,实现信息传递。
在显微镜下,可以观察到神经元之间的突触连接,了解神经元的网络结构。
六、实验结论本次实验通过观察脑切片,成功观察到了大脑的结构和功能。
小鼠vta脑区取材方法小鼠VTA脑区取材方法简介脑区取材是研究神经科学中至关重要的步骤之一。
而小鼠VTA(腹侧被盖区)是一个具有重要生理功能的脑区,因此其取材方法尤为重要。
本文将详细介绍几种常用的小鼠VTA脑区取材方法。
方法一:冰冻切片法1.准备工具和材料:小鼠脑,乙醇,刀片,冰冻剂(如乙脑)。
2.将小鼠的脑取出并迅速冷冻。
3.利用刀片将冷冻的小鼠脑切片,切得越薄越好。
4.将切片收集起来放入乙醇中浸泡,以去除残留的冰冻剂。
5.制备好的小鼠VTA脑区切片即可用于后续研究。
方法二:脑电图指导法1.准备工具和材料:小鼠,脑电图仪器,电极。
2.将小鼠进行麻醉操作,将电极植入小鼠脑内。
3.进行脑电图记录,根据脑电图上的信号变化找到VTA脑区的位置。
4.通过电极位置引导,取出VTA脑区样本。
方法三:免疫组织化学法1.准备工具和材料:小鼠脑,加权剂,抗体。
2.将小鼠的脑取出并固定在福尔马林中。
3.进行脱水、透明化等处理,以使脑组织适合免疫组织化学操作。
4.制备适当浓度的抗体,对小鼠脑组织进行免疫染色,以标记VTA脑区。
5.根据免疫染色结果,准确取出VTA脑区进行后续实验。
方法四:多色荧光染色法1.准备工具和材料:小鼠脑,荧光染料。
2.将小鼠的脑取出并固定在福尔马林中。
3.进行脱水、透明化等处理,使脑组织适合染色。
4.制备多种荧光染料的混合液,对小鼠脑组织进行染色,以区分VTA脑区。
5.利用荧光显微镜观察染色结果,准确定位并取出VTA脑区。
方法五:遗传学标记法1.准备工具和材料:转基因小鼠。
2.鉴定具有特定遗传学标记的小鼠品系,如tdTomato表达转基因小鼠。
3.麻醉小鼠,取出脑组织。
4.根据遗传学标记的特异性,轻松找到VTA脑区,取出样本。
总结本文介绍了几种常用的小鼠VTA脑区取材方法,包括冰冻切片法、脑电图指导法、免疫组织化学法、多色荧光染色法和遗传学标记法。
选择合适的方法取样,对于研究VTA脑区的生理功能具有重要意义。
山西高校动物病理学切片种类
山西高校动物病理学切片种类包括:
1. 组织切片:常见的包括肝脏、肺、肾、心脏、脑组织等。
2. 肿瘤切片:包括皮肤肿瘤、乳腺肿瘤、淋巴组织肿瘤等。
3. 炎症切片:常见的包括细菌感染、真菌感染、病毒感染等。
4. 神经病理学切片:包括脊髓、神经等组织的切片。
5. 血管系统病理学切片:包括心脏、动脉、静脉等组织的切片。
6. 滤泡切片:主要用于研究免疫系统和淋巴系统的疾病。
7. 肝胆胰切片:包括肝脏、胆管、胰腺等组织的切片。
8. 心血管切片:包括心脏、动脉、静脉等组织的切片。
以上是山西高校动物病理学切片常见种类,具体还需根据实际情况进行选择。
摘自:《萱草根素对家兔中枢神经损害的病理学研究》6.2.1 大脑染色观察结果6.2.1.1 大脑 HE 染色结果正常对照组家兔大脑皮质结构清晰,神经细胞结构完整,无炎性细胞浸润。
白质部神经纤维染色均匀,为淡粉红色,排列整齐纹理清晰(图 6-1)。
试验开始后第 4 天,即可发现试验组家兔白质部神经纤维脱髄鞘,神经纤维排列紊乱,结构疏松,此时神经细胞未见明显病变(图 6-2),第 7 天,脱髄鞘进一步加强,髄鞘间的空隙进一步加大,胶质细胞核有所减少,第 10 天,神经细胞胞体固缩,染色较深,有的细胞固缩呈三角形,胞核染色深,结构模糊,核仁不明显(图 6-3),13 d 后,坏死细胞进一步增多,有时胞核和深染的胞质不易区分开来,神经细胞变性、坏死,被胶质细胞吞噬,有明显的“噬神经”现象,胶质细胞增生,有的形成结节(图 6-4),16 d、19 d,细胞坏死普遍,毛细血管扩张,周围有淋巴细胞为主的炎性细胞浸润,白质部神经纤维脱髄鞘,神经纤维排列紊乱,结构疏松,呈丝瓜络样变,胶质细胞核减少(图 6-5)。
6.2.1.2 大脑甲苯胺蓝染色结果正常对照组家兔神经细胞结构清晰,胞核大而圆,核仁粗大清晰可见,胞桨内含有丰富蓝色呈块状的尼氏体,白质中胶质细胞核分布密集(图 6-6),试验组家兔 4 d、7 d未见神经细胞的明显变化,10d,神经细胞固缩,呈三角形或长椭圆形,染色深,胞核结构消失,与胞桨一起染成深蓝色,尼氏体溶解、消失(图 6-7),13 d、16 d、19 d,坏死细胞进一步增多,视野中可见多个坏死的细胞,呈深染的团块状(图 6-8)。
6.2.1.3 大脑透射电镜结果试验组家兔有髄神经纤维髄鞘板层结构疏松,出现较大的空隙,严重的髄鞘断裂(图6-9)。
大脑神经细胞胞膜溶解消失,失去细胞界限,胞桨内细胞器出现严重病变,数目减少,粗面内质网和高尔基体发生扩张,结构不清,线粒体肿胀,嵴断裂、溶解、消失,呈空泡状,有的神经细胞出现明显的细胞内染色体边集现象,核膜消失,粗面内质网扩张,有的神经细胞染色质浓缩,核周间隙扩张,细胞坏死,坏死细胞被胶质细胞黏附和围绕,呈现“噬神经现象”(图 6-10, 6-11, 6-12)。
一、实验目的1. 观察神经组织的微细结构,了解神经元、神经胶质细胞、突触等基本结构。
2. 掌握神经组织切片的制作方法,提高实验操作技能。
二、实验原理神经组织是人体内的一种特殊组织,主要由神经元和神经胶质细胞组成。
神经元是神经系统的基本功能单位,具有接受、传递和整合信息的功能。
神经胶质细胞具有支持、营养和保护神经元的作用。
突触是神经元之间传递信息的结构基础。
三、实验材料与仪器1. 实验材料:新鲜动物大脑、酒精、甲醛、苏木精、伊红、磷酸缓冲液、切片机、显微镜等。
2. 仪器:显微镜、切片机、载玻片、盖玻片、眼科镊等。
四、实验步骤1. 切片制备(1)将新鲜动物大脑浸泡在10%的甲醛溶液中固定1-2小时。
(2)将固定好的大脑组织进行脱水、透明处理,采用酒精梯度逐级脱水,最后用二甲苯透明。
(3)将透明后的组织进行石蜡包埋,制成蜡块。
(4)将蜡块进行切片,切片厚度约为5-10微米。
(5)将切片展平,用苏木精染色3-5分钟,水洗去多余染料。
(6)用伊红复染1-2分钟,水洗去多余染料。
(7)将切片放入磷酸缓冲液中分化,去除多余颜色。
(8)用蒸馏水冲洗切片,晾干。
(9)将切片放置在载玻片上,滴加适量中性树胶,盖上盖玻片。
2. 观察与记录(1)使用显微镜观察切片,寻找神经元、神经胶质细胞、突触等结构。
(2)记录所观察到的神经组织结构及其特点。
五、实验结果1. 神经元神经元是神经系统的基本功能单位,由细胞体、树突、轴突组成。
细胞体位于神经元中央,呈椭圆形或梭形。
树突从细胞体发出,呈树枝状,负责接收其他神经元的信号。
轴突从细胞体发出,呈细长状,负责将信号传递给其他神经元或靶细胞。
2. 神经胶质细胞神经胶质细胞是神经组织的支持细胞,包括星形胶质细胞、少突胶质细胞和小胶质细胞。
星形胶质细胞具有支持和营养神经元的作用,形态呈星状。
少突胶质细胞主要存在于中枢神经系统,具有支持和营养神经元的作用。
小胶质细胞具有吞噬和清除细胞碎片、病原体等功能。
摘自:《萱草根素对家兔中枢神经损害的病理学研究》
6.2.1 大脑染色观察结果
6.2.1.1 大脑 HE 染色结果
正常对照组家兔大脑皮质结构清晰,神经细胞结构完整,无炎性细胞浸润。
白质部神
经纤维染色均匀,为淡粉红色,排列整齐纹理清晰(图 6-1)。
试验开始后第 4 天,即可发现试验组家兔白质部神经纤维脱髄鞘,神经纤维排列紊乱,结构疏松,此时神经细
胞未见明显病变(图 6-2),第 7 天,脱髄鞘进一步加强,髄鞘间的空隙进一步加大,胶质细胞核有所减少,第 10 天,神经细胞胞体固缩,染色较深,有的细胞固缩呈三角形,胞核染色深,结构模糊,核仁不明显(图 6-3),13 d 后,坏死细胞进一步增多,有时
胞核和深染的胞质不易区分开来,神经细胞变性、坏死,被胶质细胞吞噬,有明显的
“噬神经”现象,胶质细胞增生,有的形成结节(图 6-4),16 d、19 d,细胞坏死普遍,毛细血管扩张,周围有淋巴细胞为主的炎性细胞浸润,白质部神经纤维脱髄鞘,神经
纤维排列紊乱,结构疏松,呈丝瓜络样变,胶质细胞核减少(图 6-5)。
6.2.1.2 大脑甲苯胺蓝染色结果
正常对照组家兔神经细胞结构清晰,胞核大而圆,核仁粗大清晰可见,胞桨内含有丰
富蓝色呈块状的尼氏体,白质中胶质细胞核分布密集(图 6-6),试验组家兔 4 d、7 d
未见神经细胞的明显变化,10d,神经细胞固缩,呈三角形或长椭圆形,染色深,胞核结构消失,与胞桨一起染成深蓝色,尼氏体溶解、消失(图 6-7),13 d、16 d、19 d,坏死细胞进一步增多,视野中可见多个坏死的细胞,呈深染的团块状(图 6-8)。
6.2.1.3 大脑透射电镜结果试验组家兔有髄神经纤维髄鞘板层结构疏松,出现较大的空隙,严
重的髄鞘断裂(图6-9)。
大脑神经细胞胞膜溶解消失,失去细胞界限,胞桨内细胞器出现严重病变,数目减少,粗面内质网和高尔基体发生扩张,结构不清,线粒体肿胀,
嵴断裂、溶解、消失,呈空泡状,有的神经细胞出现明显的细胞内染色体边集现象,
核膜消失,粗面内质网扩张,有的神经细胞染色质浓缩,核周间隙扩张,细胞坏死,
坏死细胞被胶质细胞黏附和围绕,呈现“噬神经现象”(图 6-10, 6-11, 6-12)。
摘自:《Effect of melatonin on PCB (Aroclor 1254) induced neuronal damage and changesin Cu/Zn superoxide dismutase and glutathione peroxidase-4mRNA expression incerebral cortex, cerebellum and hippocampus of adult rats》
Fig. 3. Photomicrograph of the cerebral cortical layers in control, PCB and PCBwithme latonin treated animals. (A) The normal neuronal morphology without cellular dama
ge.(B) Pyknotic nuclei (PN) with prominent perineuronal spaces (PNS) and neuronal s hrinkage (NS) in PCB exposed rats. (C) Normal cellular arrangement with few pyknoti cnucleus in PCBwithmelatonin (5 mg) treated rats. (D) Less number of pyknotic nucle
i in PCBwithmelatonin (10 mg) treated ratswhen compared to PCBwith 5 mgmelatoni ntreated rats. (E) and (F) shows the normal neuronal cells (NNC) in melatonin alone (5 mg and 10 mg) treated rats (haematoxylin and eosin staining, 400.
在PCB暴露的大鼠中,细胞核固缩(PN)与突出的神经细胞周围的空间(PNS)和
神经收缩(NS);normal neuronal cells (NNS)正常的神经细胞。
摘自:《通过调节 JAK2-STAT3 和 Wnt5a 信号通路可能是缺血后处理及低温
减轻全脑缺血性脑损伤的分子机制》
我们在镜下将神经元变性程度分为 0-5 级,
级别越高,神经细胞损伤变性程度越重。
0 级:神经元细胞胞体、胞核形态正常,细胞核周围尼氏小体多,此为基本正常细胞。
1 级:神经元细胞形态基本
正常,核周尼氏小体略减少,核无明显形态学改变。
2 级:神经元细胞肿胀,
细胞边缘变凸出,核周尼氏小体明显减少,胞浆均匀蓝色,细胞核常偏居一侧,核仁无明显变化。
3 级:神经元细胞胞体缩小,核周尼氏小体消失,胞核内染
色质浓缩,核仁与染色质分界不清。
4级:神经元细胞胞体及细胞核均浓缩,
尼氏小体消失,细胞核裂解,核仁消失,细胞胞膜与周围界限清楚。
5 级:除
上述变化外,胞浆中出现空泡,有的坏死神经元细胞被吞噬细胞吞噬,卫星细
胞增多,有的侵入胞体使细胞残缺不全。
由上图可见空白组顶叶皮层神经元形态基本正常。
其余各组都有不同程度的神经元变性表现,缺血再灌注组神经元变性程度最严重,而且视野中 4-5 级的变性现象多。
相对于缺血再灌注对照组,其他几个处理组都有不同程度的减轻。
3 0 秒×3 次(30×3)组、60 秒×1 次(60×1)组与缺血再灌注对照组相比,
较稍减轻,以 3-4 级变性表现为主,提示处理后神经元保护结果不明显。
综合各处理组,15 秒×3 次(15×3)组神经元变性程度最轻,可得出结论,15 秒×3 次(15×3)组神经元保护作用最明显。
在HE染色实验中观察到神经元的变性,细胞肿胀,尼氏小体减少胞浆均匀不等核内染色质深染,浓缩,核仁分界不清,部分神经元胞体及核均固缩为三角形,核裂解,核仁消失,细胞周围间隙明显增宽,有些神经元坏死后小胶质细胞的胞浆突起深入神经细胞中出现“噬神经现象”。
摘自《酒精中毒大鼠脑血管病变及相应脑组织损伤的病理观察》
摘自:《针刺对海洛因精神依赖小鼠稽延性戒断症状作用机制的研究》
摘自:《P53蛋白与 TNF/ TGF在实验性自身免疫性脑脊髓炎大鼠表达的相关性分析》
病理EAE大鼠炎症病灶主要侵犯脊髓腰膨大、颈膨大的
白质及白灰质交界处、软脊膜及脊髓实质。
大脑皮质及皮髓质交
界处甚至深部髓质、脑脊膜和侧脑室周围以及脑干白质也被侵
犯,但侵犯的较少。
HE染色显示病变血管周围有淋巴细胞和单
核细胞浸润,呈典型的袖套样改变 (见图 1)。
摘自:《米尔贝肟大鼠急性中毒的病理学研究》
本研究发现,d14 雄性Ⅱ组大鼠大脑皮层区血管淤血,内有炎症细胞浸润,血管边缘区空泡化,神经胶质细胞增生,神经元坏死,存在噬神经现象。
摘自:《实验病理学图鉴》,更多图片请参照资料。