高考化学硫及其化合物的综合热点考点难点及答案解析
- 格式:doc
- 大小:777.00 KB
- 文档页数:18
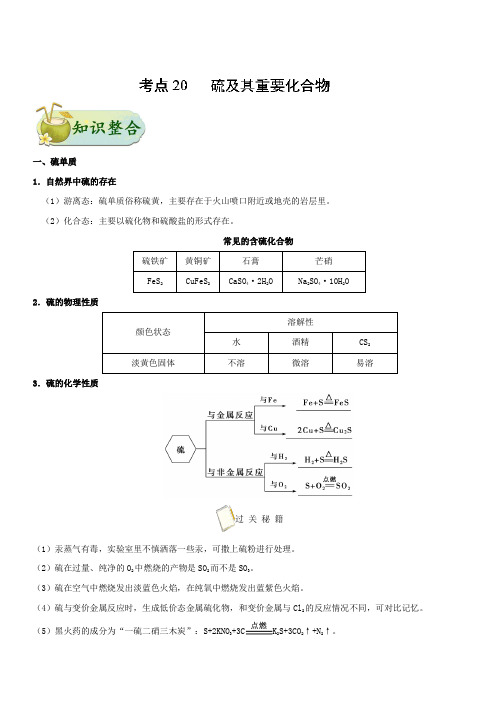
一、硫单质1.自然界中硫的存在(1)游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
常见的含硫化合物2.硫的物理性质溶解性颜色状态水酒精CS2淡黄色固体不溶微溶易溶3.硫的化学性质过关秘籍(1)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
(2)硫在过量、纯净的O2中燃烧的产物是SO2而不是SO3。
(3)硫在空气中燃烧发出淡蓝色火焰,在纯氧中燃烧发出蓝紫色火焰。
(4)硫与变价金属反应时,生成低价态金属硫化物,和变价金属与Cl2的反应情况不同,可对比记忆。
(5)黑火药的成分为“一硫二硝三木炭”:S+2KNO3+3C K2S+3CO2↑+N2↑。
二、硫的氧化物——二氧化硫和三氧化硫1.二氧化硫(1)物理性质(2)化学性质①酸性氧化物的通性a.与水反应:SO 2+H2O H2SO3b.使指示剂变色:SO2能使紫色石蕊溶液变红c.与碱反应:NaOH足量:SO2+2NaOH Na2SO3+H2ONaOH不足量:SO2+NaOH NaHSO3d.与碱性氧化物反应:SO2+CaO CaSO3②氧化性:2H2S+SO23S↓+2H2O(产生淡黄色沉淀)③还原性a.与O2反应:2SO2+O22SO3b.与X2(Cl2、Br2、I2)的水溶液反应:SO2+X2+2H2O2HX+H2SO4c.可被酸性KMnO4溶液、K2Cr2O7溶液、H2O2、Fe3+等氧化。
④漂白性:SO2能漂白某些有色物质(如品红溶液),但不能使紫色石蕊溶液等指示剂褪色。
(3)检验将气体通入品红溶液后,溶液褪色,加热后溶液又恢复到红色则可验证该气体是SO2。
注意“加热”是必不可少的步骤,因为氯气也能使品红溶液褪色,但加热后溶液不会重新变红色。
2.三氧化硫(1)物理性质常温常压下为无色、易挥发的液体,熔点为16.8 ℃,沸点为44.8 ℃。
(2)化学性质:酸性氧化物的通性三、硫酸的性质和23SO -、24SO -的检验 1.硫酸的性质干燥注意:(1)浓硫酸的稀释方法:将浓硫酸沿器壁慢慢注入水中,并用玻璃棒不断搅拌。

高考化学硫及其化合物知识点-+典型题含答案解析一、选择题1.根据SO2通入不同溶液中的实验现象,所得结论错误的是()A.A B.B C.C D.D【答案】A【详解】A.SO2与H2O2反应生成H2SO4,结论错误,故A错误;B.SO2与H2S反应生成S沉淀,SO2中S元素化合价降低,SO2表现氧化性,故B正确;C.SO2有还原性,能被高锰酸钾氧化,使高锰酸钾褪色,故C正确;D.SO2与氢氧化钠反应生成亚硫酸钠,氢氧化钠溶液碱性减弱,溶液红色褪去,故D正确;选A。
【点睛】本题考查二氧化硫的性质,注意掌握二氧化硫具有氧化性、还原性、漂白性以及酸性氧化物的性质,试题有利于提高学生的理解能力及综合应用能力。
2.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是()A.A B.B C.C D.D【答案】A【详解】A. 由于Fe3+有氧化性,可以与铜反应,故FeCl3溶液可用于回收废旧电路板中的铜,A正确;B. 二氧化硅没有导电性,其可作光导纤维是由于其对光的创导,B错误;C. SO2可使溴水褪色是因为其还原性,C错误;D. 浓硫酸具有吸水性,故浓硫酸可用于干燥H2和CO,D错误;故答案选A。
3.下列有关说法正确的是()A.因为硫单质具有氧化性,故铁粉与硫粉共热可以生成Fe2S3B.硫在空气中燃烧的产物是SO2,在纯氧中燃烧的产物是SO3C.SO2的水溶液能导电,所以SO2是电解质D.二氧化硫可用于抑制酒类中细菌的生长,可在葡萄酒中微量添加【答案】D【详解】A. 因为硫单质具有氧化性,但氧化性不强,铁粉与硫粉共热生成FeS,A错误;B. 硫在空气中燃烧的产物是SO2,在纯氧中燃烧的产物也是SO2,B错误;C. SO2的水溶液能导电,因为二氧化硫与水反应生成亚硫酸,亚硫酸是电解质,二氧化硫不是电解质,C错误;D. 二氧化硫可用于抑制酒类中细菌的生长,可在葡萄酒中微量添加,D正确;答案为D。
【点睛】S具有弱氧化性,与Fe反应生成FeS。

上海高考化学压轴题专题复习——硫及其化合物的综合一、高中化学硫及其化合物1.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。
某研究小组进行如下实验:实验一焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5(1)装置I中产生气体的化学方程式为___________________________。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是_______________。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二焦亚硫酸钠的性质(4)Na2S2O5溶于水即生成NaHSO3。
证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是______________ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是_____________________________。
实验三葡萄酒中抗氧化剂残留量的测定葡萄酒常用Na2S2O5作抗氧化剂。
测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(6)按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_______________g·L-1。
(7)在上述实验过程中,若有部分HI被空气氧化,则测得结果_______________ (填“偏高”“偏低”或“不变”)。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O) 过滤d a、e 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 0.16 偏低【解析】【分析】实验一:装置Ⅰ制取二氧化硫,亚硫酸钠与硫酸反应Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O,装置Ⅱ制取Na2S2O5晶体,Na2SO3+SO2=Na2S2O5,装置Ⅲ用于处理尾气吸收未反应的二氧化硫。

2025年高考化学一轮复习专题知识点归纳及训练—硫及其重要化合物(解析版)知识点01硫单质的性质及应用1.硫元素的存在形态游离态:火山口附近或地壳的岩层里;化合态:主要以硫化物和硫酸盐的性质存在。
2.硫的物理性质黄色或淡黄色固体;俗称硫黄,质脆,易研成粉末,密度比水大,难溶于水,微溶于酒精,易溶于CS 2。
3.硫的化学性质S -2←――――氧化性S 0――→还原性S+4(1)与非金属单质反应与氧气反应:S+O 2=====点燃SO 2与氢气反应:S+H 2=====△H 2S (2)与金属反应与钠反应:2Na+S===Na 2S 与铁反应:Fe+S=====△FeS 与铜反应:2Cu+S=====△Cu 2S 与汞反应:Hg+S===HgS应用:去除洒落的汞硫与变价金属反应生成低价态化合物(3)与NaOH 溶液反应:3S+6NaOH=====△2Na 2S+Na 2SO 3+3H 2O应用:清洗试管壁残留的硫(1)硫与Fe 反应生成FeS ,与Cu 反应生成CuS(×)错因:硫与变价金属反应时,生成低价态金属硫化物(如Cu 2S 、FeS)2。
(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(√)(3)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(4)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(5)实验室洗涤附着在试管内壁上的硫,可用酒精清洗(×)错因:硫微溶于酒精,易溶于CS2,残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去。
1.硫和氯气的氧化性强弱比较方法(1)与变价金属反应,Cl 2与变价金属反应生成高价态化合物,S 与变价金属反应生成低价态化合物;(2)氢化物的稳定性:HCl >H 2S ;(3)置换反应:H 2S +Cl 2===2HCl +S↓;(4)最高价含氧酸的酸性:HClO 4>H 2SO 4;(5)还原性:S 2->Cl -。

高考化学硫及其化合物的综合热点考点难点及详细答案一、高中化学硫及其化合物1.硫元素具有可变价态,据此完成以下有关含硫化合物性质的试题。
(1)将H2S气体通入FeCl3溶液中,现象是_____________________________;反应的离子方程式是______________________________________。
(2)为了探究-2价硫的化合物与+4价硫的化合物反应的条件,设计了下列实验。
实验操作实验现象实验1将等浓度的Na2S和Na2SO3溶液按体积比2∶1混合无明显现象实验2将H2S通入Na2SO3溶液中未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀实验3将SO2通入Na2S溶液中有浅黄色沉淀产生已知:电离平衡常数:H2S K1 =1.3×10-7;K2 = 7.1×10-15H2SO3 K1 =1.7×10-2;K2 = 5.6×10-8①根据上述实验,可以得出结论:在_________条件下,+4价硫的化合物可以氧化-2价硫的化合物。
②将SO2气体通入H2S水溶液中直至过量,下列表示溶液pH随SO2气体体积变化关系示意图正确的是______(选填编号)。
A. B. C.D.(3)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
要证明Na2SO3具有还原性,应选用的试剂有______________,看到的现象是____________________。
要证明Na2SO3具有氧化性,应选用的试剂有___________________,反应的离子方程式是________________________________。
(4)文献记载,常温下H2S可与Ag发生置换反应生成H2。
现将H2S气体通过装有银粉的玻璃管,请设计简单实验,通过检验反应产物证明H2S与Ag发生了置换反应_____________________。

高考化学综合题专题复习【硫及其化合物】专题解析含详细答案一、高中化学硫及其化合物1.在空气中加热S粉和Fe粉的混合物,可观察到下列现象:(1)有淡蓝色火焰,且生成刺激性气味的气体。
(2)混合粉末变红,放出热量,最后变成黑色固体。
(3)不时有火星从混合物中射出。
请分别写出以上三种情况发生反应的化学方程式:__________、__________、__________。
【答案】S+O2SO2 Fe+S FeS 3Fe+2O2Fe3O4【解析】【分析】【详解】(1)S在空气中燃烧产生淡蓝色火焰,生成SO2,反应方程式为:S+O2∆SO2;(2)混合粉末变红,放出热量,最后变为黑色固体是因为Fe与S反应生成FeS,反应方程式为:Fe+S ∆FeS;(3)有火星射出是因为Fe与O2反应生成Fe3O4,反应方程式为:3Fe+2O2∆Fe3O4。
2.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置已略去)。
(1)试管①中反应的化学方程式是______;(2)若试管②中的试剂为品红溶液,实验中观察到的现象是______;若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,则说明生成的气体具有______性。
(3)试管③中的试剂为NaOH溶液,其作用是______,反应的离子方程式是______。
【答案】Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 品红溶液褪色还原吸收尾气SO2+2OH-=SO32-+H2O【解析】【分析】(1)铜与浓硫酸在加热时反应生成硫酸铜和二氧化硫气体;(2)二氧化硫能使品红溶液褪色;若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,二氧化硫与高锰钾发生氧化还原反应而褪色;(3)二氧化硫是有毒的酸性氧化物,不能直接排放空气中,所以用NaOH溶液吸收尾气。
【详解】(1)铜与浓硫酸在加热条件下发生反应生成硫酸铜和二氧化硫气体和水,反应方程式为:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;(2)SO2气体具有漂白性,能使品红溶液褪色,所以试管②品红溶液褪色;SO2气体具有强的氧化性,可以被强氧化剂氧化为硫酸,若试管②中的试剂为酸性KMnO4溶液,实验时,观察到溶液褪色,二氧化硫与高锰钾发生氧化还原反应而褪色,体现二氧化硫的还原性;(3) SO2是有毒气体,不能直接排放空气中,由于SO2属于酸性氧化物,所以可用NaOH溶液进行尾气处理,反应的离子方程式为:SO2+2OH-=SO32-+H2O。
第19讲 硫及其化合物【课程标准】 1.掌握硫及其重要化合物的主要化学性质及应用。
2.了解硫的氧化物对大气的污染与防治。
考点一 硫单质的性质1.自然界中的硫形态,游离态火山喷口附近或地壳的岩层里,化合态主要以硫化物和硫酸盐的形式存在 2.物理性质3.化学性质(1)氧化性:(0价→-2价)(2)还原性:(0价→+4价) S +O 2=====点燃SO 2(3)与碱发生歧化反应(如NaOH 溶液): 3S +6NaOH=====△2Na 2S +Na 2SO 3+3H 2O 。
[正误辨析]1.硫在自然界中仅以化合态存在( )2.硫在空气中燃烧的产物是SO 2,在纯氧中燃烧的产物是SO 3( ) 3.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物( )4.等质量的S 6和S 8分子分别与足量的KOH 反应,消耗KOH 的物质的量相同( ) 5.常温下硫单质主要以S 8形式存在,加热时S 8转化为S 6、S 4、S 2属于物理变化( )6.汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理( ) 答案:1.× 2.× 3.× 4.√ 5.× 6.√正误判断(1)(2022·山东卷)“能化……银、铜、铁,奇物”,石硫黄(S)表现氧化性( ) (2)(2019·浙江卷)硫元素在自然界中的存在形式有硫单质、硫化物和硫酸盐等( ) 答案:(1)√ (2)√硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是( )A .含硫杆菌及好氧/厌氧菌促进了硫的循环B .硫循环中硫的化合物均为无机物C .上述硫循环中硫元素均被氧化D .烧煤时加石灰石,可减少酸雨及温室气体的排放 答案:A解析:硫酸盐和亚硫酸盐等在含硫杆菌及好氧/厌氧菌作用下缓慢转化成植物R 1-S -R 2,含硫杆菌及好氧/厌氧菌促进了硫的循环,故A 正确;硫循环中硫的化合物有含硫的有机物,不全是无机物,故B 错误;含硫杆菌及好氧/厌氧菌将硫酸盐、亚硫酸盐中的硫还原成R 1-S -R 2,硫循环中硫元素有时被氧化,有时被还原,故C 错误;烧煤时加石灰石,CaCO 3+SO 2=====△CaSO 3+CO 2可减少酸雨,除上述反应外石灰石分解生成二氧化碳,会增加温室气体的排放,故D 错误。
高考化学硫及其化合物的综合热点考点难点附详细答案一、高中化学硫及其化合物1.硫和氮及其化合物在生产生活中应用广泛。
请回答:(1)将SO2通入品红溶液中,现象为品红溶液________,加热后溶液颜色________。
(2)已知反应:SO2+Cl2+2H2O ═ 2HCl+H2SO4,该反应中的氧化产物是__________。
(3)木炭与浓硫酸共热的化学反应方程式为:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O,若生成0.5 mol CO2,则转移电子的物质的量是_________mol。
(4)工业上可以通过氮气和氢气在一定条件下合成氨气。
下列关于氨气的性质和用途描述正确的是____________。
A.氨气易液化,液氨可作制冷剂 B.可用排水法收集氨气C.氨气是一种无色无味的气体 D.向氨水中滴加酚酞,溶液变红(5)实验室检验试管里氨气是否收集满的方法是___________________(写出一种即可)。
(6)汽车尾气常含有NO、NO2、CO等,会污染空气。
在汽车尾气排放管处安装一个催化转化器,可使尾气中有害气体CO和NO反应转化为两种无毒气体,该反应的化学方程式为__________________________。
【答案】褪色变红 H2SO4 2 AD 用湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则说明氨气已收集满(或用玻璃棒蘸取浓盐酸靠近试管口,若出现大量白烟,则说明氨气已收集满)。
(或其他合理答案) 2CO+2NO N2+2CO2【解析】【分析】(1)SO2具有漂白性,但漂白是有选择的、暂时性的,加热后无色产物会分解,重新生成品红。
(2)反应SO2+Cl2+2H2O ═ 2HCl+H2SO4中,氧化产物是含有价态升高元素的生成物。
(3)在反应C+2H2SO4(浓)CO2↑+2SO2↑+2H2O中,有如下关系:CO2——4e-,由此可计算出生成0.5 mol CO2,转移电子的物质的量。
人教高考化学硫及其化合物知识点总结含答案解析一、选择题1.下列物质的检验与结论正确的是()A.A B.B C.C D.D【答案】B【详解】A. 焰色反应呈黄色说明待测液含Na+,同时K的焰色反应为紫色,容易被黄色掩蔽。
所以不确定是否含K+,A项错误;B. 待测液加入过量盐酸无现象说明不含Ag+,加入BaCl2生成不溶于盐酸的沉淀,则待测液肯定含有SO42-,B项正确;C. 如果待测液只含HCO3-,加入过量盐酸也能产生CO2气体,C项错误;D. 原溶液可能只含Fe3+,先加氯水再加KSCN,溶液也呈红色,D项错误;故答案选B。
【点睛】本题易错点为A项。
Na的焰色反应颜色可能影响观察到K的焰色反应颜色,所以不能断定不含K,实际上可透过蓝色钴玻璃观察焰色反应排除Na的焰色反应影响。
2.下列操作或叙述正确的是( )A.向无色溶液中加入BaCl2溶液有白色沉淀出现,再加盐酸沉淀不消失,该溶液中一定含有SO42-B.向某溶液中加入浓氢氧化钠溶液并加热,用湿润的红色石蕊试纸进行如图所示操作来检验溶液中是否存在NH4+C.将某固体试样完全溶于盐酸,再滴加KSCN溶液,没有出现血红色,该固体试样中也可能存在Fe3+D.向无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,则该溶液中一定含有CO32-【答案】C【详解】A、向无色溶液中加入BaCl2溶液有白色沉淀出现,再加盐酸沉淀不消失,该沉淀不一定是BaSO4,也有可能是AgCl,该现象说明该溶液中可能含SO42-,也可能含Cl-;检验SO42-的方法是向无色溶液中先加入HCl,若无明显现象,再加入BaCl2溶液,出现白色沉淀说明无色溶液中含有SO42-,A错误;B、应将用镊子夹住试纸放在试管口,B错误;C、固体样品中可能含有Fe和Fe2O3,加入盐酸后,Fe可以和Fe3+反应,使得溶液中没有Fe3+,再加入KSCN溶液,溶液不变红,C正确;D、能使澄清石灰水变浑浊的气体不一定是CO2,也可能是SO2;此外,和盐酸反应生成CO2、SO2的离子有CO32-、HCO3-或SO32-、HSO3-,D错误;故选C。
高考化学硫及其化合物的综合热点考点难点及答案解析一、高中化学硫及其化合物1.亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。
实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。
已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
(1)装置A制取SO2①A中反应的化学方程式为___。
②导管b的作用是___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___(只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___。
(3)装置C的主要作用是___(用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___。
(5)测定亚硝酰硫酸NOSO4H的纯度准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。
用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O②滴定终点时的现象为___。
③亚硝酰硫酸的纯度=___。
(精确到0.1%)[M(NOSO4H)=127g·mol-1]【答案】Na2SO3+H2SO4=Na2SO4+H2O+SO2↑平衡压强,使分液漏斗中的液体能顺利流下;调节分液漏斗活塞,控制浓硫酸的滴加速度生成的NOSO4H作为该反应的催化剂SO2+2OH-=SO32-+H2O C装置中的水蒸气会进入B中使NOSO4H分解 2 5 16H+ 210CO2↑ 8 溶液恰好由粉红色变为无色,且半分钟内不恢复 92.0%【解析】【分析】(1)①装置A是利用亚硫酸钠和浓硫酸反应制取SO2;②导管b的作用平衡压强的作用;(2)①装置B中浓硝酸与二氧化硫在浓硫酸的作用下反应制得NOSO4H,该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,结合反应的操作;②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率加快,说明NOSO4H 起到了催化作用;(3)装置C主要作用是吸收二氧化硫防止污染空气;(4)NOSO4H遇水分解;(5)①高锰酸钾溶液在酸性条件下氧化草酸钠生成二氧化碳,结合元素化合价变化和电子守恒、原子守恒配平书写离子反应方程式;②高锰酸钾自身在反应中的颜色变化就可作为终点判断指示剂;③根据反应2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,结合滴定中消耗高锰酸钾的物质的量可得到亚硝酰硫酸的物质的量,据此计算纯度。
【详解】(1)①利用装置A,固液混合制取二氧化硫,其方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;②导管b的作用是:平衡压强,使分液漏斗中的液体能顺利流下;(2)①浓硫酸遇水放出大量热,维持体系温度不得高于20℃,还可以是调节分液漏斗活塞,控制浓硫酸的滴加速度;②开始反应缓慢,待生成少量NOSO4H后,反应速率明显加快,温度变化不大,排除温度的影响,其原因是:生成的NOSO4H作为该反应的催化剂,加快了反应速率;(3)装置C利用NaOH溶液将剩余的SO2吸收,防止污染环境,方程式为SO2+2OH-=SO32-+H2O;(4)NOSO4H遇水分解,C装置(或A)中的水蒸气会进入B中使NOSO4H发生分解;(5)①发生的是MnO4-和C2O42-的氧化还原反应,MnO4-做氧化剂,被还原成生成Mn2+,C2O42-做还原剂,被氧化成二氧化碳。
结合得失电子守恒和电荷守恒可得到MnO4-和C2O42-的离子反应方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;②利用草酸钠溶液滴定酸性KMnO4溶液,滴定终点时的现象为:溶液恰好由粉红色变为无色,且半分钟内不恢复;③根据题意可知,酸性KMnO4溶液先与NOSO4H反应,利用草酸钠溶液滴定剩余酸性KMnO4溶液。
用0.2500mol·L-1草酸钠标准溶液滴定酸性KMnO4溶液,消耗草酸钠溶液的体积为20.00mL。
可知剩余的KMnO4的物质的量n1(MnO4-)=25n(C2O42-)=25×0.2500mol·L-1×20.00×10-3L=2×10-3mol,则亚硝酰硫酸消耗的KMnO4的物质的量n2(MnO4-)=0.1000mol·L-1·60.00×10-3L-2×10-3mol=4×10-3mol。
n(NOSO4H)=52n2(MnO4-)=10-2mol,亚硝酰硫酸的纯度=()4m NOSO H1.380g×100%=2110mol127g mol1.380g-⨯⋅-×100%=92.0%。
2.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。
某研究小组进行如下实验:实验一焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5(1)装置I中产生气体的化学方程式为___________________________。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是_______________。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二焦亚硫酸钠的性质(4)Na2S2O5溶于水即生成NaHSO3。
证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是______________ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸d.加入品红溶液 e.用蓝色石蕊试纸检测(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是_____________________________。
实验三葡萄酒中抗氧化剂残留量的测定葡萄酒常用Na2S2O5作抗氧化剂。
测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(6)按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_______________g·L-1。
(7)在上述实验过程中,若有部分HI被空气氧化,则测得结果_______________ (填“偏高”“偏低”或“不变”)。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O) 过滤d a、e 取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成 0.16 偏低【解析】【分析】实验一:装置Ⅰ制取二氧化硫,亚硫酸钠与硫酸反应Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O,装置Ⅱ制取Na2S2O5晶体,Na2SO3+SO2=Na2S2O5,装置Ⅲ用于处理尾气吸收未反应的二氧化硫。
(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO 2,亚硫酸钠与硫酸反应生成硫酸钠或硫酸氢钠、二氧化硫与水;(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;实验二:(4)NaHSO 3溶液中HSO 3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;(5)Na 2S 2O 5晶体在空气中易被氧化为Na 2SO 4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可。
实验三:(6)①由消耗碘的量,结合SO 2+I 2+2H 2O ═H 2SO 4+2HI 计算二氧化硫的质量,进而计算浓度;②若有部分HI 被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小。
【详解】(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO 2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na 2SO 3+H 2SO 4=Na 2SO 4+SO 2↑+H 2O ,或生成硫酸氢钠,反应方程式为:Na 2SO 3+2H 2SO 4=2NaHSO 4+SO 2↑+H 2O ;(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离;(3)a .装置应将导管伸入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故a 错误;b .该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故b 错误;c .该装置不能吸收二氧化硫,所以无法实现实验目的,故c 错误;d .该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故d 正确; 故答案为d ;(4)NaHSO 3溶液中HSO 3−的电离程度大于水解程度,溶液呈酸性,测定溶液的pH ,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH 值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl 溶液、品红溶液都不能说明溶液呈酸性,故选ae ;(5)Na 2S 2O 5中S 元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na 2SO 4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na 2S 2O 5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成。
(6)①令100mL 葡萄酒中二氧化硫的质量为m g ,则:2222464g SO +2H O+I =H SO +2HI 1mol0.025L 0.01m Lg mol/ 所以,64g:mg=1mol:0.025L×0.01mol/L ,解得m =0.016,故该次实验测得样品中抗氧化剂的残留量(以游离SO 2计算)为0.016g ×0.1L=0.16g/L ;②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低。
3.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是 ______ (填写字母)。