7.3《溶液的酸碱性》鲁教版
- 格式:ppt
- 大小:3.88 MB
- 文档页数:16




第2课时教学目标【知识与能力】1.知道蒸发结晶是海水“晒盐〞的根本原理;2.理解溶解度的涵义。
【过程与方法】初步学习绘制和查阅溶解度曲线并掌握其意义。
【情感态度价值观】通过让学生参与粗盐提纯过程,培养学生一丝不苟、严谨学的态度,使学生养成耐心、细致的实验操作习惯。
教学重难点【教学重点】溶解度的概念及固体物质在水中的溶解度;【教学难点】混合物的别离方法和思路。
教学过程环节一:导入新课我们都知道由海水可以晒制食盐,但晒盐过程的原理你理解吗?本节课我们将以“海水晒盐〞为载体,学习“饱和溶液、溶解度、结晶〞等概念,并完成有关的实验探究。
环节二:新课讲授第一局部:海水“晒盐〞的过程 设疑:1.猜猜海水晒盐的流程。
2.你觉得海水晒盐的主要方法是什么?利用的原理是什么?3.你说海水晒盐的过程中水为什么不能完全蒸发干呢? 学生思考讨论。
教师展示图片,讲解:海水晒盐的原理 海水→蒸发池 → 结晶池→结晶:固体物质从它的饱和溶液中以晶体的形式析出的过程叫作结晶。
蒸发结晶是物质结晶的途径之一。
饱和溶液:在一定温度下,一定质量的溶剂里,不能再溶解某种溶质的溶液。
不饱和溶液:在一定温度下,一定质量的溶剂里,还能再溶解某种溶质的溶液。
理解饱和溶液和不饱和溶液的时应注意:①应明确“一定温度〞 和“一定量的溶剂〞,因为改变温度或溶剂量,饱和溶液和不饱和溶液可以互相转化。
②应明确“某一物质〞的饱和溶液,例如在一定条件下,不能再溶解NaCl ,可继续溶解蔗糖,此时的溶液是NaCl 的饱和溶液,对蔗糖来说,就是不饱和溶液了。
饱和溶液和不饱和溶液的相互转化:饱和溶液 −−−−−−−←−−−−−−−−−−−−−−→−增加溶质降低温度、蒸发溶剂、 增加溶剂或升高温度 不饱和溶液第二局部:溶解度 过渡固体物质溶于水都能到达饱和状态,为什么会到达饱和呢?还与什么因素有关? 二、溶解度——定量表示某种物质在某种溶剂中的溶解性。
1. 实验探究:影响物质在水中溶解性的因素 〔1〕溶质的影响 〔2〕温度的影响2.观察老师的实验,并把结果填在空格上。

7.3 溶液的酸碱性(第一课时)杜陵中学杜晨一.设计理念教育作为一种文化传承的载体,它的内容和形式随着时代的变迁和社会的发展也在不断的发展变化,同时也就形成了与之相适应的学习方法。
随着教育改革的深入,探究性学习被广泛倡导。
因为这样的学习方法抵制了死记硬背,机械训练,倡导学生自主参与,乐于探究,勤于动手,培养学生搜集和处理信息的能力,获取新知识的能力,分析和解决问题的能力以及交流与合作的能力。
具体到日常的教学中,表现在以下几个方面。
首先学生通过探究式活动获得新知,提升能力传统的教学模式是先将结论直接告诉学生,再通过演示实验或学生实验加以验证,而探究性学习是让学生通过各式各样的探究活动,自己得出结论,使他们参与并体验知识的获得过程(甚至是错误的尝试),形成新的认识,并培养科学探究的能力。
所以,要培养学生的科学探究能力,教师的首要任务不是简单地传授知识和技能,而是如何设计好实验教学的环节,创设能激发学生探究实验兴趣的情景,让学生在感兴趣的情景中动手操作,探究新知,激发他们的探究意识其次,在进行实验设计的过程中,教师始终扮演指导、组织的角色,把充分的活动时间都交给了学生,让学生充分享受探究的乐趣,在探究中学生不仅巩固了旧知识,学到了新知识而且还提高了自己与同学的合作能力,实验设计能力,实验的操作能力以及分析归纳能力。
因此实验探究的创新设计对激发学生学习科学的活力和培养实验探究能力具有重要意义。
还有就是很多问题如果光靠教师嘴说,不仅耗时长,而且学生还不一定好理解。
这时如果换成实验,不仅现象明显,而且省时省力,学生记忆也深刻,实在是事半功倍。
二.教材分析《溶液的酸碱性》是山东教育出版社出版的九年级化学教材第7章第三节的内容。
本节教材分成:溶液酸性和碱性的判断、溶液酸碱性的强弱及测定方法、溶液酸碱性与生命活动的关系三部分。
溶液的酸碱性是溶液的一个特性,溶液的酸碱性的强弱对其化学反应及应用有重大的影响,如:溶液与生命活动、植物生长就有很密切的关系,充分体现化学的价值观,有利于发展学生的化学基本观念。
7.3溶液的酸碱性教案一、教学目标1.通过实验,学会用酸碱指示剂、酸碱试纸检验溶液酸碱性,知道PH与溶液酸碱性强弱的关系,会用PH试纸检验溶液酸碱性强弱。
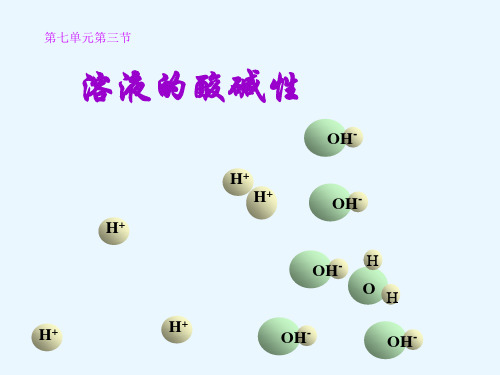
2.通过分析、讨论和模型法,从H+和OH-的角度,认识溶液成酸碱性及强弱程度不同的原因,进一步建立宏观和微观相联系的思维方式。
3.通过亲历实验探究过程,初步学会运用间接观察的方法收集证据。
4.通过阅读交流讨论,了解溶液酸碱性对生命活动的意义,发展化学的价值观等化学基本观念。
二、重难点学会用酸碱指示剂、试纸检验溶液的酸碱性,用pH试纸检验溶液的酸碱性强弱。
教学重点:教学难点:pH与溶液酸碱性强弱的关系,从H十和OH-的角度认识溶液酸碱性强弱的原因。
三、教学流程1.指导生举例生活中有酸味的食物--含有酸,列举生活中滑腻感的物质--含有碱,提出问题:化学上使用什么办法识别某种溶液是酸性还是碱性溶液?如何判断一种溶液的酸碱性强弱程度?2.酸碱指示剂的发现著名化学家罗伯特波义耳在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过了一会儿,紫色的花瓣上出现了红点点。
波义耳抓住这一意外的发现没有放弃,作出了各种假设,经过多次实验验证,终于获得了成功,从石蕊地衣中提取出最早的酸碱指示剂—紫色石蕊试液。
第一环节:通过实验探究“酸碱指示剂在不同溶液中的颜色变化”明确检验溶液酸碱性的方法。
[提出问题]:1、根据实验结果,上述溶液可以分为几种类型?2、能否用紫色石蕊试液或无色酚酞试液检验溶液的酸碱性?3、为什么用点滴板做溶液间反应的微型实验?[结果记录][引导归纳]:检验溶液酸碱性的方法有哪些?酸碱指示剂或酸碱试纸第二环节:通过阅读教材和实验探究明确怎样判断溶液酸碱性的强弱[指导阅读教材,提出问题]:1、溶液酸碱性的强弱程度跟什么有关?2、pH的范围如何规定?3、pH的大小与溶液酸碱性有什么关系?4、pH如何测定?[活动与探究]1、指导学生按所设计的方案进行实验探究,测定一些物质的pH,并按pH由小到大的顺序将式样排序。