芳香性的判断PPT课件
- 格式:ppt
- 大小:664.50 KB
- 文档页数:14

芳香性:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定.在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应,这种物理,化学性质称为芳香性. 一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把 n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π电子数的计算也许你在做题目的时候对于π电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,再加两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性. 两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,http://206.108.48.51/forumdisplay.php?fid=63。


芳香性:环状闭合共轭体系,π电子高度离域,具有离域能,体系能量低,较稳定.在化学性质上表现为易进行亲电取代反应,不易进行加成反应和氧化反应,这种物理,化学性质称为芳香性. 一,芳香性判据——Hückel规则Hückel规则:一个单环化合物只要具有平面离域体系,它的π电子数为4n+2(n=0,1,3,…整数),就有芳香性(当 n>7 时,有例外).对能看懂这篇文章的人说:苯有有芳香性,那就是废话了.非苯芳烃:凡符合Hückel规则,不含苯环的具有芳香性的烃类化合物,非苯芳烃包括一些环多烯和芳香离子等.二,一些非苯芳烃1.环多烯烃:(通式CnHn )又称作轮烯(也有人把 n≥10 的环多烯烃称为轮烯).环丁烯,苯,环辛四烯和环十八碳九烯分别称[4]轮烯,[6]轮烯,[8]轮烯和[18]轮烯.它们是否具有芳香性,可按Hückel规则判断,首先看环上的碳原子是否均处于一个平面内,其次看π电子数是否符合 4n+2.[18]轮烯环上碳原子基本上在一个平面内,π电子数为 4n+2(n=4),因此具有芳香性.又如[10]轮烯,π电子数符合 4n+2(n=2),但由于环内两个氢原子的空间位阻,使环上碳原子不能在一个平面内,故无芳香性.2,芳香离子:某些烃无芳香性,但转变成离子后,则有可能显示芳香性.如环戊二烯无芳香性,但形成负离子后,不仅组成环的 5 个碳原子在同一个平面上,且有 6 个π电子(n=1),故有芳香性.与此相似,环辛四烯的两价负离子也具有芳香性.因为形成负离子后,原来的碳环由盆形转变成了平面正八边形,且有 10 个π电子(n=2),故有芳香性.环戊二烯负离子其它某些离子也具有芳香性,例如,环丙烯正离子(Ⅰ),环丁二烯两价正离子(Ⅱ)和两价负离子(Ⅲ),环庚三烯正离子(Ⅳ).因为它们都具有平面结构,且π电子数分别位 2,2,6,6,符合4n+2(n 分别位0,0,1,1).具有芳香性的离子也属于非苯芳烃.3,稠环体系:与苯相似,萘,蒽,菲等稠环芳烃,由于它们的成环碳原子都在同一个平面上,且π电子数分别为 10 和 14,符合 Hückel 规则,具有芳香性.虽然萘,蒽,菲是稠环芳烃,但构成环的碳原子都处在最外层的环上,可看成是单环共轭多烯,故可用 Hückel 规则来判断其芳香性.与萘,蒽,等稠环芳烃相似,对于非苯系的稠环化合物,如果考虑其成环原子的外围π电子,也可用 Hückel 规则判断其芳香性.例如,薁(蓝烃)是由一个五元环和一个七元环稠合而成的,其成环原子的外围π电子有 10 个,相当于[10]轮烯,符合 Hückel 规则(n=2),也具有芳香性.三.π电子数的计算也许你在做题目的时候对于π电子数的计算弄糊涂了,比如:觉得怎么同是N原子怎么有时候要把它的孤对电子算进去,有时候又不要呢.我以前就是这样的,现在基本知道判断芳香性了,只是有点经验,有些具体原理我还是不懂.下面是我的一些心得体会,若有错误还请留言指正.下面用的例子中的杂原子是N,其他原子类推.吡咯的N的孤对电子要算进去,在家两双键上的4个电子,共有6电子,有芳香性.吡啶中N原子上连有双键,N上孤对电子不能算进去,三双键共轭,共有6个π电子,有芳香性. 两个N都与双键相连,孤对电子也都不算,还是6个π电子有一个N与双键相连,有一个没有.按以上的思路,与双键相连的N上的孤对电子不算进去,而右边的N原子上的孤对电子要算进去,结果也是6个π电子这种结构的也具有芳香性,看起来这个七元环没有达到共轭结构,我的也是经验,两双键中间隔了一个碳正离子,你就把这个碳正离子去掉再来计算π电子数,也是6个.注意:若隔的是碳负离子就不能这样了,一定要是碳正离子才可以这样算.这个和上面那个有点相似,但隔的是碳负离子,一个碳负离子算2个电子,图中有2个碳负离子,还有3个双键,有10个π电子.图中左边,一双键连接两个环,可以写出它的共振体,当然尽量往有芳香性的写,而且芳香性的环稳定,贡献大.这样下面的五元环有6π电子,上面的三元环有2π电子.都有芳香性.因为三键中两π键互相垂直,孤只有一个能与其他双键共轭,http://206.108.48.51/forumdisplay.php?fid=63。

芳香性怎么判断芳香性是一个有机化学的专业术语,指能产生芳香气味的有机化合物。
芳香性物质可以使香料更具气味,或者改变香料自身的味道。
有两种主要的芳香性物质:芳香烃和芳香醛。
这两种物质在化学上有很多重要的应用,它们能作为溶剂、催化剂和增塑剂等。
我们通常所说的合成药物就是通过这种方式制造出来的。
例如,许多药物具有不同程度且具有挥发性。
芳香烃类有很多重要用途,例如它是重要的有机合成原料,可以作为很多合成化学制品的原料等。
在一些场合下,比如当有异味出现时可以使用天然香料来去除;还可以用天然油、蜡或其它天然树脂来填充;还可以用天然石油或沥青作为溶剂等等。
一、芳香烃[芳香烃](C8~C18),即不饱和烃,是最常见的烃类化合物,有烷烃、环烷烃和芳香烃之分。
[芳香烃]具有强烈的气味,是一种有机化合物。
[芳香烷基](C-H)是最常见的芳香烃类。
[芳香烃中含有两个以上碳原子:一个碳为活泼氢、一个为活泼氧,故称之为双原子分子。
二、使用实例[芳香烃]是最常用的挥发性有机物,具有一定刺激性和毒性。
[芳香醛]挥发性小,易溶于水,可溶于乙醇、丙酮、乙醚、苯及许多有机溶剂,不溶于水。
[芳香烃和香茅醛]都是合成香料的重要原料,它主要是用来作溶剂及增塑剂等。
[芳香烃:苯、甲苯(或二甲苯)和乙腈(或甲酮)]具有很高的蒸气压。
(约为空气的100倍。
);对眼睛、呼吸道有刺激作用;吸入少量会引起咳嗽、头晕、头痛、恶心等症状。
[香茅醛的沸点很低,所以一般是做气体介质的。
三、结论芳香烃是一种芳香的物质,它比其他的有机化合物更具稳定性和挥发性。
芳香醛是一种有挥发性的化合物,主要用于挥发性的有机合成、药物合成等。
当芳香烃或芳香醛与不饱和卤素形成加成化合物时,它们具有较高的熔点,并且在加热时会有较高的粘度。
[例如,芳香烃分子可与烯烃形成加成化合物,这种加成反应称为亲核加成反应;也可发生氧化反应或开环反应,这种反应称为氧化加成作用;也可发生酯化反应、环化反应与还原产物。

芳香性的判断
一、芳香性的一般特征:
1. 分子中C/H的比例高(含多个不饱和键);
2. 键长平均化;
3. 分子共平面;
4. 不易加成、氧化,易发生亲电取代;
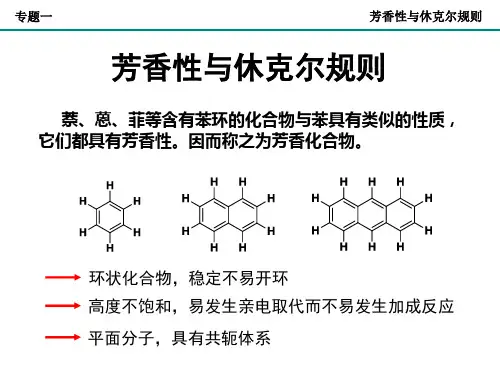
5. 符合Hǜckel规则(4n+2规律):单环多烯π电子数等于4n+2时,构成π电子的封闭体系表现出一定的芳香性。
从休克尔规则我们可以得知,具有芳香性的通常是具有如下四个特点的分子:
(1)它们是包括若干数目键的环状体系;
(2)它们具有平面结构,或至少非常接近平面(平面扭转不大于0.1nm);
(3)环上的每一个原子必须是sp 杂化(某些情况也可以是sp杂化);
(4)环上的电子能够发生离域。
分子具有芳香性的标志是:
(1)这类化合物虽有不饱和键,但不易进行加成反应,而与苯相似,容易进行亲电取代;
(2)通过氢化热或燃烧热对离域能的热化学测量表明,这类具有芳香性的环状分子比相应的非环体
系具有低的氢化热低的燃烧热,而显示特殊的稳定性。
(3)用物理方法和核磁共振谱进行测定,这类化合物的质子与苯及其衍生物的质子一样,显示类似
的化学位。
芳香性判断原则:1.环状体系;2.π电子数(4n+2规则);3.分子共平面。
判断下列化合物是否具有芳香性:
二、常见芳香性体系:杂环芳香体系:富烯衍生物:(富烯本身不稳定)。



芳香性的判断
Hückel 规则 具有平面结构的单环共轭多烯(轮烯),π电子数为4n +2 时具有芳香性。
1954年Platt(伯朗特)提出了周边修正法,认为可以忽略稠环中间的桥键, 直接计算在外围可形成离域的π电子数,是Hückel 规则的补充和完善。
14e ,有 14e ,有 14e ,有 10e ,有 12e ,无
画经典结构式时,应使尽量多的双键处在轮烯上,处在轮烯内外的双键写成其共振的正/负电荷形式,将出现在轮烯内外的单键忽略后,再用Hückerl-Platt 规则判断。
应使双键尽量多处于轮烯上,从共振式B 或C 判断,显然是有芳香性的,周边14e,有芳香性。
,有芳香性
F 12e
判断无芳香性,与实验相符。
CH 2
N N H H N N
A A 周边6个双键, 直接判芳香性错!C
下面提供一些其它例子,供大家判断芳香性:
6e
6e。
32芳香性的判别主要内容31芳香性的概念33芳香性化合物的结构特征与反应性34知识拓展:C50、C60 富勒烯的材料性能一、芳香性概念芳香化合物(Aromatic compound)也称气味成分、芳香成分、香味成分或香料成分,是一种具有气味或味道的化合物。
芳香性(Aromaticity)“芳香的(aromatic)”概念最早在1855年由August Wilhelm Hofmann在论文中提出,是指含苯基一类化合物的味觉特性。
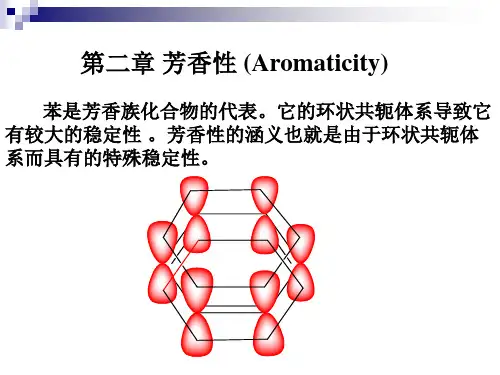
一、芳香性概念一、芳香性概念一、芳香性概念芳香性(Aromaticity)1931年物理化学家Erich Armand Arthur Joseph Hückel首次建模,提出苯稳定性的量子力学基础。
芳香性:是指分子具有环状闭合共轭体系,π电子高度离域,具有离域能(共轭能),体系能量低,分子结构很稳定。
(结构特性)面芳香性----→3D芳香性二、芳香性的判别6个π电子(n=1);有芳香性电子(n=2);有芳香性二、芳香性的判别血红素Heme含22个π电子(n=5),有芳香性。
二、芳香性的判别例2 非苯系烃:环状分子、正、负离子二、芳香性的判别例2 非苯系烃:环状分子、正、负离子有芳香性环戊二烯负离子环辛四烯双负离子10个电子迁移,每环6个π电子共平面或近平面,扭转≤0.1nm[10]轮烯[14]轮烯面性被破坏,无芳香性。
二、芳香性的判别例4 杂环化合物的芳香性???吡啶吡咯π电子数6个例4 杂环化合物的芳香性(续)π电子数6个环戊烯基负离子吡咯呋喃噻吩例4 杂环化合物的芳香性(续)嘧啶咪唑π电子数6个三、芳香化合物结构特征与反应性苯的稳定性-共轭能环己三烯苯分子基态的性质环骨架很稳定。
不容易被化学试剂所破坏。
抗磁性。
环状闭合共轭体系,电子高度离域,基态分子受外磁场诱导产生抗磁性环电流。
芳香性化合物反应表现---与不饱和烃相比易取代; 难加成; 难氧化。
三、芳香化合物结构特征与反应性三、芳香化合物结构特征与反应性四、知识拓展富勒烯Fullerene-结构与性能 三维分子芳香性???富勒烯芳香性-C60?C50?1.1960年代非面芳香结构受关注,碗烯被合成,C60H60有拓扑结构;2.1971年日本大泽映二在《芳香性》书中描述了C60分子设想;3.1985年英国克罗托(H.W.Kroto)等获得C60的质谱图,以建筑学家姓名命名C60:Buckminster Fuller ene,即富勒烯Fullerene;4.1990年,克利斯莫等第一次报道大量合成C60的方法;5.1995年,伍德制备开孔富勒烯;6.1996年,克罗托等3人因发现富勒烯获诺贝尔奖;7.2000年,Andreas Hirsch提出电子计数规则:π电子数若满足2(N+1)2,则该三维分子有芳香性。