高三化学 二轮复习 离子反应
- 格式:ppt
- 大小:560.50 KB
- 文档页数:17

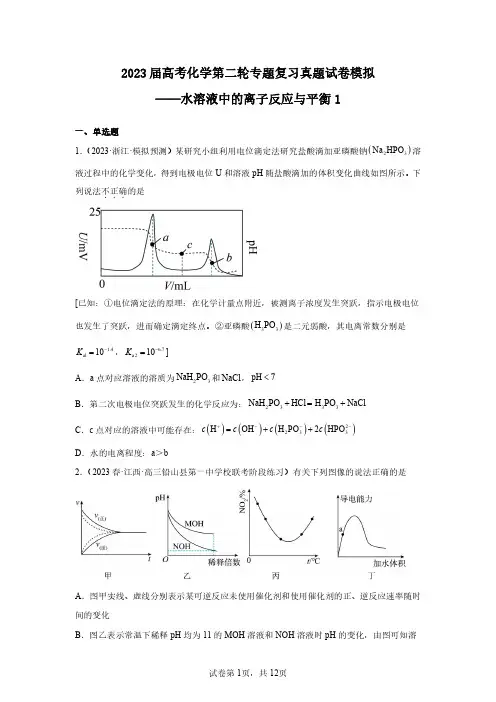
2023届高考化学第二轮专题复习真题试卷模拟——水溶液中的离子反应与平衡1一、单选题[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。
②亚磷酸(H 1.4al 10K -=, 6.7a 210K -=]A .a 点对应溶液的溶质为32NaH PO 和NaCl ,pHB .第二次电极电位突跃发生的化学反应为:NaHC .c 点对应的溶液中可能存在:()()H OH c c +-=D .水的电离程度:a >b2.(2023春·江西·高三铅山县第一中学校联考阶段练习)有关下列图像的说法正确的是A .图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化B .图乙表示常温下稀释pH 均为11的MOH 溶液和NOH 溶液时pH 的变化,由图可知溶A .()-2.3b K ROH =10B .P 、Q 点对应溶液中()()++c R c H 的值:P Q>C .若将溶液无限稀释,溶液中()(+2-4c R 2c SO ≈D .相同条件下,若改为()124c R SO =0.2mol L -⋅4.(2023秋·浙江宁波·高三统考期末)下列溶液因盐的水解而呈酸性的是A .K SO 溶液B .NaHCO 溶液CA .完全沉淀废液中的2Pb +,I -的效果不如B .z 点,()()(2-2+3sp Q=c CO c Pb <K PbCO ⋅C .()sp 2K PbI 的数量级为1410-A .A -是HA 的共轭碱C .增大pH 过程中,()()A HA c c -的值减小()()HA A 1.0δδ-+=9.(2023·辽宁·模拟预测)难溶物2SrF 可溶于盐酸。
常温下,用A .1L 代表()2+-lgc Sr 与()()+c HF lg c H ⎡⎤⎢⎥⎢⎥⎣⎦的变化曲线B .a 、c 两点的溶液中均存在(2c Sr C .()a K HF 的数量级为710-D .c 点的溶液中存在()(2+-c Sr>c Cl 10.(2023·全国·模拟预测)某元素M(OH)3(s)M 3+(aq)+3OH -(aq)、A .曲线①代表lgc(M 3+)与pH 的关系B .M(OH)3的K sp 为1×10-33.5C .4.5≤pH≤9.3时,体系中元素M 主要以D .M(OH)4-与M 3+在溶液中可以大量共存11.(2023·山东·模拟预测)室温下,向柠檬酸A .C 6H 8O 7的K a1为10−3.13B .曲线b 表示δ(677C H O -)随pH 的变化C .在C 6H 6Na 2O 7溶液中,(677C H O -)>(66C H OD .pH 大于6时,发生的反应主要为2667C H O -12.(2023·辽宁·模拟预测)25℃时,用同一NaOH 溶液,pM[p 表示负对数,M 表示()()-c A c HA 、(c CuA .HA 为一元弱酸,25℃时7.4a K =10-B .线①代表滴定4CuSO 溶液时pM 与溶液C .滴定HA 溶液至x 点时,溶液中()()()()()-++-c HA >c A >c Na >c H >c OH D .滴定4CuSO 溶液至x 点时,改为滴加HA 溶液,沉淀逐渐完全溶解二、多选题A .25℃时,BOH 的电离平衡常数的数量级为10-4B .t=0.5,2c(H +)+c(B +)=2c(OH -)+c(BOH)C .P 1所示溶液:c(Cl -)>0.05mol·L -1D .P 2所示溶液:c(B +)>100c(BOH)14.(2023春·山东滨州·高三统考开学考试)25℃时,用HCl 气体调节0.1mol 体系中微粒浓度的对数值(lgc)与pH 的关系如图1所示(a 、b 、c 、d 线分别对应体系中除下列说法错误的是A .4NH Cl 水解平衡常数的数量级为1010-B .3P 对应溶液;()-1c Cl 0.05mol L-<⋅C .水的电离程度:123P P P <<D .4P 对应溶液:()()()-+4323c Cl =2c NH +2c NH H O⋅三、工业流程题常温下,有关金属离子开始沉淀和沉淀完全的pH 见下表:金属离子3Fe +3Al +2Mg +2Ca +(1)萃取塔中经过______(填写操作名称)可将含酚有机层分离出来。



安徽省2021届高三化学 二轮复习 全国I 卷 离子方程式(一)1.下列反应的离子方程式正确的是( ) A .2MnO 与浓盐酸混合加热:+-2MnO +4H +4C1 222MnCl +C1+2H O ↑B .向65C H ONa 溶液中通入少量CO 2:-6522653C H O +CO +H O C H OH+HCO -→ C .酸性条件下,用22H O 将Fe 2+转化为3+Fe :2++3+222H O +Fe +2H Fe +2H OD .将Cu 片溶于稀硝酸中:2322Cu 4H 2NO Cu 2NO 2H O +-++++↑+2.下列反应对应的离子方程式正确的是( ) A .将铁粉加入盐酸中:322Fe 6H 2Fe 3H ++++↑B .NaOH 溶液中加入Al 粉:222Al 4OH 2AlO 2H O --++C .NaOH 溶液通入过量2CO :23OH CO HCO --+D .()2Ba OH 溶液与稀硫酸:2244Ba SO BaSO +-+↓3.下列解释事实的方程式不正确的是( )A.用食醋清洗水垢:233322CO 2CH COOH2CH COO H O CO --+++↑B.“84”消毒液与洁厕灵混用产生有毒气体:22ClO Cl 2H Cl H O --+++↑+C.用氢氧化铝治疗胃酸过多:332Al(OH)3H Al 3H O ++++D.用硫化钠除去废水中的汞离子:22Hg S HgS +-+↓4.下列反应的离子方程式不正确的是( ) A .铁与稀盐酸反应:222Fe 6H 2Fe 3H ++++↑B .氢氧化钠溶液与盐酸反应:2OH H H O -++C .锌与硫酸铜溶液反应:22Zn Cu Zn Cu ++++D .氯化钡溶液与稀硫酸反应:2244Ba SO BaSO +-+↓5.下列反应的离子方程式正确的是( )A.碳酸钠的水溶液呈碱性:23223CO 2H OH CO 2OH --++B.用3CH COOH 溶解3CaCO :233322CO CH COOH CH COO H O CO --+++↑C.向3Fe(OH)胶体中加入氢碘酸溶液:332Fe(OH)3H Fe 3H O ++++D.向氯化亚铁溶液中通入氯气:2322Fe Cl 2Fe 2Cl ++-++6.铝自然形成的氧化膜易脱落。

离子反应方程式正误判断1.常温下,部分弱酸的电离平衡常数如表。
下列离子方程式书写正确的是 化学式H 2CO 3 HClO H 2S 电离常数K a1=4×10-7 K a2=5.6×10-11 K a =4.7×10-8 K a1=1.3×10-7 K a2=7.1×10-15A .向Na 2CO 3溶液中滴加少量氯水:CO 23-+2Cl 2+H 2O=CO 2↑+2HClO+2Cl -B .向Na 2S 溶液中通入过量CO 2:S 2-+2H 2O+2CO 2=H 2S↑+2CO 23-C .向NaClO 溶液中通入少量CO 2:CO 2+ClO -+H 2O=HCO 3-+HClOD .向NaClO 溶液中通入过量H 2S :H 2S+ClO -=HS -+HClO2.能正确表示下列反应的离子方程式的是A .23Fe O 与HI 溶液充分反应:22322=Fe O 6H 2I 2Fe I 3H O +-+++++B .KClO 碱性溶液与3Fe(OH)反应:23423ClO 2Fe(OH)=2FeO 3Cl 4H H O ---+++++ C .3NaHSO 在溶液中的水解方程式:23233HSO H O H O SO -+-++D .碳酸钙溶于醋酸:23222CaCO 2H =Ca CO H O ++++↑+3.将工业废气中的SO 2吸收能有效减少对大气的污染,并实现资源化利用。
下列化学反应表示正确的是A .硫酸型酸雨露置于空气中一段时间后溶液酸性增强:H 2SO 3+O 2=2H ++SO 24-B .用Ca(ClO)2溶液吸收废气中的SO 2:Ca(ClO)2+SO 2+H 2O=2HClO+CaSO 3↓C .用过量氨水吸收废气中的SO 2:NH 3•H 2O+SO 2=NH 4HSO 3D .用过量饱和Na 2CO 3溶液吸收废气中的SO 2:2CO 23-+SO 2+H 2O=SO 23-+2HCO 3-4.下列指定反应的离子方程式正确的是A .钠与水反应:22Na 2H O Na 2OH H +-+=++↑B .向3AlCl 溶液中加入足量氨水:33234Al 3NH H O Al(OH)3NH +++⋅=↓+C .用石墨电极电解2MgCl 溶液:2222Cl 2H O2OH H Cl --++↑+↑电解 D .碱性条件下,2NaClO 将NO 氧化为3NO -:2233ClO 4NO 2H O 3Cl 4NO 4H ---+++=++5.化学创造美好生活。


专题三离子反应与氧化还原反应真题研练·析考情【真题研练】1.[2022·全国甲卷]能正确表示下列反应的离子方程式为( )A.硫化钠溶液和硝酸混合:S2-+2H+===H2S↑B.明矾溶液与过量氨水混合:Al3++4NH3+2H2O===Al O2−+4N H4+C.硅酸钠溶液中通入二氧化碳:Si O32−+CO2+H2O===HSi O3−+HC O3−D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:Ba2++2OH-+2H++SO42−===BaSO4↓+2H2O2.[2022·广东卷]为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3% NaCl溶液中。
一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )A.加入AgNO3溶液产生沉淀B.加入淀粉碘化钾溶液无蓝色出现C.加入KSCN溶液无红色出现D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成3.[2022·湖南卷]科学家发现某些生物酶体系可以促进H+和e-转移(如a、b和c),能将海洋中的N O2−转化为N2进入大气层,反应过程如图所示。
下列说法正确的是( )A.过程Ⅰ中N O2−发生氧化反应B.a和b中转移的e-数目相等C.过程Ⅱ中参与反应的n(NO)∶n(N H4+)=1∶4D.过程Ⅰ→Ⅲ 的总反应为N O2−+N H4+===N2↑+2H2O4.[2022·辽宁卷] 镀锌铁钉放入棕色碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。
下列说法正确的是( ) A.褪色原因为I2被Fe还原B.液体分层后,上层呈紫红色C.镀锌铁钉比镀锡铁钉更易生锈D.溶液恢复棕色的原因为I-被氧化5.[2021·山东卷](双选)实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )A.G与H均为氧化产物B.实验中KMnO4只作氧化剂C.Mn元素至少参与了3个氧化还原反应D.G与H的物质的量之和可能为0.25 mol【考情分析】核心突破·提能力考点1 离子反应【核心梳理】1.离子方程式正误判断的基本方法2.离子共存问题审题“三大”注意(1)审清题干中的要求:①一定能大量共存;②可能大量共存;③不能大量共存。


2023年高三化学二轮复习选择题专题二——氧化还原和离子反应1.(2022·湖南常德模拟预测)下列方法正确且涉及氧化还原反应的是( ) A .工业上电解熔融状态MgO 制备Mg B .可用CS 2试剂洗涤试管壁上的S C .利用单质Al 与NaOH 溶液制Al(OH)3 D .用稀硝酸可除去试管壁上的Ag 答案 D解析 MgO 熔点高,不能用电解熔融MgO 的方法制备Mg ,工业上用电解熔融MgCl 2制备镁,A 不符合题意;S 易溶于CS 2,可用CS 2试剂洗涤试管壁上的S ,不涉及氧化还原反应,B 不符合题意;Al 与NaOH 溶液反应生成偏铝酸钠和氢气,不能用来制取氢氧化铝,C 不符合题意;稀硝酸和Ag 反应生成硝酸银、一氧化氮和水,有元素化合价的变化,属于氧化还原反应,D 符合题意。
2.下列过程与氧化还原反应无关的是( ) A .氢氧燃料电池作为电源供电 B .月饼包装袋中还原铁粉防氧化的过程C .《淮南万毕术》记载:“白青,得铁即化为铜”D .利用ZnCl 2溶液除铁锈 答案 D解析 氢氧燃料电池的本质是通过一个可自发进行的氧化还原反应将化学能转化为电能,A 正确;还原铁粉防氧化的过程是氧气与铁粉发生了氧化还原反应,B 正确;“白青,得铁即化为铜”是金属铁与铜离子发生了置换反应,属于氧化还原反应,C 正确;ZnCl 2溶液除铁锈,利用了Zn 2+水解呈酸性的特性,没有发生元素化合价的升降,不属于氧化还原反应,D 错误。
3.(2022·四川遂宁二模)常温下,下列各组离子在指定溶液中能大量共存的是( ) A .在澄清透明的溶液中:Fe 3+、Mn 2+、SO 2-4、Cl -B .能使甲基橙显红色的溶液中:Zn 2+、H +、ClO -、I -C .含0.1 mol·L-1NaHSO 4的溶液:K +、Al 3+、NO -3、SiO 2-3D.c (H +)c (OH -)=1.0×10-12的溶液:NH +4、Na +、HCO -3、NO -3 答案 A解析 在澄清透明的溶液中:Fe 3+、Mn 2+、SO 2-4、Cl -之间相互不反应,能大量共存,选项A 正确;能使甲基橙显红色的溶液呈酸性,H +、ClO -、I -之间因发生氧化还原反应而不能大量共存,选项B 错误;含0.1 mol·L-1NaHSO 4的溶液中H +与SiO 2-3反应生成沉淀而不能大量共存,选项C 错误;c (H +)c (OH -)=1.0×10-12的溶液呈碱性,NH +4、HCO -3与氢氧根离子反应而不能大量存在,选项D 错误。

离子反应氧化还原反应(45分钟100分)一、选择题(本题包括6小题,每小题6分,共36分)1.PM2.5细颗粒物含有的毒性物质来源之一是汽车尾气排放。
通过排气管加装催化装置,可有效减少CO和NO的排放,催化装置内发生的反应为NOx+CO N2+CO2,下列关于此反应的说法中,不正确的是()A.所涉及元素中原子半径:C>N>OB.当x=2时,每生成1 mol N2,转移电子数为4 molC.等物质的量的N2和CO2中,共价键的个数比为3∶4D.氧化剂与还原剂的物质的量之比为1∶1时,NOx中氮元素的化合价为+2价2.(2013·天津南开区联考)下列说法正确的是()A.当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移B.将1.5 mol Br2通入2 mol FeI2溶液中的离子方程式为3Br2+2I-+4Fe2+====6Br-+ I2+4Fe3+C.用浓盐酸酸化KMnO4溶液以增强其氧化性D.在3NO2+H2O====2HNO3+NO中,氧化剂和还原剂的质量比为1∶23.(2013·上海高考)已知氧化性Br2>Fe3+。
FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为aFe2++bBr-+cCl2→dFe3++eBr2+fCl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是()A.24322 6B.02101 2C.20120 2D.22221 44.(2013·安徽高考)下列分子或离子在指定的分散系中能大量共存的一组是()A.银氨溶液:Na+、K+、N错误!未找到引用源。
、NH3·H2OB.空气:C2H2、CO2、SO2、NOC.氢氧化铁胶体:H+、K+、S2-、Br-D.高锰酸钾溶液:H+、Na+、S错误!未找到引用源。
、葡萄糖分子选项实验操作离子方程式A 在铁和铝混合物中加入足量氢氧化钠溶液,过滤除去铝2Al+2OH-+H2O====2Al错误!未找到引用源。
专题强化训练三离子反应氧化还原反应高频考点一、离子共存1.离子共存的判断几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的“四个要点”判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色离子Cu2+Fe3+Fe2+MnO-4溶液颜色蓝色棕黄色浅绿色紫红色(2)二性——溶液的酸、碱性①在强酸性溶液中,OH-及弱酸根阴离子(如CO2-3、SO2-3、S2-、CH3COO-等)不能大量存在。
②在强碱性溶液中,H+及弱碱阳离子(如NH+4、Al3+、Fe3+等)不能大量存在。
(3)三特殊——三种特殊情况①AlO-2与HCO-3不能大量共存:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3。
②“NO-3+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO2-3等还原性的离子发生氧化还原反应而不能大量共存。
③NH+4与CH3COO-、CO2-3,Mg2+与HCO-3等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中仍能大量共存。
(4)判断离子能否共存的四种反应类型①复分解反应:如Ba2+与SO2-4,NH+4与OH-,H+与CH3COO-等。
②氧化还原反应:如Fe3+与I-、S2-,NO-3(H+)与Fe2+等。
③相互促进的水解反应:如Al3+与CO2-3、HCO-3或AlO-2等。
④络合反应:如Fe3+与SCN-等。
3.常见阳离子的检验与推断依据根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
离子共存判断题中常见的限制条件 限制条件 分析解读无色溶液有色离子不能大量共存(透明溶液可能含有色离子) 使甲基橙呈红色或pH =1 溶液显酸性,OH -及弱酸的酸根离子不能大量共存 遇酚酞呈红色或pH =13溶液呈碱性,H +及弱碱的阳离子、弱酸的酸式酸根离子不能大量共存与Al 反应放出H 2 溶液可能显酸性,也可能显强碱性,显酸性时不能含NO -3 由水电离出的c (H +)=1×10-13mol·L -1溶液可能显酸性,也可能显碱性 通入足量的CO 2(或NH 3) 溶液呈酸性(或碱性)因发生氧化还原反应而不能大量共存能发生氧化还原反应的氧化性离子和还原性离子不能大量共存“一定”“可能”还是“不能”大量共存确定是“可能性”还是“肯定性”加水稀释,c (H +)c (OH -)减小 说明该溶液呈酸性[稀释的是溶质,溶质c (H +)减小,而c (OH -)增大] 某溶液的lg c (H +)c (OH -)=12 该溶液呈酸性高频考点二、氧化还原反应的五规律 1.守恒律化合价升高总数与降低总数相等,实质是反应中失电子总数与得电子总数相等。
专题03 离子反应方程式和离子共存1.(2021·四川省成都市第一次诊断)对下列实验,一定能正确描述其反应过程的离子方程式是( ) A .向稀硝酸中加入过量铁粉:Fe +4H ++ NO -3 =Fe 3++NO↑+2H 2OB .向饱和Na 2CO 3溶液中滴入几滴稀AlCl 3溶液:2A13++3CO 2-3+3H 2O=2Al(OH)3↓+3CO 2↑C .乙酸乙酯与稀NaOH 溶液共热:CH 3COOC 2H 5+OH -→ CH 3COO -+C 2H 5OHD .向长期露置于空气的酸性KI 溶液先后滴入几滴FeCl 3溶液和淀粉溶液,立即出现蓝色2Fe 3++2I -=2Fe 2++I 2【答案】C【解析】铁粉过量生成Fe 2+,离子方程式为+-2+323Fe +8H + 2NO =3Fe +2NO +4H O ↑,故A 错误;AlCl 3少量2-3CO 过量,只发生第一步水解生成-3HCO ,离子方程式为()3+2--3233A1+3CO +3H O=Al OH +3HCO ↓,故B 错误;乙酸乙酯在碱性条件下水解生成CH 3COO -和C 2H 5OH ,故C 正确;长期露置于空气的KI 被氧气氧化,生成I 2,遇到淀粉立即出现变蓝,离子方程式为+-222O +4I =+4H +I 2H 2O ,故D 错误;故选C 。
2.(2021·云南省红河州统一检测)常温下,下列各组离子在有关限定条件下一定能大量共存的是( ) A .酸性溶液中:K +、Na +、Fe 2+、NO 3-、Cl -B .中性溶液中:K +、Fe 3+ 、Cl -、CO 23-、HCO 3-C .常温下,C(H +)/C(OH -)=1×10-12的溶液:K +、AlO 2-、CO 23-、Na +、Cl -D .pH =13的溶液中:AlO 2-、Cl -、HCO 3-、SO 24-【答案】C【解析】酸性溶液中:H +、Fe 2+、NO 3-能发生氧化还原反应,不能大量共存,A 与题意不符;中性溶液中:Fe 3+和CO 23-或HCO 3-发生双水解反应,不能大量共存,B 与题意不符;常温下,C(H +)/C(OH -)=1×10-12的溶液呈碱性,K +、AlO 2-、CO 23-、Na +、Cl -、OH -之间不反应,能大量共存,C 符合题意;pH =13的溶液呈碱性, HCO 3-、OH -反应生成碳酸根离子和水,不能大量共存,D 与题意不符;答案为C 。
专题三离子反应学习目标:1、了解离子反应的概念、离子反应发生的条件。
2、掌握离子方程式的书写。
3、能正确判断离子是否大量共存。
4、了解常见离子的检验方法。
学习重难点:离子方程式的书写、离子共存、离子检验自主学习一、电解质及其电离【知识回顾】1.电离电解质在水溶液中或熔融状态下产生自由移动离子的过程。
2.电解质和非电解质(1)电解质是在水溶液中或熔融状态下能够导电的化合物。
(2)非电解质是在水溶液中和熔融状态下都不能导电的化合物。
3.强电解质和弱电解质在水溶液中完全电离的电解质叫强电解质。
在水溶液中部分电离的电解质叫弱电解质。
4.依据元素周期表,记忆常见强弱电解质ⅠA:除LiOH外其余都是强碱。
ⅡA:除Mg(OH)2、Be(OH)2外其余都是强碱。
ⅢA:Al(OH)3是两性氢氧化物。
ⅣA:H2CO3、H2SiO3均为弱酸。
ⅤA:强酸:HNO3中强(或弱)酸:HNO2、H3PO4。
ⅥA:强酸:H2SO4弱酸:H2SO3、H2S。
ⅦA:强酸:HCl、HBr、HI、HClO4等弱酸:HF、HClO等。
过渡元素中常见的弱碱:Fe(OH)3、Fe(OH)2、Cu(OH)2、Zn(OH)2等。
注意盐不论难溶、易溶,绝大多数都是强电解质。
二、离子反应1.离子反应(1)概念:有离子参加或有离子生成的反应统称为离子反应。
(2)离子反应的条件①生成难溶的物质;②生成难电离的物质;③生成易挥发的物质;④发生氧化还原反应。
(3)离子反应的本质离子反应的本质是溶液中某些物质的物质的量的减少。
2.离子方程式(1)离子方程式:用实际参加反应的离子符号来表示反应的式子。
(2)离子方程式的意义离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应。
正误辨析正误判断,正确的打“√”,错误的打“×”(1)银和食盐水都能导电,都属于电解质( )(2)AgCl、BaSO4等不溶于水,都属于弱电解质( )(3)HClO是弱酸,但NaClO是强电解质( )(4)在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质( )(5)Na2O固体与水反应:O2-+H2O===2OH-( )(6)醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑()(7)Fe(OH)3和稀硫酸的反应:OH-+H+===H2O( )(8)硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO2-4===BaSO4↓()答案(1)×(2)×(3)√(4)√(5)×(6)×(7)×(8)×【题组集训】题组一准确判断概念1.下列说法正确的是( )A.金属能导电,所以金属是电解质B.Cl2的水溶液能导电,所以Cl2是电解质C.硫酸在水溶液中能完全电离,所以硫酸是强电解质D.SO2、NH3的水溶液能导电,所以SO2、NH3均是电解质答案 C2.下列说法正确的是( )A.BaSO4的水溶液导电性很弱,故它是弱电解质B.强电解质溶液的导电性比弱电解质溶液的导电性强C.弱电解质溶液中存在多种共价化合物分子D.强电解质都是离子化合物,弱电解质都是共价化合物答案 C题组二电离方程式的书写——理解离子反应的基石3.写出下列典型物质在溶液中的电离方程式(注:如无特别说明,均指在水溶液中的电离)。
[考纲要求] 1.了解氧化还原反应的本质,了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
2.能正确书写化学方程式和离子方程式,并能进行有关计算。
3.了解离子反应的概念、离子反应发生的条件。
掌握常见离子的检验方法。
考点一氧化还原反应(一)理清两条概念线索1.按要求回答下列问题4FeS2+11O2===2Fe2O3+8SO2(1)用双线桥法表示该反应电子转移的方向和数目。
________________________________________________________________________。
(2)氧化剂________,还原剂________;氧化产物________,还原产物________。
答案(1)(2)O2FeS2Fe2O3、SO2Fe2O3、SO22.根据化合物中各元素化合价代数和等于零原则,写出括号内相应元素的化合价。
NaClO2(Cl:________)、ClO2(Cl:________)、CuCl(Cu:________)、N2H4(N:________)、NaBH4(B:________)、2Cr2O7(Cr:________)、Na2CrO4(Cr:________)、H2C2O4(C:________)、Na2S2O3(S:________)、MnO(OH)2(Mn:________)、2FeO4(Fe:________)、CuFeS2(Fe:________、S:________)、LiNH2(N:______)、LiCoO2(Co:________)答案+3+4+1-2+3+6+6+3+2+4+6+2-2-3+3 (二)掌握氧化还原反应的规律1.写出证明氧化性、还原性强弱的离子方程式。
(1)氧化性强弱顺序:MnO4>Cl2>Br2>Fe3+>Cu2+。
①MnO4>Cl2:__________________________。
2021届高中化学高三第二轮复习——认识化学科学:离子反应专题训练一、单选题1.下列说法正确的是( ) A .石墨导电,所以是电解质B .SO 2的水溶液导电,所以SO 2是电解质C .固体NaCl 不导电,所以NaCl 是非电解质D .CaCO 3在水中难溶但熔融状态下能导电,所以CaCO 3是电解质 2.室温下,下列离子组在给定条件下一定能大量共存的是( ) A .pH=1的溶液中:+K 、+Na 、-2NO 、-3CH COO B .使甲基橙变红的溶液中:+4NH 、3+Al 、2-4SO 、2+MgC .KSCN 溶液中:+Na 、3+Fe 、2-4SO 、-ClD .()-c ClO =1.0mol/L 的溶液:+K 、2-3SO 、2-S 、-Cl3.限用硫酸、盐酸、醋酸、钠盐、钾盐、钡盐两两相互反应,符合+2-3222H +CO ===H O+CO ↑的反应个数有( )种 A .4B .6C .8D .104.已知:SO 23-+I 2+H 2O=SO 24-+2I -+2H +,某无色溶液中可能含Na +、NH 4+、Cu 2+、K +、I -、SO 23-、SO 24-,且所含离子物质的量浓度均相等。
向溶液中滴加少量氯水,溶液呈无色。
下列关于该溶液的判断中正确的是( ) A .肯定不含I -B .可能含有Cu 2+C .至少含有Na +、NH 4+、K +中的两种D .不能确定是否含有SO 24-5.下列物质的水溶液,不存在电解质分子的是(水分子除外)( ) A .HClB .CH 3COOHC .NH 3D .HClO6.某溶液在25℃时由水电离产生的H +浓度为1×10-12mol·L -1,下列说法正确的是 A .该溶液的pH 一定为2 B .该溶液的pH 一定为12C .Fe 3+、SCN -、Na +在该溶液中一定能大量共存D .-3HCO 、HS -、2-4HPO 在该溶液中不能大量共存7.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象相同的是( ) A .Na 2CO 3和 HCl B .AlCl 3和NaOH C .Ca(OH)2 和Ba(HCO 3)2D .NaAlO 2和H 2SO 48.下列化学用语或描述中,正确的是( ) A .对硝基甲苯的结构简式:B .SO 3的水溶液能导电,说明SO 3是电解质C .四氯化碳的电子式:D .CO 2的比例模型:9.为探究某些硫的含氧酸盐的部分性质,进行如下实验,并记录实验现象。