LAMP技术原理和引物设计
- 格式:doc
- 大小:24.50 KB
- 文档页数:2


lamp等温扩增技术原理LAMP等温扩增技术是一种高灵敏度的基于序列特异性寡核苷酸探针的新型核酸检测方法,由于其极高的灵敏度、特异性和快速性,广泛应用于疾病的诊断与研究中。
该技术的原理可以分为以下步骤:第一步:沙门氏菌DNA引物的特异性结合并扩增LAMP等温扩增技术采用一组详细的引物设计,使其具有高度特异性,能够在目标核酸序列的正常条件下,加速酶间反应来扩增目标序列。
针对沙门氏菌的DNA扩增,引物组成为2个反向外部引物、2个内部引物和一个环引物。
反向外部引物的特异性结合在目标DNA序列的外侧,内部引物则在外部引物结合后依次将产物扩增。
环引物在推进反向内外部引物的条件下,促进并加速扩增反应的进行。
该技术最大的优势在于,即使非特异性的DNA序列存在,也能在反应系统中抑制它们的扩增,从而提高扩增产物的特异性。
第二步:单管内扩增反应LAMP等温扩增技术在单个反应管中完成扩增,因此省去了扩增过程中由于分离和清洗产物所需的步骤,从而能够提高扩增的效率。
同时,该技术利用因特异性扩增反应而产生的大量产物来实现放大反应信号。
由于其不需要复杂的设备,仅需要水槽温度控制器和能够给温度控制提供稳定电源的仪器即可完成。
整个扩增过程中,所有反应物成分的变化均与恒定温度下运行。
第三步:利用Dye负电荷的反应性质由于在反应中引物的选取和调额完全根据目标DNA的序列比对所进行,因此LAMP等温扩增技术具有绝对的特异性。
同时,其采用的是特殊的Dye(反应染色),具有负电荷和荧光反应性质,在在反应完成后,在阳性结果的情况下,消耗成本非常低。
而在负性结果的情况下,由于该Dye信号使读取结果清晰方便。
由此,LAMP等温扩增技术结果得到广泛的应用,例如疾病的检测、环保检测等领域,得到了广泛应用。
疫情爆发的现实情况促使LAMP等温扩增技术得到了更广泛的应用,因为该技术的使用,并不需要高技术门槛和特别条件,能够在不同的场景中提供高效、可靠、精确的检测结果,不仅在意大利等高发疫区广泛应用,也得到了世界范围内各国科研人员和医务行业的关注和使用。

lamp原理和应用情况
LAMP 原理:
环介导等温扩增法(loop-mediated isothermal amplification,LAMP),是一种新型的核酸扩增方法,其特点是针对靶基因的6个区域设计4种特异引物,在链置换DNA聚合酶(Bst DNA polymerasc)的作用下,60--65℃恒温扩增,15-60rain左右即可核酸扩增,效率可达109~10m个数量级,具有操作简单、特异性强、产物易检测等特点。
在DNA合成时,从脱氧核酸三磷酸基质(dNTPs) 中析出的焦磷酸根离子与反应溶液中的镁离子反应,产生大量焦磷酸镁沉淀,呈现白色。
因此,可以把浑浊度作为反应的指标,只用肉眼观察白色浑浊沉淀,就能鉴定扩增与否,而不需要繁琐的电泳和紫外观察。
由于LAMP反应不需要PCR 仪和昂贵的试剂,有着广泛的应用前景。
LAMP法的应用领域:
灵活运用能够简单、快速地进行基因扩增的特征,在各个领域得到广泛应用
食品领域:食物中毒致病菌的检测,食品的卫生管理,食物中毒的防止;
临床领域:病原菌、病毒的检测及鉴定,通过SNP多态性分型决定用药量;
农业领域:植物病害的早期发现及蔓延防止,转基因作物的检测;
环境领域:环境、水中病原微生物的检测;
工业领域:工业产品用大量DNA的生产成为可能;
畜牧业领域:雌雄性别判断,病原微生物的检测,遗传病的发现.。

LAMP技术及其在微生物检测中的应用近年来,随着食品安全事件的频繁发生,食品安全问题受到了越来越多的重视。
然而,在食品微生物检测过程中,传统的检测方法已经远远不能满足微生物快速、简易、高特异性的鉴定要求。
随着分子生物学技术的发展,核酸扩增法已经被广泛应用于病原微生物的鉴定,LAMP法(即环-媒恒温核酸扩增方法)就是近几年发展起来的新技术之一。
1 LAMP技术简介1.1 LAMP技术原理LAMP法是由Notomi等[1]于2000年开发出来的一种连续、恒温、基于酶反应的新型核酸扩增方法,其原理是针对靶基因的6个区域设计两对特殊的内、外引物,利用一种链置换DNA聚合酶(Bst酶)在恒温条件(60-65℃)下启动循环链置换反应。
在靶标DNA区启动互补链合成,结果在同一链上互补序列周而复始形成有很多环的花椰菜结构的茎-环DNA混合物。
LAMP反应过程中,从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物(焦磷酸镁)形成乳白色沉淀,加入显色液,即可通过肉眼观察判定扩增与否。
1.2 LAMP技术的优缺点1.2.1 优点1.2.1.1 特异性强、灵敏度高4条引物可以严格识别靶核酸序列上的6个独立区域,反应过程不会受到反应混合物种非靶序列DNA的影响,保证了LAMP扩增的高度特异性。
在检测过程中可以根据是否扩增就能判断目标基因是否存在,可用于细菌或病毒的定性检测。
1.2.1.2 等温高效L AMP在等温条件下扩增,不会因温度改变而造成时间的损失,在1h 内可将靶序列扩增至109~1010倍。
而且受非靶序列的影响小,模板也不需要热变性。
1.2.1.3 整个扩增反应操作简便、快捷LAMP反应过程中会产生白色的焦磷酸镁沉淀,肉眼即可直接观察,是鉴定反应是否进行的最直接方法。
另外,LAMP扩增产物可以像PCR 反应利用凝胶电泳结合成像系统进行鉴定,通过产生的不同梯型来区分特异性扩增和非特异性扩增。
1.2.1.4 实验装置简单,费用相对较低LAMP反应不需要进行模板的热变性、长时间的温度循环、繁琐的电泳和紫外观察等,在操作过程中,仅需要普通的水浴锅或其他可以得到稳定热源的设备即可。

LAMP技术原理和引物设计LAMP技术(Loop-mediated isothermal amplification),中文称为环介导等温扩增技术,是一种于2000年由Eiken Chemical Co. Ltd.日本公司开发的基于异十四链聚合酶反应(Bst聚合酶)的异源DNA快速扩增技术。
LAMP技术通过引物设计和反应条件的优化,实现在等温条件下对目标DNA的高效扩增。
下面将分别介绍LAMP技术的原理和引物设计。
LAMP技术的核心原理是通过酶的协同作用,在等温条件下进行DNA的扩增。
它利用一种特殊的DNA聚合酶(Bst聚合酶),能够在不需要高温退火的情况下,具有高度特异性和高效率地进行DNA合成。
LAMP技术本身具有极高的扩增速度,优势在于其在等温下,不需要复杂的设备和严格的实验条件,可以简化扩增过程。
同时采用特殊设计的引物组合,能够提高扩增特异性。
1.初始化反应:将反应体系中的DNA片段与引物(包括2个外端引物和2个补体引物)结合;2. 引物扩增:引物与Bst聚合酶作用,反应体系中的DNA得到扩增;3.聚合物合成:一种特殊的引物结合到目标DNA的5'末端,通过内端引物和内部位点进行扩增;4.循环放大:扩增产物作为新的模板参与反应,进行连续循环扩增。
通过这种等温扩增的方法,LAMP技术可以在短时间内获得大量的目标DNA,且具有很高的扩增特异性和灵敏度,可以用于分子生物学、诊断医学和病原检测等领域。
引物设计:引物设计是LAMP技术成功应用的重要因素之一、LAMP技术使用了4个单链引物,包括2个外端引物(forward outer primer,F3和reverse outer primer,B3)和2个内端引物(forward inner primer,FIP和reverse inner primer,BIP)。
外端引物负责扩增DNA的初始段,内端引物负责扩增DNA的中间段。
在引物设计中,需要注意以下几个方面:1.引物的特异性:要求引物能够有高度特异地结合到目标DNA的区域,确保扩增的目标是准确的;2.引物的长度和碱基组成:引物的长度通常为20-24个碱基,碱基组成要尽量避免重复序列和形成组内结构,以保证扩增效率和特异性;3.引物的位置和方向:合理选择引物的位置和方向,以确保扩增产物的特异性和有效性;4.引物的浓度:引物的浓度需要进行优化,以获得最佳的扩增效果。
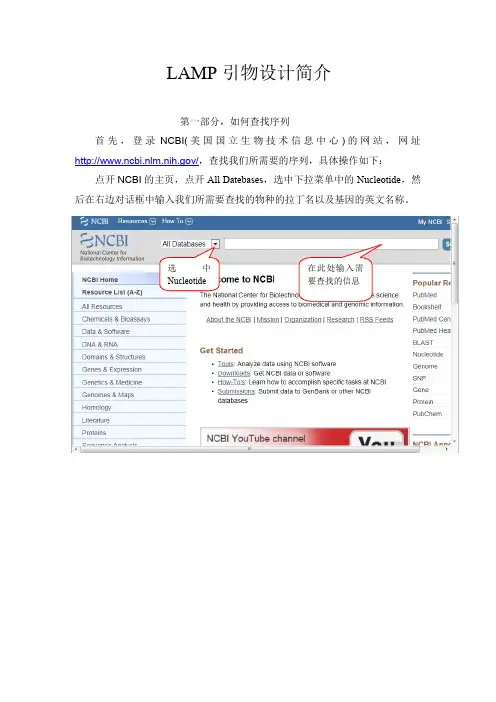
选中Nucleotide 在此处输入需要查找的信息LAMP引物设计简介第一部分,如何查找序列首先,登录NCBI(美国国立生物技术信息中心)的网站,网址/,查找我们所需要的序列,具体操作如下:点开NCBI的主页,点开All Datebases,选中下拉菜单中的Nucleotide,然后在右边对话框中输入我们所需要查找的物种的拉丁名以及基因的英文名称。
比如说我要查找大肠杆菌的16S rDNA的序列,那么只需要将大肠杆菌的拉丁名Escherichia coli以及16S rDNA输入即可,如下图所示,然后点击search。
如果NCBI的GenBank数据库有这些序列,那么我们就可以找到我们所需要的序列了。
当然,数据库中可能会出现很多相关的序列,这时我们需要自己慢慢查找自己需要的序列信息,如下图所示:接下来我们就浏览这些信息,然后将我们需要的信息复制下来,粘贴到TXT或者Word里。
这里我们示例选中的是第20条信息,当然你可以打开所有的你需要的信息。
如下图所示,我们可以得到基因的全部信息,包括来源、出自那片文献、核酸序列等等。
这样,我们的序列查找就完成了。
当然并不是所有物种的基因都可以在这里找到,在查不到的情况下,就需要我们自己通过PCR的方法将我们所需要的基因扩增出来,然后测序获得序列信息。
第二部分序列比对目前有一些分子生物学软件可以用于序列比对分析,像DNASTAR、ClustalW、MEGA等等,这里我们以MEGA5.0为例进行讲解。
首先,将目标序列和其它需要与其比对的序列放入一个文本文档中,以大肠杆菌的16S rDNA为例,格式如下图所示:打开MEGA5.0软件,点击Alignment的下拉菜单,选取Alignment的下拉菜单,选取Edit/Build Alignment,出现一个Alignment Editor的对话框,然后选择Creat a new alignment,点击OK。
出现下面的对话框,选择DNA软件就会出现下图的界面,单击Edit,选择下拉菜单中的Insert Sequence From File然后我们就把大肠杆菌的16S rDNA的序列及其他细菌的16S rDNA序列上传,出现下图的对话框,点击Alignment,选择下拉对话框的Align by ClustalW,对这个序列进行比对。

通过LAMP实现DNA的线性扩增一、LAMP 原理60-65℃是双链DNA复性及延伸的中间温度,DNA在65℃左右处于动态平衡状态。
因此,DNA在此温度下合成是可能的。
利用4种特异引物依靠一种高活性链置换DNA聚合酶。
使得链置换DNA合成在不停地自我循环。
扩增分两个阶段。
第1阶段为起始阶段,任何一个引物向双链DNA的互补部位进行碱基配对延伸时,另一条链就会解离,变成单链。
上游内部引物FIP的F2序列首先与模板F2c结合,在链置换型DNA聚合酶的作用下向前延伸启动链置换合成。
外部引物F3与模板F3c结合并延伸,置换出完整的FIP连接的互补单链。
FIP上的F1c与此单链上的Fl为互补结构。
自我碱基配对形成环状结构。
以此链为模板。
下游引物BIP与B3先后启动类似于FIP和F3的合成,形成哑铃状结构的单链。
迅速以3' 末端的Fl区段为起点。
以自身为模板,进行DNA合成延伸形成茎环状结构。
该结构是LAMP基因扩增循环的起始结构。
第2阶段是扩增循环阶段。
以茎环状结构为模板,FIP与茎环的F2c区结合。
开始链置换合成,解离出的单链核酸上也会形成环状结构。
迅速以3’末端的B1区段为起点,以自身为模板。
进行DNA合成延伸及链置换.形成长短不一的2条新茎环状结构的DNA,BIP引物上的B2与其杂交。
启动新一轮扩增。
且产物DNA长度增加一倍。
在反应体系中添加2条环状引物LF 和LB,它们也分别与茎环状结构结合启动链置换合成,周而复始。
扩增的最后产物是具有不同个数茎环结构、不同长度DNA的混合物。
且产物DNA为扩增靶序列的交替反向重复序列。
二、实验流程二、阶段实验及需要解决的问题(一) 实验准备阶段1、引物设计2、模板中引入合适的酶切位点3、不同梯度拷贝数模板的准备4、反应仪器的准备5、具有链置换活性的DNA聚合酶的选择6、扩增产物的检测方法7、扩增产物量的检测(二) 实验阶段1、反应体系的确定2、模板浓度的优化3、反应时间的优化4、扩增产物的检测5、以PCR的扩增作为对照三、具体实验方案(一) 引物的设计LAMP引物设计的在线网站(http://primerexplorer.jp/e/),只要导入靶基因就能自动生成成组引物。


lamp环介导等温扩增技术LAMP环介导等温扩增技术是一种用于检测DNA或RNA的方法,具有快速、高度敏感和特异性等优点。
下面我们来详细介绍一下这种技术的原理和应用。
一、原理LAMP技术是一种环介导等温扩增方法,与PCR不同的是,LAMP不需要高精度的温度控制和特异性引物,只需要4-6个引物就可扩增目标序列。
LAMP反应的基本步骤为:首先,在等温条件下,外部引物(F3和B3)和内部引物(FIP和BIP)结合在DNA目标序列上,形成一个环形结构;然后,在BIP的3'端内部引物(LF和LB)的作用下,DNA目标序列不断的进行扩增,最终形成一个由数以百万计的拷贝构成的扩增产物。
在反应中,LF和LB作为内部补体引物,增强了反应的特异性和扩增效率。
二、优点1、高度敏感:在LAMP扩增反应中,由于不需要复杂的环境条件和反应体系,扩增过程高效,形成的扩增产物数量极多,可以检测到非常微弱的目标DNA或RNA信号。
2、特异性强:LAMP反应需要多个引物结合于目标序列,而且引物是从多个区域的序列中选择设计的,所以扩增的产物只会与目标序列高度特异结合,不会出现交叉反应的问题。
3、环境友好:LAMP扩增只需要一个热水浴,不需要PCR反应所需的高精密温控仪器,同时反应体系中不含有有毒有害的物质,对环境及实验者均无危害。
三、应用LAMP技术已广泛应用于临床医学、食品安全、环境检测和生物技术等领域。
1、临床医学:LAMP技术可以高效、快速、准确地检测病原微生物、基因突变和药物耐药性等,对于疾病的快速诊断和精准治疗提供了有力支持。
2、食品安全:LAMP技术可以检测微生物、病毒和其他有害物质,对于食品安全监管起到了重要作用。
3、环境检测:LAMP技术可以应用于环境污染的检测、植物病害的检测以及水质检测。
4、生物技术:LAMP技术可以用于基因组学、遗传学和分子病理学等领域的基础科研。
总之,LAMP技术作为一种新兴的DNA或RNA检测技术,具有快速、高效、经济和特异性强等优点,已成为分子生物学和生命科学领域的焦点研究。

lamp引物设计原则
LAMP引物设计是快速测定体外或者体内某类特定微生物的基因序列和数量的方法。
它是通过构建重复序列检测(Loop-mediated isothermal amplification),利用特定的引物对特定序列进行适应温度条件的扩增,从而迅速反应特定的微生物的基因序列标志物。
因此LAMP引物的设计是一个关键。
LAMP引物设计的基本原则是确保布雷克体(Balaureate)的精确性和密度。
布雷克体必须精准地对应到所研究的目标物,并且每个布雷克体在聚合酶体系统中的比例必须保持一定的程度,以确保引物交联有效。
此外,布雷克体也必须满足其他标准,例如,GC含量高于50%,最大高于70%;碱基序列中引发扩增最大应当是锡调序列;布雷克体大小(20~25个碱基)适合于LAMP反应,以避免太多的自结构化;引物温度Tm应该在60~65℃,以提高其渗透反应活性;该引物的碱基序列中,最坏的拓扑结构必须被避免,如死角、完成二聚体、死角、活动簇等;引物内的自结合应当是最低的,关联酶的活性是自结合低活性的前提;引物不应含有重复序列;引物标准形式及义项要求;引物末端锌离子结合站。
要满足这些标准,需要在设计引物时确保设计规则严格有效。
一般来说,根据LAMP 引物设计要求,引物设计应具备以下几方面:一是确保布雷克体的表达,二是建立高GC 含量的布雷克体序列,三是对每个布雷克体碱基序列和拓扑结构进行优化,四是控制锡离子结合站站点的位置,五是控制Tm温度,以及在前后游离靶序列中确保高渗透性。
但是除此之外,专家还建议有步骤尽量增加探针的保守性,及减少重复序列,避免一次检测多种不相干的特征的可能性。

等温扩增原理等温扩增(LAMP)是一种用于DNA的体外扩增技术,由Eiken Chemical Co. Ltd.的Notomi等人于2000年首次报道。
相较于PCR技术,LAMP技术具有操作简便、成本低廉、扩增效率高等优点,因此在临床诊断、食品安全监测、环境微生物检测等领域得到了广泛的应用。
LAMP技术的原理基于异热核酸酶的作用,通过四种核酸酶的协同作用,在等温条件下扩增DNA。
下面将详细介绍LAMP技术的原理及其特点。
1. 引物设计。
LAMP技术使用6个引物,包括两对外向引物(F3和B3)、内向环引物(FIP 和BIP)以及两个外向环引物(LF和LB)。
这些引物能够在等温条件下特异性地识别目标DNA序列,并启动扩增反应。
2. 异热核酸酶的作用。
LAMP技术中使用的异热核酸酶具有多种酶活性,包括DNA依赖DNA聚合酶活性、融合酶活性和核酸内切酶活性。
这些酶的协同作用使得LAMP技术在等温条件下能够高效地扩增目标DNA。
3. 扩增过程。
在LAMP技术中,引物结合到目标DNA上,形成环状结构,然后通过异热核酸酶的作用,进行DNA聚合反应,最终产生大量的扩增产物。
这一过程在等温条件下进行,无需复杂的温度变化步骤,因此操作简便。
4. 特点及应用。
LAMP技术具有操作简便、扩增效率高、特异性强等特点,因此在临床诊断、食品安全监测、环境微生物检测等领域得到了广泛的应用。
同时,LAMP技术还可以用于快速检测病原微生物、农作物病害和害虫等,具有重要的应用前景。
综上所述,LAMP技术是一种操作简便、成本低廉、扩增效率高的DNA扩增技术,其原理基于异热核酸酶的作用,在等温条件下进行。
由于其独特的优势,LAMP技术在临床诊断、食品安全监测、环境微生物检测等领域有着广泛的应用前景。
随着技术的不断发展,LAMP技术将在更多领域展现出其重要的应用价值。
环介导等温扩增(LAMP)引物设计LAMP引物设计关键点:Tm值,引物末端稳定性,GC含量,二级结构,引物间距1.Tm值引物Tm值采用Nearest-Neighbor Method进行预测,该法所预测的值可能是最为接近真实情况。
通常情况下,Tm值会受实验条件所影响,例如盐浓度、寡核苷酸浓度等,因此需在实验条件下对Tm值进行预测。
●寡核苷酸0.1 μM;●Na+ 50 mM;●Mg2+ 4 mM;各个引物的最终Tm值需尽量满足以下条件:●F1c/B1c = 64-66 °C;●F2/B2、F3、B3 = 59-61 °C;●LoopF/LoopB = 64-66 °C;2.引物末端稳定性引物的末端是DNA复制的起点,因此需要一定的稳定性。
(通常情况下,引物需要一个稳定的5’端和一个相对不稳定的3’端,自由能绝对值越高,则形成的DNA双链越稳定,即越容易退火。
)●F2/B2,F3/B3,LoopF/LoopB的3’末端自由能≤-4 kcal/mol;●F1c/B1c的5’末端自由能≤-4 kcal/mol;此处的末端自由能指末端6个碱基的自由能。
3.GC含量引物的GC含量尽量在40-65%。
50-60%的GC含量可能会有更好效果。
4.二级结构需确保引物不会形成二级结构,例如二聚体,发卡结构。
5.引物间距●F2的5’末端到B2的5’末端约为120-160 bp;●F2的5’末端到F1c的5’末端约为40-60 bp;●F3的3’末端到F2的5’末端约为0-60 bp;1.上传序列打开PrimerExplorer V4网站:http://primerexplorer.jp/elamp4.0. 0/index.html上传所选的DNA特异序列(序列长度需小于2000 bp),参数选择Automatic Judgment,然后点击Primer Design。
系统自动对所上传的序列进行分析:●GC% ≤ 45%,则判定为AT Rich;●45% < GC% < 60%,则判定为正常;●GC% ≥ 60,则判定为GC Rich;不同情况对引物的要求不一。
lamp扩增原理LAMP扩增原理LAMP是一种用于DNA扩增的方法,它的全称是Loop-mediated isothermal amplification,即环介导等温扩增。
与PCR(聚合酶链式反应)相比,LAMP具有更高的扩增效率和更好的特异性,因为它只需要一个酶(Bst DNA polymerase)和四个特异性的引物来进行扩增。
本文将介绍LAMP的扩增原理及其基本步骤。
一、LAMP的扩增原理LAMP的扩增原理是通过“环式扩增”来实现的,其基本过程可以分为两个阶段:第一阶段是DNA的线性扩增,第二阶段是DNA的环式扩增。
LAMP的基本原理如下:1. 首先,一组称为F3和B3的特异引物与DNA靶标结合,形成一个F3/B3复合物。
该复合物在特定的温度下,通过Bst DNA polymerase的催化作用,进行线性扩增。
在该过程中,F3引物与B3引物结合的区域就会形成一个双链DNA结构,该结构具有一个单股环形DNA的结构,称为“DNA花环”。
2. 在第一阶段完成后,第二组引物(FIP和BIP)与F3/B3复合物结合,即形成FIP/F3/B3/BIP的四元复合物。
在特定的温度下,FIP 引物与BIP引物结合的区域就会形成一个新的DNA花环结构,这个花环嵌套在第一阶段的DNA花环中。
这个过程被称为“环式扩增”,在这个过程中,产生大量的DNA产物。
3. 在LAMP反应结束时,可以通过如凝胶电泳、荧光探针或颜色指示剂等多种方法来检测扩增产物。
二、LAMP的基本步骤LAMP的基本步骤包括:制备反应体系、扩增反应、检测扩增产物等。
1. 制备反应体系LAMP反应需要一个含有DNA靶标、Bst DNA polymerase、四组引物(F3、B3、FIP、BIP)和一些缓冲剂的反应体系。
反应体系的配制需要考虑到反应的温度、pH值等因素。
2. 扩增反应将反应体系加热到适当的温度,通常为60-65℃,进行扩增反应。
反应时间通常为1-2小时。
环介导等温扩增引物设计环介导等温扩增(Loop-mediated isothermal amplification,LAMP)是一种常用的核酸扩增技术,其最大的优势是可以不受限地在恒定温度下进行反应。
为了实现快速、准确、可靠的DNA扩增,合理的引物设计是至关重要的。
下面就环介导等温扩增引物的设计进行详细介绍:一、引物长度引物长度对扩增效率和特异性有很大影响。
通常建议引物长度在18-24bp之间,太短的引物会导致扩增效率低下,太长的引物则容易出现多个峰或非特异性扩增。
因此,在长度的选择上需要平衡扩增效率和特异性,一般来说,20bp左右的引物是比较适合的选择。
二、引物序列选择引物序列选择需要保证具有较低的自身互补性和互补性。
通常情况下,引物中应避免出现多个重复序列,避免引物间形成二级结构或者嵌套回路,可以通过NCBI的Primer BLAST或DNAMAN等软件进行序列比对,评估引物设计的准确性。
三、环结构设计与PCR引物不同,LAMP引物一般会在5’端和3’端添加的特殊序列(FIP和BIP)和环的序列。
它们是设计LAMP的关键部分,必须确保它们的特异性和互补性。
FIP和BIP序列需要匹配到目标序列上,而F1c和B1c环序列主要用于在反应过程中拉开靶DNA,为DST和DHT提供起始端。
四、引物浓度引物浓度对LAMP反应影响也很大,它的作用是影响LAMP反应的灵敏度和特异性。
在引物浓度过高时,会出现非特异性扩增和产生大量的非特异性产物;而在引物浓度过低时,则可能影响LAMP反应的灵敏度。
因此,在引物浓度的选择上也需要进行优化。
综上所述,环介导等温扩增引物设计是一项较为关键的技术,涉及到引物长度、序列选择、环结构设计和引物浓度等方面。
在实际操作中,需要根据样品特点和实验要求来进行引物设计。
同时,还需要结合实验优化引物浓度以及其他实验条件,以获得高灵敏度和高特异性的扩增结果。
研究生课程论文课程: 微生物检测技术题目LAMP技术及其在微生物检测中的应用姓名: 王飞学院: 生命科学学院专业: 微生物学号: 201121601620 11 年12 月30 日LAMP技术及其在微生物检测中的应用摘要:环介导等温扩增(1oop-mediated isothermal amplification,LAMP)技术是近年来发展出的一种敏感、特异、方便快捷的核酸扩增技术。
与传统PCR方法相比,LAMP不需要热循环,为等温扩增,且由于LAMP反应中产生大量的副产物一白色焦磷酸镁沉淀,扩增产物可不经过电泳,通过肉眼观察或浊度计即可判定结果。
因此LAMP是一种不需要热循环仪、肉眼即可判定结果的高度特异和敏感的DNA 扩增方法。
近年LAMP技术在病原微生物检测及食品微生物检测上已有广泛应用,本文就LAMP极其在这两方面的研究进展作一综述。
关键词:LAMP;环介导等温扩增;核酸扩增Application of LAMP in detection of microorganism Abstract:LAMP (loop-mediated isothermal amplification) method, which develops in recent years, is a sensitivity, special and convenience nucleic acid amplification technique. To compare with the traditional PCR, LAMP, which needn’t hot circle, is constant temperature amplification. Because LAMP can produce a mount of coproduce, magnesium pyrophosphate,which is a white precipitation,the result can be estimated by eyes or nephelometer without electrophoresis. In recent years, the application of LAMP in detection of disease pathogen and microorganism in food had been wide studied. These articles summarize the studies in these two aspects.Key words:LAMP; loop-mediated isothermal amplification; nucleic acid amplification 1.引言核酸体外扩增技术是分子生物学领域最重要的研究手段之一,以检测核酸为基础的分子诊断技术已广泛应用于临床医学和微生物检测等领域。
LAMP技术原理和引物设计LAMP引物的设计主要是针对靶基因的六个不同的区域,基于靶基因3'端的F3c、F2c和Flc区以及5'端的Bl、B2和B3区等6个不同的位点设计4种引物。
FIP(ForwardInnerPrimer):上游内部引物,由F2区和F1C区域组成,F2区与靶基因3’端的F2c区域互补,F1C区与靶基因5'端的Flc区域序列相同。
F3引物:上游外部引物(ForwardOuterPrimer),由F3区组成,并与靶基因的F3c区域互补。
BIP引物:下游内部引物(BackwardInnerPrimer),由B1C和B2区域组成,B2区与靶基因3'端的B2c区域互补,B1C域与靶基因5'端的Blc区域序列相同.B3引物:下游外部引物(BackwardOuterPrimer),由B3区域组成,和靶基因的B3c区域互补。
2.扩增原理60-65℃是双链DNA复性及延伸的中间温度,DNA在65℃左右处于动态平衡状态。
因此,DNA在此温度下合成是可能的。
利用4种特异引物依靠一种高活性链置换DNA聚合酶。
使得链置换DNA合成在不停地自我循环。
扩增分两个阶段。
第1阶段为起始阶段,任何一个引物向双链DNA的互补部位进行碱基配对延伸时,另一条链就会解离,变成单链。
上游内部引物FIP的F2序列首先与模板F2c结合(如图B所示),在链置换型DNA聚合酶的作用下向前延伸启动链置换合成。
外部引物F3与模板F3c结合并延伸,置换出完整的FIP连接的互补单链(如图C所示)。
FIP上的F1c与此单链上的Fl为互补结构。
自我碱基配对形成环状结构(如图C所示)。
以此链为模板。
下游引物BIP与B3先后启动类似于FIP和F3的合成,形成哑铃状结构的单链。
迅速以3'末端的Fl区段为起点。
以自身为模板,进行DNA合成延伸形成茎环状结构。
该结构是LAMP基因扩增循环的起始结构。
第2阶段是扩增循环阶段。
LAMP原理及引物设计与实例
.LAMP引物的设计
LAMP引物的设计主要是针对靶基因的六个不同的区域,基于靶基因3' 端的F3c、F2c和Flc区以及5' 端的Bl、B2和B3区等6个不同的位点设计4种引物。
FIP(Forward Inner Primer):上游内部引物,由F2区和F1C区域组成,F2区与靶基因3’端的F2c区域互补,F1C区与靶基因5' 端的Flc区域序列相同。
F3引物:上游外部引物(Forward Outer Primer),由F3区组成,并与靶基因的F3c区域互补。
BIP引物:下游内部引物(Backward Inner Primer ),由B1C和B2区域组成,B2区与靶基因3' 端的B2c区域互补,B1C域与靶基因5' 端的Blc区域序列相同.
B3引物:下游外部引物(Backward Outer Primer ),由B3区域组成,和靶基因的B3c区域互补。
2.扩增原理
60-65℃是双链DNA复性及延伸的中间温度,DNA在65℃左右处于动态平衡状态。
因此,DNA在此温度下合成是可能的。
利用4种特异引物依靠一种高活性链置换DNA聚合酶。
使得链置换DNA合成在不停地自我循环。
扩增分两个阶段。
第1阶段为起始阶段,任何一个引物向双链DNA的互补部位进行碱基配对延伸时,另一条链就会解离,变成单链。
上游内部引物FIP的F2序列首先与模板F2c结合(如图B所示),在链置换型DNA聚合酶的作用下向前延伸启动链置换合成。
外部引物F3与模板F3c结合并延伸,置换出完整的FIP连接的互补单链(如图C所示)。
FIP上的F1c与此单链上的Fl 为互补结构。
自我碱基配对形成环状结构(如图C所示)。
以此链为模板。
下游引物BIP与B3先后启动类似于FIP和F3的合成,形成哑铃状结构的单链。
迅速以3' 末端的Fl区段为起点。
以自身为模板,进行DNA合成延伸形成茎环状结构。
该结构是LAMP基因扩增循环的起始结构。
第2阶段是扩增循环阶段。
以茎环状结构为模板,FIP与茎环的F2c区结合。
开始链置换合成,解离出的单链核酸上也会形成环状结构。
迅速以3’末端的B1区段为起点,以自身为模板。
进行DNA合成延伸及链置换.形成长短不一的2条新茎环状结构的DNA,BIP引物上的B2与其杂交。
启动新一轮扩增。
且产物DNA长度增加一倍。
在反应体系中添加2条环状引物LF和LB,它们也分别与茎环状结构结合启动链置换合成,周而复始。
扩增的最后产物是具有不同个数茎环结构、不同长度DNA的混合物。
且产物DNA为扩增靶序列的交替反向重复序列。
MP的特点
LAMP与以往的核酸扩增方法相比具有如下优点:
(1)操作简单,LAMP核酸扩增是在等温条件下进行,对于中小医院只需要水浴锅即可,产
物检测用肉眼观察或浊度仪检测沉淀浊度即可判断。
对于RNA的扩增只需要在反应体系中加入逆转录酶就可同步进行(RT.LAMP),不需要特殊的试剂及仪器。
(2)快速高效,因为不需要预先的双链DNA热变性.避免了温度循环而造成的时间损失.核酸扩增在l h内均可完成,添加环状引物后时间可以节省1/2,多数情况在20。
30 rain均可检测到扩增产物。
且产物可以扩增至109倍,达0.5 mg/mL.应用专门的浊度仪可以达到实时定量检测。
(3)高特异性,由于是针对靶序列6个区域设计的4种特异性引物。
6个区域中任何区域与引物不匹配均不能进行核酸扩增。
故其特异性极高。
(4)高灵敏度,对于病毒扩增模板可达几个拷贝,比PCR高出数量级的差异。
缺点:由于LAMP扩增是链置换合成,靶序列长度最好在300 bp以内。
>500 bp则较难扩增。
故不能进行长链DNA的扩增。
由于灵敏度高。
极易受到污染而产生假阳性结果。
故要特别注意严谨操作,以及在产物的回收鉴定、克隆、单链分离方面均逊色于传统的PCR方法。
4.引物设计实例
LAMP引物设计的在线网站(http://primerexplorer.jp/e/),只要导入靶基因就能自动生成成组引物。
以某一微生物的鞭毛基因为例讲解一下LAMP相物设计的过程:
首先,单击浏览按钮选择靶基因序列文件,靶序列默认的是小于22 kbp。
支持三个类型的文件,普通文本格式(仅含序列)。
FASTA格式和GenBank 格式文件。
第二,从下面三个选项中选择定参数设定(引物设计条件)条件。
基于GC含量的自动判断, 起始的参数是特定的:如果GC含量小于或等于45%,则选取AT丰度高的区,如果GC含量高于60%,则选取GC丰度高的区,其它情况是标准设定状态。