LAMP引物设计说明书V3
- 格式:pdf
- 大小:1.95 MB
- 文档页数:23

LAMP原理及引物设计与实例.LAMP引物的设计LAMP引物的设计主要是针对靶基因的六个不同的区域,基于靶基因3' 端的F3c、F2c和Flc区以及5' 端的Bl、B2和B3区等6个不同的位点设计4种引物。
FIP(Forward Inner Primer):上游内部引物,由F2区和F1C区域组成,F2区与靶基因3’端的F2c区域互补,F1C区与靶基因5' 端的Flc区域序列相同。
F3引物:上游外部引物(Forward Outer Primer),由F3区组成,并与靶基因的F3c区域互补。
BIP引物:下游内部引物(Backward Inner Primer ),由B1C和B2区域组成,B2区与靶基因3' 端的B2c区域互补,B1C域与靶基因5' 端的Blc区域序列相同.B3引物:下游外部引物(Backward Outer Primer ),由B3区域组成,和靶基因的B3c区域互补。
2.扩增原理60-65℃是双链DNA复性及延伸的中间温度,DNA在65℃左右处于动态平衡状态。
因此,DNA在此温度下合成是可能的。
利用4种特异引物依靠一种高活性链置换DNA聚合酶。
使得链置换DNA合成在不停地自我循环。
扩增分两个阶段。
第1阶段为起始阶段,任何一个引物向双链DNA的互补部位进行碱基配对延伸时,另一条链就会解离,变成单链。
上游内部引物FIP的F2序列首先与模板F2c结合(如图B所示),在链置换型DNA聚合酶的作用下向前延伸启动链置换合成。
外部引物F3与模板F3c结合并延伸,置换出完整的FIP连接的互补单链(如图C所示)。
FIP上的F1c与此单链上的Fl 为互补结构。
自我碱基配对形成环状结构(如图C所示)。
以此链为模板。
下游引物BIP与B3先后启动类似于FIP和F3的合成,形成哑铃状结构的单链。
迅速以3' 末端的Fl区段为起点。
以自身为模板,进行DNA合成延伸形成茎环状结构。
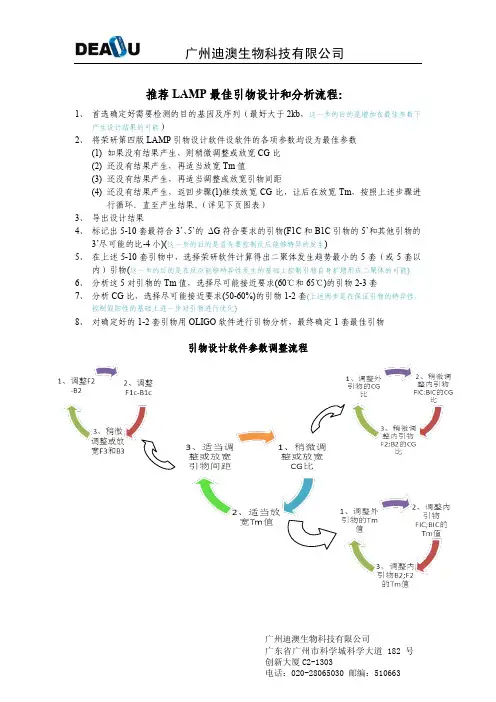
推荐LAMP最佳引物设计和分析流程:1、首选确定好需要检测的目的基因及序列(最好大于2kb,这一步的目的是增加在最佳参数下产生设计结果的可能)2、将荣研第四版LAMP引物设计软件设软件的各项参数均设为最佳参数(1)如果没有结果产生,则稍微调整或放宽CG比(2)还没有结果产生,再适当放宽Tm值(3)还没有结果产生,再适当调整或放宽引物间距(4)还没有结果产生,返回步骤(1)继续放宽CG比,让后在放宽Tm,按照上述步骤进行循环。
直至产生结果。
(详见下页图表)3、导出设计结果4、标记出5-10套最符合3’、5’的ΔG符合要求的引物(F1C和B1C引物的5’和其他引物的3’尽可能的比-4小)(这一步的目的是首先要控制反应能够特异的发生)5、在上述5-10套引物中,选择荣研软件计算得出二聚体发生趋势最小的5套(或5套以内)引物(这一步的目的是在反应能够特异性发生的基础上控制引物自身扩增形成二聚体的可能)6、分析这5对引物的Tm值,选择尽可能接近要求(60℃和65℃)的引物2-3套7、分析CG比,选择尽可能接近要求(50-60%)的引物1-2套(上述两步是在保证引物的特异性,控制假阳性的基础上进一步对引物进行优化)8、对确定好的1-2套引物用OLIGO软件进行引物分析,最终确定1套最佳引物引物设计软件参数调整流程6110第一套引物总体评价●从设计结果来看,引物3’和5’ ΔG是比较容易满足的●由于CG比例和目的序列有关,但可以通过输入较长的目的片段(>1Kb),而相对容易满足●该套引物的Tm值是根据PCR引物设计原则(不同引物之间Tm值最好能够接近)为标准从设计结果中选择的,所以和最佳Tm存在一定偏差,但是可以在设计结果选择中加以改善。
●引物二聚体和发夹结构是比较难避免的,需要通过引物设计软件primer 5和oligo进行两两匹配分析,由于需要针对3对,一共6条引物之间和引物本身进行错配分析,一套引物共需要进行21次分析,所以较为耗时,而且比较难以选择最佳结果。

LAMP技术原理和引物设计LAMP技术(Loop-mediated isothermal amplification),中文称为环介导等温扩增技术,是一种于2000年由Eiken Chemical Co. Ltd.日本公司开发的基于异十四链聚合酶反应(Bst聚合酶)的异源DNA快速扩增技术。
LAMP技术通过引物设计和反应条件的优化,实现在等温条件下对目标DNA的高效扩增。
下面将分别介绍LAMP技术的原理和引物设计。
LAMP技术的核心原理是通过酶的协同作用,在等温条件下进行DNA的扩增。
它利用一种特殊的DNA聚合酶(Bst聚合酶),能够在不需要高温退火的情况下,具有高度特异性和高效率地进行DNA合成。
LAMP技术本身具有极高的扩增速度,优势在于其在等温下,不需要复杂的设备和严格的实验条件,可以简化扩增过程。
同时采用特殊设计的引物组合,能够提高扩增特异性。
1.初始化反应:将反应体系中的DNA片段与引物(包括2个外端引物和2个补体引物)结合;2. 引物扩增:引物与Bst聚合酶作用,反应体系中的DNA得到扩增;3.聚合物合成:一种特殊的引物结合到目标DNA的5'末端,通过内端引物和内部位点进行扩增;4.循环放大:扩增产物作为新的模板参与反应,进行连续循环扩增。
通过这种等温扩增的方法,LAMP技术可以在短时间内获得大量的目标DNA,且具有很高的扩增特异性和灵敏度,可以用于分子生物学、诊断医学和病原检测等领域。
引物设计:引物设计是LAMP技术成功应用的重要因素之一、LAMP技术使用了4个单链引物,包括2个外端引物(forward outer primer,F3和reverse outer primer,B3)和2个内端引物(forward inner primer,FIP和reverse inner primer,BIP)。
外端引物负责扩增DNA的初始段,内端引物负责扩增DNA的中间段。
在引物设计中,需要注意以下几个方面:1.引物的特异性:要求引物能够有高度特异地结合到目标DNA的区域,确保扩增的目标是准确的;2.引物的长度和碱基组成:引物的长度通常为20-24个碱基,碱基组成要尽量避免重复序列和形成组内结构,以保证扩增效率和特异性;3.引物的位置和方向:合理选择引物的位置和方向,以确保扩增产物的特异性和有效性;4.引物的浓度:引物的浓度需要进行优化,以获得最佳的扩增效果。
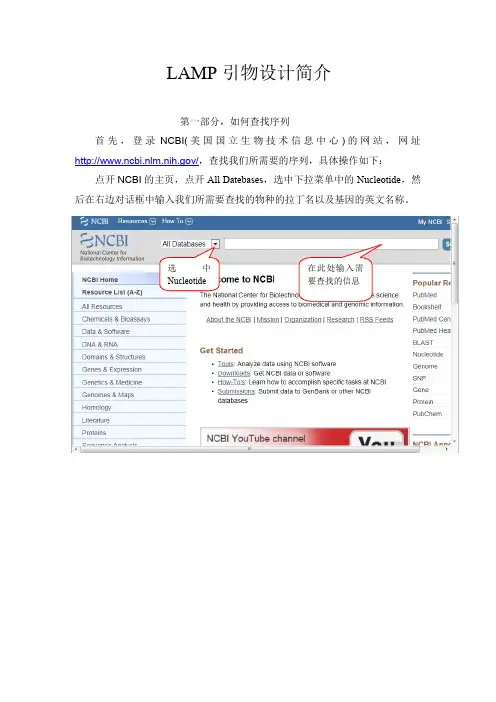
选中Nucleotide 在此处输入需要查找的信息LAMP引物设计简介第一部分,如何查找序列首先,登录NCBI(美国国立生物技术信息中心)的网站,网址/,查找我们所需要的序列,具体操作如下:点开NCBI的主页,点开All Datebases,选中下拉菜单中的Nucleotide,然后在右边对话框中输入我们所需要查找的物种的拉丁名以及基因的英文名称。
比如说我要查找大肠杆菌的16S rDNA的序列,那么只需要将大肠杆菌的拉丁名Escherichia coli以及16S rDNA输入即可,如下图所示,然后点击search。
如果NCBI的GenBank数据库有这些序列,那么我们就可以找到我们所需要的序列了。
当然,数据库中可能会出现很多相关的序列,这时我们需要自己慢慢查找自己需要的序列信息,如下图所示:接下来我们就浏览这些信息,然后将我们需要的信息复制下来,粘贴到TXT或者Word里。
这里我们示例选中的是第20条信息,当然你可以打开所有的你需要的信息。
如下图所示,我们可以得到基因的全部信息,包括来源、出自那片文献、核酸序列等等。
这样,我们的序列查找就完成了。
当然并不是所有物种的基因都可以在这里找到,在查不到的情况下,就需要我们自己通过PCR的方法将我们所需要的基因扩增出来,然后测序获得序列信息。
第二部分序列比对目前有一些分子生物学软件可以用于序列比对分析,像DNASTAR、ClustalW、MEGA等等,这里我们以MEGA5.0为例进行讲解。
首先,将目标序列和其它需要与其比对的序列放入一个文本文档中,以大肠杆菌的16S rDNA为例,格式如下图所示:打开MEGA5.0软件,点击Alignment的下拉菜单,选取Alignment的下拉菜单,选取Edit/Build Alignment,出现一个Alignment Editor的对话框,然后选择Creat a new alignment,点击OK。
出现下面的对话框,选择DNA软件就会出现下图的界面,单击Edit,选择下拉菜单中的Insert Sequence From File然后我们就把大肠杆菌的16S rDNA的序列及其他细菌的16S rDNA序列上传,出现下图的对话框,点击Alignment,选择下拉对话框的Align by ClustalW,对这个序列进行比对。


LAMP引物设计LAMP(Loop-mediated isothermal amplification)是一种在等温条件下进行的核酸扩增技术。
与传统的PCR技术相比,LAMP技术具有操作简单、扩增速度快、特异性高以及不依赖于PCR仪等优点。
在LAMP技术中,引物的选择尤为关键。
合适的引物序列能够提高LAMP扩增的效率和特异性。
1.目标序列选择:首先根据所需检测的目标基因或序列,选择合适的目标序列。
该目标序列应该是特异的,并且在相关物种中高度保守。
2.引物设计:通常,LAMP反应需要4个引物,包括两个外部引物(F3和B3)、两个内部引物(FIP和BIP)以及一个环引物(LF和LB)。
FIP和BIP引物包含了一个共享的反向互补序列,以及两个非共享的序列。
外部引物和内部引物必须与目标序列匹配,并且具有适当的长度和GC含量。
3.引物序列分析:选择合适的引物序列后,使用生物信息学工具对其进行分析。
对于引物序列,可以使用BLAST等工具进行同源性比对,以确保其特异性。
4.引物序列优化:如果在初步设计的引物序列中存在问题(如二聚体、自相互作用等),则需要针对这些问题进行优化。
这可能包括引物序列的长度调整、GC含量的调整或引物序列的重新设计。
5.引物合成:最后,设计好的引物序列需要通过化学合成进行合成。
在合成过程中,引物的纯度和质量也需要进行检查,以确保引物的稳定性和有效性。
LAMP引物设计的关键是选择合适的引物序列。
合适的引物序列应该与目标序列完全匹配,并且能够提供高效的扩增,同时对非目标序列具有良好的特异性。
此外,引物序列的长度和GC含量也是重要的考虑因素。
过长或过短的引物序列可能导致扩增效率低下,而过高或过低的GC含量可能影响引物的稳定性和特异性。
总结起来,LAMP引物设计是一个复杂的过程,需要综合考虑引物序列的特异性、长度、GC含量等因素。
通过合理设计和优化,可以选择出高效、特异和敏感的引物序列,实现准确的荧光定量PCR检测。

环介导等温扩增(LAMP)引物设计LAMP引物设计关键点:Tm值,引物末端稳定性,GC含量,二级结构,引物间距1.Tm值引物Tm值采用Nearest-Neighbor Method进行预测,该法所预测的值可能是最为接近真实情况。
通常情况下,Tm值会受实验条件所影响,例如盐浓度、寡核苷酸浓度等,因此需在实验条件下对Tm值进行预测。
●寡核苷酸0.1 μM;●Na+ 50 mM;●Mg2+ 4 mM;各个引物的最终Tm值需尽量满足以下条件:●F1c/B1c = 64-66 °C;●F2/B2、F3、B3 = 59-61 °C;●LoopF/LoopB = 64-66 °C;2.引物末端稳定性引物的末端是DNA复制的起点,因此需要一定的稳定性。
(通常情况下,引物需要一个稳定的5’端和一个相对不稳定的3’端,自由能绝对值越高,则形成的DNA双链越稳定,即越容易退火。
)●F2/B2,F3/B3,LoopF/LoopB的3’末端自由能≤-4 kcal/mol;●F1c/B1c的5’末端自由能≤-4 kcal/mol;此处的末端自由能指末端6个碱基的自由能。
3.GC含量引物的GC含量尽量在40-65%。
50-60%的GC含量可能会有更好效果。
4.二级结构需确保引物不会形成二级结构,例如二聚体,发卡结构。
5.引物间距●F2的5’末端到B2的5’末端约为120-160 bp;●F2的5’末端到F1c的5’末端约为40-60 bp;●F3的3’末端到F2的5’末端约为0-60 bp;1.上传序列打开PrimerExplorer V4网站:http://primerexplorer.jp/elamp4.0. 0/index.html上传所选的DNA特异序列(序列长度需小于2000 bp),参数选择Automatic Judgment,然后点击Primer Design。
系统自动对所上传的序列进行分析:●GC% ≤ 45%,则判定为AT Rich;●45% < GC% < 60%,则判定为正常;●GC% ≥ 60,则判定为GC Rich;不同情况对引物的要求不一。