去泛素化
- 格式:doc
- 大小:47.50 KB
- 文档页数:2

去泛素化在NF-κB信号通路调节中的作用Edward W Harhaj1, Vishva M Dixit21Department of Microbiology and Immunology, Sylvester Comprehensive Cancer Center, The University of Miami, Miller School of Medicine, 1550 NW 10 Avenue, Miami, FL 33136, USA; 2Department of Physiological Chemistry, Genentech Inc., 1 DNA Way,South San Francisco, CA 94080, USA核因子kappa B(NF-κB)是一种非常关键的调控因子,参与多种生物功能,包括先天和适应性的免疫以及细胞的生存等。
NF-κB的激活严格受到一种慢性信号的调节,这一信号会导致持续性的炎症以及癌症。
由关键信号分子E3连接酶介导的泛素化途径对NF-κB信号通路具有重要的调控作用。
去泛素化(DUBs)可抵抗E3连接酶,因此在下调NF-κB信号通路以及维持稳态时,其有重要的作用。
通过特异的去泛素化,如A20和CYLD,可以了解NF-κB信号通路的下调途径,进而为慢性疾病以及癌症提供治疗的可能。
核因子kappa B(NF-κB)/Rel代表了一种真核转录因子家族,这一家族是基因的主要调控因子,可以控制先天和适应性的免疫反应。
NF-κ B 家族的蛋白都含有约300个氨基酸组成的RHD 结构域,这一结构域包括DNA结合区、核定位区以及二聚化区。
NF-κ B 家族成员可以形成同源或异源的二聚体,包括p65/RelA, c-Rel, RelB, p105/p50 以及p100/p52。
在细胞质中,NF-κB被抑制蛋白或IκBs抑制,所以呈现非活性状态,这些抑制蛋白可以阻止NF-κB的核定位以及与DNA的结合。
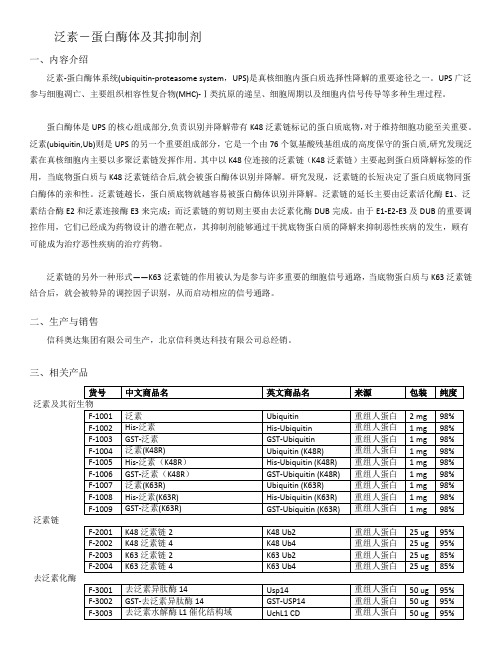
泛素-蛋白酶体及其抑制剂一、内容介绍泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是真核细胞内蛋白质选择性降解的重要途径之一。
UPS广泛参与细胞凋亡、主要组织相容性复合物(MHC)-Ⅰ类抗原的递呈、细胞周期以及细胞内信号传导等多种生理过程。
蛋白酶体是UPS的核心组成部分,负责识别并降解带有K48泛素链标记的蛋白质底物,对于维持细胞功能至关重要。
泛素(ubiquitin,Ub)则是UPS的另一个重要组成部分,它是一个由76个氨基酸残基组成的高度保守的蛋白质,研究发现泛素在真核细胞内主要以多聚泛素链发挥作用。
其中以K48位连接的泛素链(K48泛素链)主要起到蛋白质降解标签的作用,当底物蛋白质与K48泛素链结合后,就会被蛋白酶体识别并降解。
研究发现,泛素链的长短决定了蛋白质底物同蛋白酶体的亲和性。
泛素链越长,蛋白质底物就越容易被蛋白酶体识别并降解。
泛素链的延长主要由泛素活化酶E1、泛素结合酶E2和泛素连接酶E3来完成;而泛素链的剪切则主要由去泛素化酶DUB完成。
由于E1-E2-E3及DUB的重要调控作用,它们已经成为药物设计的潜在靶点,其抑制剂能够通过干扰底物蛋白质的降解来抑制恶性疾病的发生,顾有可能成为治疗恶性疾病的治疗药物。
泛素链的另外一种形式——K63泛素链的作用被认为是参与许多重要的细胞信号通路,当底物蛋白质与K63泛素链结合后,就会被特异的调控因子识别,从而启动相应的信号通路。
泛素链去泛素化酶泛素链接酶1、产品质量有保障——产品均由专家研发生产,均可提供试用装2、性价比高——价格比国外同样的产品便宜30%左右,关税、国际运费等均省了3、订货周期短——备有大量现货4、技术健全——泛素相关产品齐全,技术成熟5、相信自己——中国自己的产品跟国外的一样好。


去泛素化酶USP19通过对Beclin-1去泛素化调控细胞自噬和抗病毒反应细胞自噬是真核细胞内一套高度保守的降解系统,它能够清除毒害性质的蛋白堆积物、衰老的线粒体以及侵染机体的病原微生物。
根据其类型,自噬可以划分为巨自噬、微自噬和分子伴侣介导的自噬三种形式。
巨自噬,也就是常规意义上的自噬,它会形成双层膜结构包裹底物的自噬体,随后自噬体与溶酶体进行融合,在溶酶体中酸性水解酶的作用下将底物降解。
在哺乳动物细胞中,一系列与酵母同源的自噬相关蛋白(ATG)组装成自噬复合体精细操控自噬的过程。
自噬在细胞和生理水平的生物学过程中都发挥至关重要的作用,此外,自噬相关蛋白不但在自噬过程中起作用,而且还参与免疫反应的调节,例如:炎症、抗病毒反应、抗原加工和抗原递呈。
自噬的主要激活剂能够抑制m TOR(mammalian target of rapamycin)信号从而启动自噬。
m TOR信号通路中的关键受体m TORC1复合体抑制ULK1、ATG13、ATG101和FIP200组成的ULK1复合体的活性;而诱导细胞自噬的各种信号能够通过抑制m TORC1的活性,从而激活ULK1复合体,造成自噬的启动,进一步激活下游的Beclin-1复合体。
Beclin-1复合体由Beclin-1、VPS34、VPS15以及ATG14L组成。
Beclin-1复合体的活化导致VPS34催化产生磷脂酰肌醇3磷酸,后者对于自噬体的膜的成核是必需的。
除此之外,在葡萄糖缺失的饥饿条件下,AMPK可以直接磷酸化Beclin-1从而激活VPS34。
Beclin-1是激活VPS34活性进而引发自噬过程的信号中心。
基于Beclin-1在细胞自噬中的核心地位,研究Beclin-1的翻译后水平的调控显得尤为重要。
以往对Beclin-1的研究都集中在磷酸化修饰,对于Beclin-1的泛素化修饰,我们目前还知之甚少。
泛素(ubiquitin)是具有76个氨基酸的高度保守序列的多肽,它们主要在一系列泛素连接酶(E1,E2和E3)的作用下,通过一个或者多个赖氨酸残基连接到蛋白上,从而形成泛素链。


去泛素化酶与肿瘤唐时珺;陈松;叶茂【摘要】去泛素化是指由去泛素化酶介导的一种蛋白质泛素化的负向调节过程.迄今为止已确定的去泛素化酶有99种,根据其序列和结构的相似性可以分为6大家族,大部分属于半胱氨酸蛋白酶.去泛素化酶的活性直接影响细胞内多种蛋白的周转率、活性、再生以及定位.因此,去泛素化酶对细胞内环境自稳态的维持、蛋白的稳定或降解以及细胞内的信号转导通路起着极其重要的作用.研究表明,去泛素化酶的功能异常与包括肿瘤在内的多种疾病的发生密切相关,以其作为分子靶标,筛选新药物抑制肿瘤的生长已成为抗肿瘤药物开发的热点.【期刊名称】《激光生物学报》【年(卷),期】2014(023)004【总页数】7页(P294-300)【关键词】去泛素化;去泛素化酶;肿瘤【作者】唐时珺;陈松;叶茂【作者单位】湖南大学生物学院分子科学与分子医学实验室,湖南长沙410082;湖南师范大学生命科学学院,湖南长沙410006;湖南大学生物学院分子科学与分子医学实验室,湖南长沙410082【正文语种】中文【中图分类】Q71泛素是由76个氨基酸组成的球形热稳定蛋白。
在真核细胞中,泛素的结构高度保守,蛋白质接受一些信号(如磷酸化、氧化、错误折叠、损伤等)能引发其泛素-蛋白酶体降解途径。
泛素-蛋白酶体降解途径是指靶蛋白通过一系列的酶促反应被泛素链标记进而在蛋白酶体中降解,而泛素分子则可以被释放出来重复利用的过程。
酶促反应包括三步:泛素激活酶E1激活游离的泛素分子并形成E1-泛素复合物;泛素结合酶E2催化E1-泛素复合物形成高能磷酸键相连的E2-泛素复合物;泛素连接酶E3识别靶蛋白并将泛素链连接到靶蛋白上,真核生物中还存在一些E2(如RAD6/UBC2等),不需要E3的参与就能直接识别靶蛋白并标记上泛素链[1]。
近来研究表明,泛素化是一个可逆的过程,去泛素化酶能够水解泛素羧基末端的异肽键,将泛素分子特异性地从底物蛋白或者前体蛋白上水解下来,逆转泛素化过程。
蛋白质泛素化、去泛素化与肿瘤发生的关系【关键词】泛素化泛素-蛋白酶体途径去泛素化去泛素化酶肿瘤泛素蛋白水解酶体途径(Ubiquitin proteasome pathway, UPP)是细胞质和核内蛋白ATP 依托性的非溶酶体降解途径,高效并高度选择性地进行细胞内蛋白转换,还参与某些重要蛋白质的编译后修饰和改造。
因此,对维持细胞正常生理功能具有十分重要的意义。
但随着对UPP研究的深切,发觉蛋白泛素化调剂是一个可逆的进程。
细胞内同时还存在一些特异的去泛素化蛋白酶进行负向调剂[1]。
1 泛素及其功能泛素是由76个氨基酸组成的球形热稳固蛋白,其结构在真核细胞中高度保守,在不同生物体间组成泛素的氨基酸序列不同很小。
泛素是通过一系列泛素启动酶的作用而与靶蛋白连接的。
泛素-蛋白酶体系统的组成(1)泛素:分子量约,普遍存在于真核细胞。
泛素链与蛋白底物的结合形成被蛋白酶体降解的识别信号。
(2)泛素活化酶E1:通过半胱氨酸残基与泛素C端活化的甘氨酸残基形成硫酯键。
(3)泛素转移酶E2:以泛素结合酶方式起作用,活性部位为半胱氨酸。
(4)泛素连接酶E3:识别被降解的蛋白并将泛素连接到底物上。
(5)26S蛋白酶体():蛋白酶体定位于胞核和胞质内。
26S蛋白酶体是由2个环状的19S亚单位和1个20S微粒体状的亚单位组成[2]。
蛋白酶体被以为是细胞内的再生与回收中心,泛素化的靶蛋白在此被分解为短肽和氨基酸,而泛素被回收再利用。
泛素-蛋白酶体降解途径第一时期为泛素与蛋白底物的彼此作用:(1)高能硫酯键E1泛素复合物的形成。
在ATP参与下,游离的泛素被E1激活,即E1的半胱氨酸残基与泛素的C结尾甘氨酸残基形成高能硫酯键。
(2)活化泛素(E1泛素复合物)转移到E2上,释放出E1,形成高能键E2泛素复合物。
(3)底物(被磷酸化、氧化、错误折叠或与辅助蛋白结合的蛋白质)被E3识别并与之结合。
(4)E2泛素复合物上的泛素转移到E3上,形成高能键复合物。
[分享]讲座教授朱健康《Nature》文章解析表观遗传学[复制链接]
bbioo
Administrator
积分
17006
秀蛋白
3487 个
秀基因
7845 个
帖子
367
楼主
发表于 2009-8-26 08:21 |只看该作者|倒序浏览
|打印
摘要:来自美国加州大学河滨分校植物科学系,植物分子生
物学中心,普渡大学园艺及园林系的研究人员发现了组蛋白
H2B去泛素化(deubiquitination)在表观遗传DNA甲基化和
异染色质沉默方面的调控作用,在DNA甲基化修饰与泛素化之
间建立了新联系,也为DNA甲基化修饰研究提出了新观点,这
一研究成果公布在6月7日《Nature》上。
生物通报道:来自美国加州大学河滨分校植物科学系,植物分
子生物学中心,普渡大学园艺及园林系的研究人员发现了组蛋
白H2B去泛素化(deubiquitination)在表观遗传DNA甲基化
和异染色质沉默方面的调控作用,在DNA甲基化修饰与泛素化
之间建立了新联系,也为DNA甲基化修饰研究提出了新观点,
这一研究成果公布在6月7日《Nature》上。
这一文章的通讯作者是加州大学河滨分校的朱健康教授,其早
年毕业于中国农业大学,现任加州大学河滨分校教授,整合基
因研究所所长,2005年被聘为中国农业大学长江学者讲座教
授。
原文检索:
Nature 447, 735-738 (7 June 2007) |
doi:10.1038/nature05864; Received 23 February 2007;
Accepted 24 April 2007
Control of DNA methylation and heterochromatic silencing
by histone H2B deubiquitination
[Abstract]
在基因组中除了DNA和RNA序列以外,还有许多调控基因的信
息,它们虽然本身不改变基因的序列,但是可以通过基因修饰,
蛋白质与蛋白质、DNA和其它分子的相互作用,而影响和调节
遗传的基因的功能和特性,并且通过细胞分裂和增殖周期影响
遗传,这就是表观遗传学(epigenetics)。
在表观遗传学研究中,小分子RNAs(Short interfering RNAs,
siRNAs)可以引导DNA甲基化,以及异染色质组蛋白修饰,导
致序列特异性转录基因沉默。
目前已知动物和酵母组蛋白H2B
能单泛素化(monoubiquitinate),这能调控H3组蛋白的甲
一领域的一个未解之谜。
在这篇文章中,研究人员发现一种拟南芥去泛素化酶
(deubiquitination enzyme)的突变:SUP32/UBP26能减少
组蛋白H3赖氨酸9的去甲基化,抑制siRNA指导的DNA甲基
化,以及转基因和转座子的异染色质沉默。
同时研究人员也发现拟南芥组蛋白H2B在赖氨酸143位可以发
生单泛素化,并且在sup32突变株中,H2B泛素化及H3赖氨
酸4的三甲基化的水平也增加了。
这些都说明SUP32/UBP26引
起的H2B去泛素化是异染色质组蛋白H3甲基化和DNA甲基化
的一种必要元素。
(生物通:张迪)
附:
朱健康教授
1987年毕业于中国农业大学土化系
1990年取得加州大学河畔分校植物学硕士学位
1993年获得普渡大学植物生理学博士学位
1993--1996朱健康随后任教于纽约市洛克斐勒大学与阿拉
巴马州奥本大学,教授植物生物学
1996年转赴亚利桑那大学吐桑分校任教,2000年成为该校植
物学系教授
现任美国加州大学河滨分校教授,整合基因研究所所长,兼任
国际著名学术刊物《Plant Physiology》、《Plant Molecular
Biology》副主编。
朱健康教授为植物抗逆分子生物学领域世界级领军人物之一,
其及其领导的实验室在植物抗旱、耐盐与耐低温方面的研究硕
果累累,在国内外享有声誉,他的实验室已在《Cell》、
《Science》、《Gene&Development》、《Plant Cell》、PNAS
等国际著名学术刊物发表论文40余篇。