(完整版)蛋白质泛素化研究进展—探索蛋白修饰的秘密
- 格式:doc
- 大小:920.01 KB
- 文档页数:57
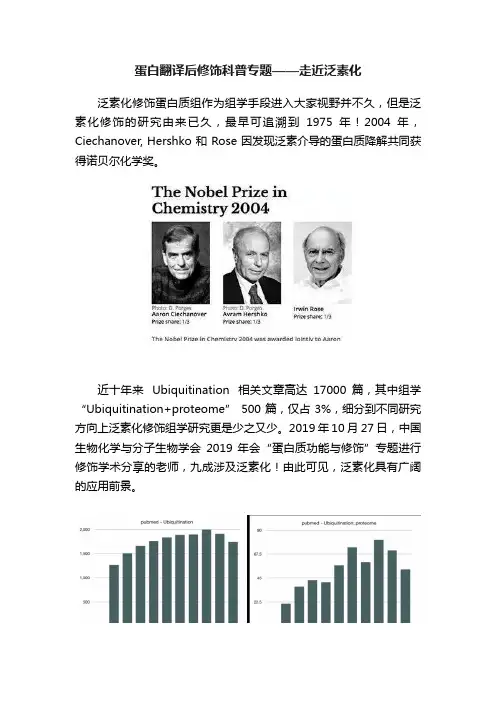
蛋白翻译后修饰科普专题——走近泛素化泛素化修饰蛋白质组作为组学手段进入大家视野并不久,但是泛素化修饰的研究由来已久,最早可追溯到1975年!2004年,Ciechanover, Hershko 和 Rose 因发现泛素介导的蛋白质降解共同获得诺贝尔化学奖。
近十年来Ubiquitination 相关文章高达17000篇,其中组学“Ubiquitination+proteome”500篇,仅占3%,细分到不同研究方向上泛素化修饰组学研究更是少之又少。
2019年10月27日,中国生物化学与分子生物学会2019 年会“蛋白质功能与修饰”专题进行修饰学术分享的老师,九成涉及泛素化!由此可见,泛素化具有广阔的应用前景。
本文,小编抛砖引玉简要总结一下泛素化修饰。
内容分为五个模块:1. 泛素化修饰简述2. 泛素及泛素连接方式3. 泛素酶及泛素化修饰过程4. 质谱鉴定泛素化修饰蛋白的原理5. 泛素化修饰的生物学功能1泛素化修饰简述一个或多个泛素分子在一系列酶的作用下与底物蛋白质分子共价结合的翻译后修饰过程称为泛素化修饰(Ubiquitination/Ubiquitylation)。
泛素化修饰在细胞生命周期各个方面,通过对蛋白质稳定性、定位、活性以及相互作用的调控,广泛参与了诸如转录调节、DNA 损伤修复、细胞周期、细胞凋亡、囊泡运输等生理过程。
2泛素及泛素连接方式泛素(ubiquitin, Ub)是一种由76个氨基酸组成的小分子蛋白质,高度保守,全长包含7个赖氨酸位点(K6, K11, K27, K29, K33, K48和K63)和1个位于C 端的甘氨酸(Gly)位点以及位于N 端的甲硫氨酸(Met)位点。
泛素化修饰分类及泛素连接方式:1)如果靶蛋白结合单个泛素分子,则称为单泛素化;2)如果靶蛋白的多个 Lys 残基同时被单个泛素分子标记称为多泛素化;3)而靶蛋白的单个 Lys 残基被多个泛素分子标记则称为多聚泛素化。

3分钟带您了解蛋白泛素化修饰人体细胞内蛋白质降解主要有两条途径:一种是在溶酶体内(一种具有“消化降解”功能的细胞器)通过ATP(体内直接供能分子)非依赖途径被降解,此途径主要降解外来的蛋白质,对蛋白质的选择性较差。
另一种是在蛋白酶体内,通过ATP依赖途径(需耗能),经过泛素化修饰后被降解。
此途径主要降解细胞内结构异常的蛋白质和短寿的蛋白质。
如果我告诉你真核生物80%~90%蛋白质的降解是由泛素-蛋白酶体降解途径(ubiquitin-pro-teasomepathway, UPP)介导的,而此途径是泛素化修饰蛋白最主要的去向,你是不是很好奇泛素化修饰到底是何方神圣?那小编就言简意赅、简明扼要的给大家介绍一下蛋白泛素化修饰。
泛素(Ub, ubiquitin)是一种普遍存在于真核细胞中的由76氨基酸残基组成的多肽。
一个或多个泛素分子能够在一系列酶的作用下共价连接至蛋白质底物上,形成泛素化修饰(ubiquitination)。
调控蛋白表达水平的重要机制,参与了几乎所有生命过程,是一种至关重要的翻译后修饰。
01在ATP供给能量的情况下,泛素激活酶E1将泛素分子活化。
02泛素激活酶E1将活化的泛素分子传递给泛素结合酶E2。
03泛素连接酶E3将结合E2的泛素连接到靶蛋白上。
图1. 泛素化修饰过程[1]泛素-蛋白酶体途径(UPP)20S催化核心与19S调节复合物结合形成26S蛋白酶体结构。
泛素标记的蛋白质与19S复合物结合,并在蛋白水解β亚基处降解。
19S亚单位与多泛素链结合,ATP展开蛋白质底物并将其转移到20S核心颗粒中。
蛋白质通过20S 中心,在那里被降解成25个氨基酸以下的小寡肽。
介导泛素非依赖性蛋白质降解。
图2. 蛋白酶体结构与蛋白质降解[1]泛素化修饰类型在泛素链中,泛素部分可通过其赖氨酸(Lys11、Lys27、Lys6、Lys29、Lys33、Lys63和Lys48)或N端蛋氨酸残基(Met1)结合。

蛋白泛素化修饰及其生物学作用研究生物体内的蛋白质是细胞内最重要的功能分子之一。
其修饰可以调节生物体的许多生理过程,并与许多疾病息息相关。
蛋白泛素化作为一种普遍的蛋白质后修饰,已经引起了人们的广泛关注。
本文将介绍蛋白泛素化修饰及其生物学作用研究的现状。
一、蛋白泛素化修饰的概述蛋白泛素化修饰是一种广泛存在于生物体内的蛋白质后修饰。
它是由泛素家族的蛋白质附加到目标蛋白质上的一系列过程。
泛素本身是一个小分子蛋白质,由76个氨基酸组成,主要通过连接肽链的方式与目标蛋白质结合。
泛素连接蛋白酶是一个非常重要的酶,可以催化这一过程。
目前已知的泛素家族成员有数百个,它们可以与目标蛋白质特定结合。
蛋白泛素化修饰最初被认为是一种可以调节蛋白质降解的过程。
这种修饰可以标记蛋白质,让其被连接蛋白酶降解。
然而,随着对泛素家族成员的研究不断深入,人们发现蛋白泛素化修饰还可以调节生物体许多其他生理过程。
二、蛋白泛素化修饰的生物学作用1. 调节蛋白质降解蛋白泛素化修饰最常见的生物学作用之一是调节蛋白质降解。
目标蛋白质被泛素家族成员连接后,将被连接蛋白酶水解降解。
这种机制对细胞内的蛋白质质量控制至关重要。
2. 调节细胞信号转导泛素家族成员可以与一些信号分子结合,并调节其活性。
例如,泛素连接蛋白酶可以调节IκBα的降解,从而调节NF-κB信号通路。
此外,许多激酶和转录因子也受到蛋白泛素化修饰的调节。
3. 调节基因表达蛋白泛素化修饰还可以调节细胞核内的基因表达。
例如,泛素连接蛋白酶可以去泛素化转录因子。
另外,一些转录因子本身也可以被泛素连接。
4. 调节细胞周期和凋亡蛋白泛素化修饰还可以调节细胞周期和凋亡。
例如,有证据表明,泛素连接蛋白酶可以调节p53的活性,从而影响细胞的凋亡。
三、蛋白泛素化修饰的研究方法目前,研究人员已经发展出了多种方法来研究蛋白泛素化修饰。
其中最常见的方法是免疫印迹分析。
这种方法可以检测蛋白质是否被连接泛素,并确定泛素连接在哪些位点上。

泛素化内稳态及信号一:背景1.细胞内蛋白酶解:80%-90%通过蛋白酶体降解,10%-20%通过自噬。
2.泛素:由70个左右的氨基酸组成,本身有7个赖氨酸可被泛素化。
细胞内广泛存在的一种蛋白。
占细胞总蛋白1-2%,真核生物中高度保守。
泛素内稳态取决于不断的改变。
泛素化和去泛素化是一个动态平衡过程。
3.细胞内泛素化-蛋白酶体系统(U P S)(1)E3连接酶亚家族:E3连接酶的功能影响细胞每个方面的活性,它的改变可以导致疾病。
(2)E3连接酶(大约600种)可以作为o n c o g e n e或者t u m o r s u p p r e s s o r(3)泛素信号:分类及功能功能:细胞凋亡、D N A转录和修复、分化和生长、免疫应答和炎症,细胞表面受体和离子通道,血管新生,核糖体生物合成等等泛素信号异常:肿瘤、病毒感染、神经退行性疾病、发育畸形、细菌感染等。
蛋白质降解受到抑制后,正常细胞会出现生长抑制,而肿瘤细胞则出现凋亡。
二、泛素内稳态及应激1.细胞内泛素内稳态(老师上课说过这是可能的考点)泛素内稳态:泛素合成聚泛素链形成聚泛素链组装泛素降解泛素应激:泛素增加、泛素减少泛素减少:损害减数分裂、组织生长缺陷、突触发育及功能、胎儿肝脏发育细胞周期及耐逆性、增殖缺陷、扰乱造血系统、神经退化和代谢紊乱、细胞分化异常泛素增加:延迟衰老、改变基因表达、热击的应答方式、促进细胞增殖和应激耐受、改变蛋白酶体构成、激活自噬三、泛素信号和主要信号通路1、N-e n d r u l e通路泛素化蛋白酶体系统中最简单的规则:及蛋白质N端的特点决定蛋白质的半衰期,若N端为精氨酸或者赖氨酸的蛋白质寿命就很短。
最早期试验:牛血清白蛋白(B S A)N端为天冬氨酸,可以被A T E1(精氨酸t-R N A转移酶1)催化在N端加上精氨酸,进而被E3连接酶识别发生降解。
后来发现:机制是蛋白质N端带上谷氨酸和天冬氨酸可以在A T E1作用下被精氨酸化。

科研新视⾓,蛋⽩翻译后修饰(PTM)之泛素化欲知蛋⽩泛素化的秘密,且听⽼谈娓娓道来。
蛋⽩作为⽣命功能的主要的执⾏物质,其功能研究⼀直备受青睐。
⽽蛋⽩之所以神通⼴⼤,翻译后修饰(post-translational modification,PTM)居功⾄伟。
这是因为蛋⽩的个别氨基酸残基被共价修饰后,其理化性质、构象等也随之改变,可显著影响蛋⽩的功能。
⽬前已知的PTM多达数百种,⽽⼏乎所有的蛋⽩质均可发⽣PTM,且同⼀个蛋⽩质还可同时具有多种PTM,如此不仅能指数级地扩增了蛋⽩质的种类,更是赋予了⼈类⽣命过程更多的复杂性。
PTM作为⼀种⽣物功能的调控机制,其重要性不亚于转录和蛋⽩表达调控,因⽽近年来关于翻译后修饰的研究也逐渐呈现出井喷之势。
⽬前针对PTM功能的认识,主要集中在磷酸化、泛素化、⼄酰化、糖基化等少数常规性修饰,⽽《⼆⼗四型》课程也将针对PTM开设⼀系列课程进⾏细致的讲解,本期课程则主要聚焦于蛋⽩泛素化。
1、泛素化的关键组分⼀般蛋⽩泛素化后,会被泛素-蛋⽩酶体系统(UPS)识别并降解,是下调蛋⽩表达的主要机制。
在UPS系统中,泛素是⼀个普遍存在于真核细胞内的由76个氨基酸组成的⼩肽(8.5 kDa)。
该肽序列⾼度保守,且含有7个赖氨酸位点(K6、K11、K27、K29、 K33、 K48和K63)和1个位于C端的⽢氨酸(Gly)位点以及位于N端的甲硫氨酸(Met1)位点。
依据靶蛋⽩泛素链上的泛素分⼦是否通过同⼀个氨基酸残基彼此相连,可将其分为同型或异型泛素化修饰(如图1A和图1B)。
此外,泛素⾃⾝也能被翻译后修饰,如磷酸化或⼄酰化修饰等,可使得泛素化过程变得更为复杂,如图1C。
图1:A,同型的多聚泛素化修饰;B,异型的多聚泛素化修饰;C,泛素的⼄酰化和磷酸化⽽泛素化过程通常需要3种泛素化酶的协同作⽤:泛素激活酶 E1、泛素结合酶E2和泛素连接酶E3。
其中,E1是起始泛素化反应的酶,可在ATP的作⽤下,将两个泛素分⼦C端⽢氨酸的羧基以⾼能的硫羟酸酯键连接到E1⾃⾝的活性半胱氨酸的巯基侧链上。

蛋白质化学修饰的研究进展及其在疾病治疗中的应用随着现代医学研究的不断深入,人们越来越清楚地认识到蛋白质是生物体内最重要的分子之一。
蛋白质化学修饰作为蛋白质结构和功能的关键调节因素,在细胞信号转导、代谢调节、基因表达、免疫应答以及疾病发生发展等方面发挥着至关重要的作用。
本文将介绍蛋白质化学修饰的研究进展和其在疾病治疗中的应用。
一、蛋白质化学修饰的研究进展蛋白质化学修饰是指在蛋白质分子上发生的各种化学反应,包括糖基化、磷酸化、醋酸化、甲基化、乙酰化、泛素化等多种修饰类型。
其中,糖基化是目前最为广泛研究的一种蛋白质修饰,它涉及到多种糖基转移酶、糖化终产物和受体等。
糖基化的主要功能是调节蛋白质的稳定性、活性和相互作用,进而影响蛋白质参与的细胞生理和病理过程。
近年来,越来越多的研究表明蛋白质化学修饰不仅包括单一修饰的发生,还涉及到复杂的“联合修饰”和“交叉修饰”等模式。
例如,乙酰化和甲基化在修饰特定位点上相互作用,形成了蛋白质的“联合修饰”模式,这种模式在基因表达和染色质结构的调节中更为常见。
另外,一些神经退行性疾病如阿尔茨海默病、亨廷顿舞蹈症等,其病理表现中也涉及到复杂的“交叉修饰”。
除了复杂的修饰模式,科学家们也在不断发掘蛋白质化学修饰的新功能。
例如,乙酰化修饰可以作为非编码RNA的启动子,直接参与到基因转录中;而磷酸化修饰可以诱导蛋白质的异构转变,影响蛋白质相互作用和免疫应答等多种生物学过程。
二、蛋白质化学修饰在疾病治疗中的应用随着对蛋白质化学修饰的深入研究,科学家们也开始尝试利用这些修饰来开发新的疾病治疗策略。
以下是一些目前已知的疾病治疗应用:1. 蛋白质泛素化在肿瘤治疗中的应用泛素化是一种重要的蛋白质化学修饰方式,在调节蛋白质代谢、稳定性和免疫应答等方面发挥着重要作用。
研究表明,许多恶性肿瘤的发生和发展与泛素化失调有关。
因此,利用泛素化修饰来调节肿瘤细胞的代谢和凋亡等生理过程,已经成为很多科学家的研究重点。

泛素化修饰与人类疾病泛素-蛋白酶体途径由泛素(ubiquitin,Ub)、泛素活化酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzymes,E2s)、泛素-蛋白连接酶(ubiquitin-protein ligases,E3s)、26S蛋白酶体和泛素解离酶(deubiquitinating enzymes,DUBs)等组成,其对靶蛋白的降解是一种级联反应过程。
泛素首先在El催化下,其C末端甘氨酸残基与El的半胱氨酸残基间形成高能硫酯键而获得活性。
El-泛素结合的中间体再将泛素转移给E2,形成E2-泛素中间体。
最后靶蛋白的泛素化还需要另一个特异的泛素蛋白连接酶E3s。
E3s可以直接或间接与底物结合,促使泛素从与E2s形成的硫酯中间产物转移到靶蛋白赖氨酸残基的ε氨基基团上,形成异肽键(isopeptide bond)。
当第一个泛素分子连接到靶蛋白上后,另外一些泛素分子在E3s的催化下相继与底物相连的泛素分子的第48位赖氨酸残基相连,形成一条多聚泛素链,作为底物被蛋白酶体识别和降解的靶向性信号。
完成泛素化的蛋白质结构被展平进入26S蛋白酶体,在20S催化中心中被降解,泛素分子可被DUBs从底物上水解下来,重复利用。
一、泛素(Ub)泛素是1975年由Goldstein首先发现的一种在真核生物细胞内高度保守的多肽,单个泛素分子由76个氨基酸组成,分子量约8.5kD。
在不同生物体间组成泛素的氨基酸序列差别很小,如酵母和人的泛素仅有3个氨基酸序列的差别。
泛素分子紧密折叠成球形,5股混合的β片层形成一个腔样结构,内部对角线位置有1个α螺旋,这个结构称为泛素折叠。
这个小蛋白含有一个明显的疏水核心和大量的氢键,表现出特殊的稳定性,能够防止在结合和靶向性降解循环中变性失活,从而保证泛素循环的运行。
从泛素折叠中突出来的是具有一定变形性的C末端延伸部分,这个末端第76位含有一个必须的甘氨酸。

精心整理泛素化蛋白检测方法蛋白质泛素化简介蛋白质泛素化修饰过程在人体免疫系统调节过程中起到了关键性的作用。
与磷酸化修饰过程一样,泛素化修饰过程也是一种可逆的共价修饰过程,它能够调节被修饰蛋白的稳定性、功能活性状态以及细胞内定位等情况。
泛素蛋白是一个由76个氨基酸残基组成的非常保守的多肽,它能在E1、E2、E3 酶等一系列酶促反应催化下与细胞内靶蛋白上的一个或多个赖氨酸残基发生共价连接。
泛素蛋白本身也含有7 个赖氨酸残基,因此它们之间也可以通过这些位点互相连接,形成多泛素蛋白链(polyubiquitinchain )。
目前研究显示,如果多泛素蛋白链与被修饰蛋白上的第48 位赖氨酸残基相连,会介导靶蛋白进入蛋白酶体而被降解;如果与被修饰蛋白上其它位点,比如第63 位赖氨酸残基相连,则靶蛋白可以发挥信号通路功能而不会被降解。
与磷酸化修饰途径一样,泛素化修饰途径也是可逆的,即可以通过去泛素化酶(DUB )将泛素蛋白修饰物去除掉。
靶蛋白经泛素化途径修饰之后,连接在靶蛋白上的泛素蛋白单体或多聚体可以被各种泛素蛋白结合结构域(UBD )所识别和结合。
人类蛋白质组中含有两种E1酶、50种E2 酶、600种E3酶、90种DUB 酶和20种UBD,这说明泛素修饰途径在细胞调控中起到了多么重要的作用。
E3酶是泛素修饰途径中决定底物特异性的关键酶,它可以分为两大类,即含有HECT 结构域的E3酶和其它含有RING 结构域或RING 样结构域(比如U-box或PHD结构域)的E3酶。
这两种E3 酶都在免疫调控过程中起到了关键性的作用。
蛋白质泛素化的检测方法研究蛋白质的泛素化首先需要明确的三个基本点:哪些蛋白发生了泛素化;发生了泛素化的蛋白质,具体是哪个位点的赖氨酸残基发生了泛素化;进行定量。
明确了上述几点后,进一步需要弄清楚的是,我们感兴趣的泛素化蛋白,是如何发生泛素化的,影响这一泛素化过程的关键分子是什么?或者说这一过程中的E3 酶是什么?然后需要研究的是,这一蛋白质发生泛素化之后可以产生那些分子效应?对下游的信号通路有什么影响?研究上述内容的实验方法和实验流程:方法一:westernblotandstrip通过WB 检测所有发生泛素化的蛋白条带,拍照后,将膜strip。

蛋白质表达下游泛素化修饰的研究进展蛋白质表达和修饰是细胞中重要的生物过程之一。
其中,泛素化修饰作为一种重要的调控方式,在调节细胞功能和生命活动中起到了关键作用。
本文将重点讨论蛋白质表达下游泛素化修饰的研究进展。
1. 泛素化修饰的基本原理泛素化修饰是通过将小的蛋白质分子——泛素与目标蛋白结合,形成共价结合的方式,来对目标蛋白进行调控和修饰。
此过程中,泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)共同参与,其中泛素连接酶起到了选择性识别目标蛋白的作用。
2. 泛素化修饰与蛋白质降解蛋白质降解是泛素化修饰的一个重要功能。
泛素连接酶通过特定的底物递交系统将泛素与目标蛋白结合,之后将其送入蛋白酶体进行降解。
此过程中,泛素附着于目标蛋白的Lys残基上,形成与多个泛素分子相连接的链状结构(泛素链)。
泛素链的长度和具体的泛素链拓扑类型能够决定目标蛋白的降解速率和方式。
3. 泛素化修饰在信号转导中的作用泛素化修饰在细胞信号转导中也发挥着重要的作用。
例如,某些泛素连接酶可以调控细胞因子受体的内化和降解,从而调节信号通路的激活和抑制。
此外,泛素化修饰还能够通过调控转录因子的稳定性和活性,影响基因的表达。
4. 泛素化修饰与细胞周期调控细胞周期的调控是细胞正常生命周期的重要保证。
泛素化修饰在细胞周期各个阶段都发挥着关键的作用。
例如,在细胞进入有丝分裂前期时,泛素化修饰可以调控关键蛋白的降解,从而促进细胞周期的进展。
5. 泛素化修饰与疾病的关系泛素化修饰的异常在很多疾病的发生和发展中起到了关键作用。
例如,其与癌症的关系已被广泛研究。
异常的泛素化修饰可以导致细胞周期失控、肿瘤抑制基因的失活以及促癌基因的活化等,从而促进肿瘤发展。
综上所述,蛋白质表达下游泛素化修饰是一个复杂而重要的生物学过程,对细胞功能和生命活动起着关键作用。
对该修饰过程的深入研究将有助于我们更好地理解细胞调控的机制,进而为疾病治疗和药物研发提供新的思路和靶点。

蛋白质泛素化修饰和去泛素化修饰的功能研究蛋白质泛素化修饰和去泛素化修饰是目前热门的研究领域。
泛素是一种重要的蛋白质后修饰,可以通过与目标蛋白特异性连接,调控其功能、定位、代谢等。
实验证明,除了内源性泛素化修饰,该系统还需要伴随流程——去泛素化修饰——维持平衡。
本文旨在介绍蛋白质泛素化修饰和去泛素化修饰的功能研究进展。
一、蛋白质泛素化修饰的功能泛素连接酶(E1)和泛素结合酶(E2)与箭头指向同一泛素激活酶(E3)协同作用,将泛素连接到目标蛋白上。
泛素化修饰在细胞内起着许多核心功能,在生理和病理学上具有广泛的影响。
大量的细胞过程都受到蛋白质泛素化修饰的调控,如可编程信号转导和调节,细胞周期,基因表达,代谢和蛋白折叠以及定位。
1. 信号转导和调节泛素连接的蛋白在许多信号通路的正常调节中有着核心作用。
泛素化修饰在核转录因子、膜受体、调节因子等参与的信号传递中,保证了较为复杂的信号递交和加工。
同时,这些途径也参与了免疫反应保护、热休克反应、细胞凋亡等复杂生理过程。
2. 细胞周期泛素化修饰在细胞周期的健康维护中发挥着重要作用。
泛素连接的蛋白参与了细胞增殖和分化调控。
细胞周期调控中,MCB-box E3家族成员在S期或G2期维持稳态和动力学计时控制;Apc/C家族成员调节了有丝分裂中的染色体分离、微管稳定性、细胞质基质重组,而作为细胞膜相关的ligase NEDD4以及cullin-RING E3连接酶 (CRL)家族成员在G1、M和G0期活动。
3. 代谢和蛋白折叠以及定位泛素化修饰在代谢、蛋白折叠状态的维持和细胞定位等方面有着重要的调控作用。
透过泛素化修饰,能够联接蛋白在细胞内的移动和转化,同时配合去泛素化酶对蛋白的稳定性和生物功能进行精细的调节。
二、蛋白去泛素化修饰的功能近期研究表明,除了泛素化修饰重要之外,泛素蛋白酶(Deubiquitinatingenzymes,DUBs)在之前研究中仍倾向于较为简单的视作一种“蛋白分解酶”,实际上其功能极其广泛。

蛋白质泛素化修饰作用机制及其研究进展蛋白质泛素化修饰是指将多聚泛素附加到特定蛋白质上,起调节蛋白酶降解、修饰、信号转导等多种作用。
蛋白质泛素化修饰是一种基因后修饰修饰,与磷酸化、甲基化、乙酰化等修饰方式类似,参与了调控细胞周期、免疫应答、DNA修复、蛋白聚集等重要生命过程。
本文旨在综述蛋白质泛素化修饰的作用机制及其在疾病诊断和治疗中的研究进展。
一、泛素修饰酶泛素修饰酶(Ubiquitin ligases)是将泛素分子连接到靶蛋白质上的酶。
经典的泛素修饰酶主要由Cullin-RING Ligase (CRL)家族和Anaphase PromotingComplex/Cyclosome (APC/C)家族构成。
这些酶通过牵扯多条泛素分子来修饰靶蛋白,此过程被称为多聚化。
多聚泛素化被认为是介导靶蛋白降解及其它细胞生理过程的关键。
二、泛素化的类型及作用在泛素化过程中,可发生单泛素化、多泛素化和链型泛素化三种方式。
泛素单体附着到靶蛋白上通常会参与非降解途径,比如调节某些酶的活性或定位。
而多泛素化通常意味着目标蛋白质的降解,也可以用来促进信号转导。
至于链型泛素化,不同的链型几乎会导致不同的生物学效应。
三、泛素化修饰与疾病泛素化与疾病的相关性始终是生物医学领域中的热点问题。
如丝裂原活化酶(Anaphase-Promoting Complex, APC)受阻会导致细胞周期紊乱从而出现癌症。
近年来,越来越多的证据表明,泛素化失调会导致许多疾病:神经退行性疾病、白血病、自身免疫性疾病等。
四、蛋白质泛素化的研究进展近年来,高清新技术如晶体和电子显微镜、质谱分析等手段为蛋白质泛素化修饰的研究提供了很多途径。
同时,小分子作为泛素化调控的工具被广泛使用。
但是仍存在很多问题,如调控的复杂性以及特殊群体的深入研究等。
研究表明,针对特定生理过程中的泛素化调控靶点,特别是那些可能影响免疫系统、精子发生以及神经系统活动的靶点,是很有潜力的治疗方案。
组蛋白泛素化和去泛素化调节修饰的作用研究细胞内的蛋白质通常需要通过修饰来调控其生物功能。
其中,泛素化和去泛素化修饰是广泛研究的两种蛋白质修饰方式。
泛素化修饰通常会使其靶蛋白在适当的条件下发生降解,而去泛素化修饰则是通过移除蛋白质上的泛素来调节泛素化修饰的水平。
在这篇文章中,我们将探讨组蛋白泛素化和去泛素化调节修饰在细胞内的作用,并介绍相关的研究进展。
1. 组蛋白泛素化的作用组蛋白泛素化是指泛素蛋白质连接酶复合物(E3)在组蛋白上进行泛素修饰。
这种修饰通常发生在组蛋白H2A和H2B上的C 端赖氨酸上。
组蛋白泛素化在细胞内扮演着重要的角色,影响染色质的结构、功能和动态状态。
研究发现,组蛋白泛素化可以促进染色质复制、DNA损伤修复和转录调控等生物学过程。
组蛋白泛素化作用最初被发现是通过泛素连接酶复合物RNF8来调节DNA损伤响应。
它将组蛋白H2A和H2AX泛素化,以便于DNA损伤和修复信号的转录调控。
除此之外,在DNA损伤之后还有另外一种泛素连接酶复合物RNF168参与到DNA损伤响应中。
RNF168会在损伤位点周围的组蛋白H2A上进行泛素化修饰,并进一步定位和激活DNA损伤响应因子。
2. 组蛋白去泛素化的作用与组蛋白泛素化相对应,组蛋白去泛素化是移除蛋白质上泛素修饰的修饰方式。
组蛋白去泛素化酶(DUBs)可以通过水解泛素和靶蛋白的连接来调节蛋白质的泛素化状态。
研究表明,组蛋白去泛素化可以影响转录调控、DNA损伤修复和染色质结构等生物学过程。
有一类组蛋白去泛素化酶,被称为SAGA去泛素化模块(SGF11),可以移除组蛋白上的泛素修饰,从而调节转录后修饰事件。
研究表明,SGF11在神经发育和骨骼肌形成中具有重要的作用。
此外,RICTOR蛋白也具有去泛素化酶活性,它能够去除组蛋白上的泛素修饰,影响胚胎干细胞的自我更新和再生。
3. 组蛋白泛素化和去泛素化在疾病中的作用组蛋白泛素化和去泛素化对于人类疾病的发病机制也具有很大的影响。
蛋白质修饰与功能的研究进展蛋白质是生命体中最基本的分子之一,它是细胞的组成部分和许多生命过程的执行者。
在生命过程中,蛋白质的功能受到多种因素的影响,蛋白质的修饰是其中一种影响因素。
蛋白质修饰是指通过添加或移除化学基团来改变蛋白质的性质和功能。
现在,越来越多的研究表明蛋白质修饰与生物活动密切相关。
本文将介绍蛋白质修饰的类型、研究进展以及蛋白质修饰在生物医学、生物工程等领域的应用。
一、蛋白质修饰的类型在生物体内,蛋白质的形成和功能实现涉及到多种修饰。
其中比较常见的修饰方式包括糖基化、磷酸化、乙酰化、甲基化、泛素化等。
这些蛋白质修饰的方式可以单独或联合发生,从而影响蛋白质的结构和功能。
糖基化是一种最常见的蛋白质修饰,它指的是糖基分子连接到蛋白质分子的过程。
糖基化修饰可以改变蛋白质的结构和功能,例如增加蛋白质的稳定性、改变分子的亲和性等。
磷酸化是一种将磷酸基团添加到蛋白质上的修饰方式。
它可以调节蛋白质的结构和功能,影响细胞信号转导和代谢通路等生命过程。
泛素化是一种蛋白质降解的基本机制,通过将泛素蛋白修饰在蛋白质上,可使蛋白质降解。
二、蛋白质修饰的研究进展蛋白质修饰研究是生命科学中的一个重要方向。
长期以来,人们一直认为修饰是蛋白质的“附属品”,没有太多的作用。
但最近的研究表明,蛋白质修饰在生物过程中发挥着至关重要的作用。
例如,磷酸化修饰的蛋白质可以调节细胞内信号转导通路,从而影响细胞的生长、分化和死亡等过程。
糖基化修饰则可以影响免疫系统的信号转导和外泌体释放等。
近年来,蛋白质修饰的研究进展非常迅速,越来越多的修饰方式被发现,并且人们开始注意到修饰在疾病治疗中的潜在应用价值。
三、蛋白质修饰在生物医学、生物工程等领域的应用蛋白质修饰在医学和生物工程领域的应用受到越来越多的关注。
蛋白质修饰不仅可以用于疾病诊断,还可以针对某些病理生理现象进行研究和治疗。
例如,在某些肿瘤细胞中,糖基化修饰的数量相对较高,因此通过研究这一修饰方式,可以研究和治疗这些肿瘤。
蛋白质泛素化修饰及其在脓毒症中的研究进展
王宇轩;王倩(综述);吴晓静(审校)
【期刊名称】《微循环学杂志》
【年(卷),期】2024(34)1
【摘要】蛋白质在机体生命活动中扮演关键角色,其降解途径中,泛素-蛋白酶体途
径(UPS)通过泛素化修饰调控蛋白降解,同时通过共价修饰底物蛋白参与细胞生理活动。
去泛素化酶(DUBs)对蛋白质泛素化具有平衡作用,通过移除泛素化修饰来维持
泛素化修饰的动态平衡,它们在脓毒症中发挥着关键作用,通过调控炎症因子的表达,影响机体的炎症反应。
脓毒症是导致患者重症监护的主要疾病,涉及复杂炎症反应。
蛋白质泛素化修饰参与脓毒症信号转导,影响核因子-κB(NF-κB)信号通路和NOD
样受体蛋白3炎症小体(NLRP3)活化。
这些调控机制影响细胞内炎症因子的释放,
进而影响机体炎症反应的强度和时机。
本文探讨了近年来与脓毒症相关关键蛋白的泛素化及去泛素化机制,以期为脓毒症的治疗提供新的靶点和策略。
【总页数】6页(P86-91)
【作者】王宇轩;王倩(综述);吴晓静(审校)
【作者单位】武汉大学人民医院麻醉科
【正文语种】中文
【中图分类】R631
【相关文献】
1.蛋白质小泛素样修饰体化修饰对神经发育和功能的影响
2.蛋白质泛素化修饰的生物信息学研究进展
3.结直肠癌组织中泛素化修饰蛋白的蛋白质组学分析
4.亲和分离在蛋白质泛素化修饰研究中的应用进展
5.母胎界面的蛋白质泛素化修饰及其与病理妊娠相关性的研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
蛋白质泛素化修饰的生物信息学研究进展卢亮;李栋;贺福初【期刊名称】《遗传》【年(卷),期】2013(035)001【摘要】Ubiquitin-proteasome system (UPS) mediates 80% to 85% of the protein degradation in eukaryotic cells. The characteristics of UPS pathway are dependent on ATP, efficient and highly selective. Ubiquitination not only participates in protein degradation, but also directly affects protein activity and localization. Ubiquitination can regulate multiple cellular processes including cell cycle progression, apoptosis, transcriptional regulation, DNA damage repair and immune response. More and more datasets about UPS are published, and it is necessary to organize and analyze these data efficiently. We review the related bioinformatics studies in UPS datasets, such as collection of UPS related proteins, construction and analysis of ubiquitination networks, prediction of ubiquitination sites and motifs. Some potential perspectives are also discussed.%泛素-蛋白酶体系统(Ubiquitin-proteasome system,UPS)介导了真核生物80%~85%的蛋白质降解,该蛋白质降解途径具有依赖ATP、高效、高度选择性的特点.除参与蛋白质降解之外,泛素化修饰还可以直接影响蛋白质的活性和定位.由于泛素化修饰底物蛋白在细胞中的广泛存在,泛素化修饰可以调控包括细胞周期、细胞凋亡、转录调控、DNA 损伤修复以及免疫应答等在内的多种细胞活动.近年来,泛素-蛋白酶体系统相关的蛋白质组学数据不断产出,有效地管理、组织并合理分析这些数据显得尤为必要.文章综述了当前世界范围内针对蛋白质泛素化修饰展开的生物信息学研究,总结了前人的工作结果,包括UPS 相关蛋白质数据的收录、泛素化修饰网络的构建和分析、泛素化修饰位点的预测及泛素化修饰motif 的研究等方面内容,并对该领域未来的发展方向进行了讨论.【总页数】10页(P17-26)【作者】卢亮;李栋;贺福初【作者单位】军事医学科学院放射与辐射医学研究所,北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京,102206;军事医学科学院放射与辐射医学研究所,北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京,102206;军事医学科学院放射与辐射医学研究所,北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京,102206【正文语种】中文【相关文献】1.氮代谢调控相关蛋白质泛素化修饰筛选 [J], 吕永坤;周景文;刘龙2.蛋白质的泛素化修饰在细胞应激反应中的作用 [J], 董雯3.结直肠癌组织中泛素化修饰蛋白的蛋白质组学分析 [J], 杨照微;王晶莹;李时孟;李晓鸥;谢风;何成彦4.布鲁菌16M感染后宿主免疫相关蛋白质泛素化修饰的差异分析 [J], 周玉成; 郭梦楠; 程世鹏; 张海威; 周曼莉; 乔连江; 杨艳玲5.亲和分离在蛋白质泛素化修饰研究中的应用进展 [J], 钟卉菲;黄嫣嫣;金钰龙;赵睿因版权原因,仅展示原文概要,查看原文内容请购买。
蛋白质泛素化研究进展——探索蛋白修饰的秘密泛素是一种含76个氨基酸的多肽,存在于除细菌外的许多不同组织和器官中,具有标记待降解蛋白质的功能。
被泛素标记的蛋白质在蛋白酶体中被降解。
由泛素控制的蛋白质降解具有重要的生理意义,它不仅能够清除错误的蛋白质,还对细胞周期调控、DNA修复、细胞生长、免疫功能等都有重要的调控作用。
2004年,以色列科学家Aaron Ciechanover、Avram Hershko和美国科学家Irwin Rose就因发现泛素调节的蛋白质降解而被授予2004年诺贝尔化学奖。
正是因为泛素调节的蛋白质降解在生物体中如此重要,因而对它的开创性研究也就具有了特殊意义。
目前,在世界各地的很多实验室中,科学家不断发现和研究与这一降解过程相关的细胞新功能。
现在,研究人员已发现泛素具有多种非蛋白水解功能,包括参与囊泡转运通路、调控组蛋白修饰以及参与病毒的出芽过程等。
鉴于蛋白质降解异常与许多疾病,例如癌症、神经退行性病变以及免疫功能紊乱的发生密切相关,而基因的功能是通过蛋白质的表达实现的,因此,泛素在蛋白质降解中的作用机制如能被阐明将对解释多种疾病的发生机制和遗传信息的调控表达有重要意义。
《生命奥秘》本月专题将介绍泛素系统的来源、研究进展,并重点介绍以“泛素-蛋白酶”为靶位的抗癌疗法,希望能给相关领域的研究人员带来崭新的思路。
一、泛素样蛋白的来源及功能1. 泛素样蛋白及其相关蛋白结构域2. 泛素样蛋白连接后的结果3. 泛素样蛋白修饰途径的起源4. 前景展望二、泛素化途径与人体免疫系统调节1. 泛素修饰途径与NF-κB信号通路的关系2. 泛素蛋白在天然免疫中的作用3. 泛素化修饰途径在获得性免疫机制中的作用4. 泛素修饰系统在自身免疫机制中的作用5. 研究展望三、针对泛素修饰系统的肿瘤治疗方案1. 泛素连接系统是致癌信号通路的重要治疗靶标2. 针对泛素连接酶的治疗方法3. E3连接酶与肿瘤血管形成之间的关系4. 针对抗凋亡蛋白5. 去泛素化酶在肿瘤进展中的作用6. 针对肿瘤细胞的蛋白酶体7. 非降解途径的泛素化修饰作用与肿瘤发生之间的关系8. 干扰泛素蛋白识别过程9. SUMO修饰过程与癌症的关系10. 未来还将面临的挑战四、扩展阅读一种新型抗癌药物——NEDD8活化酶抑制剂五、其它1. 内体ESCRT装置能分选泛素化修饰的膜蛋白2. 内质网的泛素化机制3. DNA修复过程中的泛素以及SUMO修饰机制下一期预告:生物信息学在癌症研究中的应用癌症是一种由遗传和表观遗传改变而引起的疾病。
随着各种“组学”技术的进展,癌症的研究正在经历一场革命。
后基因组学时代的生物技术进展使分子生物学家得以较为精细地研究DNA(基因组学)、mRNA(转录组学)和蛋白质(蛋白质组学),试图在完整背景下描述癌症的技术革新为研究者获得更多有用的资料,并在新途径下去研究及整合提供了机遇。
虽然存在一定的实际困难,但很多的方案正在开发中,目的是整合关于实例的信息、方案和其它不同来源的资料,以鉴定出重要的趋势和方法,最终找到治疗或诊断癌症的新途径。
下一期《生命奥秘》将讨论癌症治疗方法的革命,重点放在生物信息学方面,并进一步讨论如何分析各种组学信息,和它们的应用如何改变了癌症的治疗方法。
一、泛素样蛋白的来源及功能2010-09-21真核生物蛋白可以通过与各种小分子物质或蛋白质相结合的方式被修饰。
在众多的修饰方式当中有一种就是与泛素蛋白或泛素样蛋白(UBL)相结合,采用这种修饰方法可以对多种生理过程进行调控。
UBL蛋白可以控制被修饰蛋白与其它生物大分子(比如蛋白酶体或染色质)间的相互作用。
各种UBL系统都会使用相应的酶来催化修饰反应,不过这些修饰反应中大部分都是暂时的。
有越来越多的证据表明这种UBL修饰途径来自原核生物的硫转移酶系统(sulphurtransferase system)及相关酶类。
而且,在真核生物的共同祖先中,类似于UBL连接酶和UBL去连接酶的蛋白也是广泛存在的,这些证据都说明UBL修饰系统不是起源于真核生物。
真核细胞内的蛋白都会经历各种翻译后修饰,这些修饰过程极大地扩展了蛋白的功能多样性和动力学多样性。
蛋白可以通过与磷酸基团、甲基化基团、乙酰基团或某些蛋白质基团(通常这种连接方式都是短暂的)相连接的方式被修饰。
而泛素蛋白修饰方式就是上述与蛋白质相连的修饰方式中第一个被发现的。
现在,我们已经对这种修饰途径研究得非常透彻了。
泛素蛋白是一小分子蛋白,它在真核生物界非常保守,但是在真细菌界(Eubacteria)和古细菌界(Archaea)都不存在。
泛素蛋白还可以与上千种不同的蛋白结合。
泛素化过程是一个复杂的过程(背景知识框1)。
UBL修饰途径也与泛素化修饰途径类似。
参与UBL修饰途径的酶虽然各不相同,但在进化上都与参与泛素化途径的酶具有相关性。
由于泛素蛋白与UBL蛋白具有相同的三维核心结构——β-抓握折叠(β-grasp fold)结构——这说明各种不同的UBL修饰系统都源自一个共同的祖先。
背景知识框1:泛素蛋白连接机制泛素蛋白(图中绿色圆圈所示)是由76个氨基酸残基组成的多肽,它可以被一系列的酶促反应活化,进而与底物靶蛋白相连接(如图中箭头所示)。
UBL修饰系统采用的也是类似途径。
有三种酶——E1、E2和E3——参与了泛素修饰反应,这包括多泛素蛋白合成反应,即在一个泛素蛋白的基础之上再添加好几个泛素蛋白(如图中括号所示)。
E1酶负责活化泛素蛋白、E2酶通过转硫醇作用从E1酶处获得泛素蛋白,并将其与底物蛋白相结合,然后E3酶将泛素蛋白与底物连接(在某些情况下会先形成一种硫酯中间产物,然后再与底物结合)。
所有真核生物编码的E2和E3同工酶种类非常多,其中E2同工酶有几十种,而E3同工酶则多达数百种。
这样,细胞就能对多种蛋白进行各种方式、特异性的修饰和调节,而且这些修饰调控作用也都会受到严密的时空调控。
泛素蛋白的C末端通常都经由酰胺键(amide linkage)与靶蛋白的氨基团连接在一起。
最常见的连接是与靶蛋白赖氨酸的ε氨基团相连,不过也可以与靶蛋白的N末端相连。
此外,最近还发现泛素蛋白可以与靶蛋白上的半胱氨酸、丝氨酸和苏氨酸相连。
在多泛素链中,一个泛素蛋白分子的赖氨酸侧链与另一个泛素蛋白的C末端相连,如此反复形成多泛素链。
泛素蛋白含有7个赖氨酸残基,所有这些赖氨酸残基都可以参与上述多泛素链的合成过程。
泛素蛋白的C末端含有甘氨酸残基,在泛素蛋白与其它蛋白相连之前,该残基必须被活化。
最初,C末端被E1酶腺苷酰化,随后E1酶的半胱氨酸侧链攻击泛素蛋白的C末端,形成E1-泛素蛋白硫酯中间产物。
然后被活化的泛素蛋白被“移交”给E2酶活性位点中的半胱氨酸残基,再在E3酶的共同作用下,催化靶蛋白泛素化反应。
E3酶在识别靶蛋白底物的过程中起到了关键性作用(不过有些UBL 途径不需要E3酶的参与)。
在泛素化修饰途径中,还有一些不同的E3酶可以催化泛素蛋白与被单泛素化修饰或多泛素化修饰的靶蛋白相连接。
这些E3酶有时也被称为E4酶(尤其是在延伸多泛素侧链时)。
去泛素化酶(DUB)可以将靶蛋白上的泛素蛋白水解下来,由于DUB酶的存在,泛素化作用只能是暂时的。
这种由泛素蛋白和其它UBL蛋白负责的动态修饰过程构成了一个可逆的“开关”,来控制底物蛋白的不同功能状态,调控细胞内的多种生理活动过程。
泛素蛋白于1975年被首次发现。
之后的10年间,我们对泛素修饰系统的进化前体分子(evolutionary precursors)进行了深入的研究。
泛素蛋白被认为是真核生物蛋白中最保守的蛋白之一,但直到最近都还没有很好的、足够灵敏的序列比对方法在细菌蛋白质中发现序列相似的蛋白质。
不过,近两年技术方法的快速发展彻底改变了这种情况。
首先,序列比对方法变得更为先进了,因而发现了许多泛素蛋白以及泛素修饰系统参与蛋白之间的相似之处,也发现了很多细菌蛋白之间的相似之处;其次,结构测定研究发现,在很多原核蛋白、真核蛋白中都有泛素样折叠结构,不过这些蛋白之间在序列上的相似性很低;第三,在对次级代谢产物和酶辅因子,比如原核生物里的硫胺素(thiamine),即维生素B1等的机理分析中发现了UBL蛋白的激活与连接机制。
这些研究进展说明,泛素系统是由各种早就在原核生物里存在的、经历了多样化改变的组成元件和反应体系进化而来的。
在泛素修饰过程中存在的多样性非常奇特,修饰的结果取决于泛素蛋白是以单体形式还是多聚体形式与靶蛋白相连接(图1)。
各种不同的泛素蛋白间的连接形式决定了被修饰蛋白的命运。
当靶蛋白被多泛素化途径修饰之后会与26S蛋白酶体这种多亚基蛋白酶复合物结合,然后被降解,靶蛋白降解后泛素蛋白会被循环利用。
细胞利用这种途径降解那些“多余的”蛋白质,以保证细胞周期的正常进行,保证转录调节、蛋白质含量、信号转导甚至昼夜节律等的正确性。
泛素化修饰也有非降解作用,比如介导膜蛋白内吞作用和蛋白质胞内运输作用、参与染色质介导的转录调节作用、DNA修复作用以及信号复合体合成等等。
泛素化途径与细胞内这么多的功能都有关系,这就不难解释为什么我们会发现越来越多的疾病都与泛素化途径失调有关了。
这些疾病包括癌症、Angelman综合征等严重智力障碍疾病,帕金森氏病、阿尔茨海默病和亨廷顿氏病等神经变性性疾病以及II型糖尿病等等。
1. 泛素样蛋白及其相关蛋白结构域对UBL蛋白及其相关蛋白结构域的研究缘起于上世纪80年代末。
当时发现了一种干扰素诱导的、分子量为15KDa的蛋白产物——ISG15。
该蛋白在序列上与泛素蛋白有高度的相似性——可以通过共价结合的方式修饰其它蛋白。
后来发现ISG15蛋白是表1中所列举的一系列UBL蛋白中第一个被发现的UBL蛋白。
尽管如此,直到目前为止我们对它的功能还是知之甚少,至今才发现了ISG15蛋白的E1酶(即ISG15活化酶)和E2酶(即ISG15连接酶)(背景知识框1)。
这些酶与ISG15蛋白一样,也都是被I型干扰素诱导表达的。
我们用小鼠模型研究发现,蛋白经ISG15蛋白修饰之后,可以表现出抗病毒作用,这也符合ISG15蛋白通过I型干扰素诱导表达的特性。
I型干扰素是机体先天免疫系统对病毒作出反应而产生的活性蛋白。
与泛素蛋白一样,9种UBL蛋白都是通过共价连接的方式连接到靶生物大分子(大部分是蛋白)上从而对其进行修饰的。
表1列出了UBL修饰系统常见的靶蛋白(不过该表并不完整)。
泛素系统可以对酵母细胞中超过1000多种的不同蛋白质进行修饰,有一些UBL修饰途径,比如SUMO(小类泛素修饰因子)修饰途径的靶蛋白非常多,而且靶蛋白之间差异非常大。
而另一些UBL修饰途径的靶蛋白范围则非常有限,比如UBL蛋白酵母蛋白Atg12似乎只有一个靶蛋白Atg5,Atg8蛋白只与一种特殊的磷脂——磷脂酰乙醇胺(phosphatidylethanolamine)相结合。