硼族元素及其化合物
- 格式:pptx
- 大小:1.79 MB
- 文档页数:17
高中化学奥林匹克竞赛辅导硼族元素一、硼族元素简介硼族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl),在周期表中处于第Ⅲ A族。
硼族元素的价电子构型为n s2n p1,除硼外其余元素均为金属元素,金属性随原子序数的增加而增强。
B的半径较小,失去三个电子非常困难,因此硼不能形成简单阳离子B3+,只能通过共用电子对形成共价化合物。
Al、Ga、In、Tl在水溶液中可以形成M3+。
因为惰性电子对效应,Tl3+具有强氧化性。
在硼族元素形成的共价分子中,中心原子最外层只有6个电子,未达到8电子的外层结构,属于缺电子化合物,它们具有一个空p轨道,可以接受孤对电子形成配位键,是强的路易斯酸。
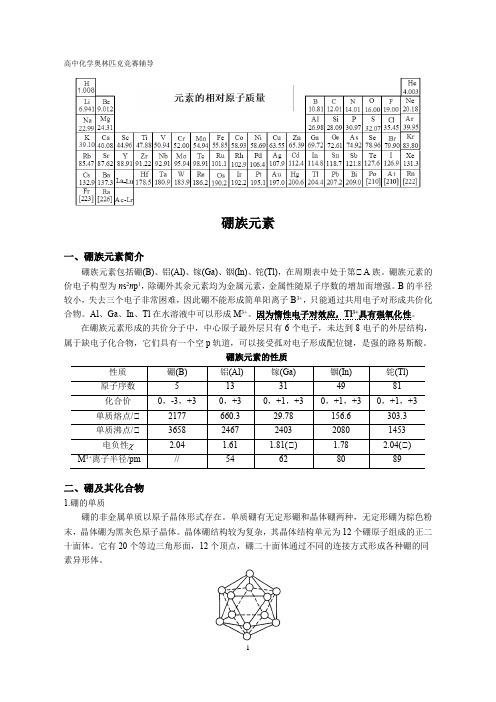
硼族元素的性质二、硼及其化合物1.硼的单质硼的非金属单质以原子晶体形式存在。
单质硼有无定形硼和晶体硼两种,无定形硼为棕色粉末,晶体硼为黑灰色原子晶体。
晶体硼结构较为复杂,其晶体结构单元为12个硼原子组成的正二十面体。
它有20个等边三角形面,12个顶点,硼二十面体通过不同的连接方式形成各种硼的同素异形体。
晶体硼的化学活性较低,无定形硼较活泼。
常温下,硼能与F 2反应,高温下能与N 2、O 2、S 等非金属单质反应。
无定形硼可被热的浓硝酸、浓硫酸氧化成硼酸,也能与强碱作用放出氢气。
2B+N 22BN(与金刚石C 2互为等电子体,是原子晶体) B+3HNO 3(浓)B(OH)3+3NO 2↑2B+2NaOH+2H 2O2NaBO 2+3H 2↑(与Al 的性质相似)2.硼的氧化物及含氧酸硼最重要的氧化物是B 2O 3,熔融B 2O 3能溶解许多金属氧化物,形成具有特征颜色的偏硼酸盐,这个反应用于定性分析,称为硼珠实验:CuO+B 2O 3Cu(BO 2)2(蓝色) NiO+B 2O 3Ni(BO 2)2(绿色) B 2O 3的水化物为硼酸H 3BO 3或B(OH)3。
H 3BO 3是白色的片状晶体,具有片层结构,层和层 之间存在范德华力,容易发生滑动,其中氢键对其结构的形成具有支配的作用。



硼族元素及其化合物
一、硼的性质
硼(Boron)是一种族IIIb的元素,在化学元素周期表中第五位,原子序数为5,原子质量为10.81、硼元素是一种半金属元素,具有金属质地,保持着类似硅的结构。
硼具有极强的抗氧化、加热稳定性、腐蚀性,使其有着优良的电性能,适用于电子设备中的导电成份,还拥有稳定的介电性能,是线路板制作的上佳材料。
二、硼的化合物
(1)氢氧化硼
氢氧化硼(H₂BO₃)是硼元素的最常见的化合物。
它是一种无色粉末状的晶体,熔点为350℃,有特殊的稀酸味,非常溶于水,但在碳酸钠、碳酸氢钠水溶液中极难溶解。
氢氧化硼是一种电解质,是用作电缆、电池和电磁浮动的主要材料。
(2)硼酸
硼酸(HBO₂)是硼的重要的化合物之一,其有机半氧化物的形式为
H₃BO₃,通常以白色粉末的形式存在,溶于水,不溶于二氯甲烷,拥有特殊的稀酸性味道。
硼酸有着广泛的应用,主要用作农药、洗涤剂、轻工业中制作消光剂、染料、防腐剂和焊条等。
(3)硼酸钠
硼酸钠(Na₂B₂O₄·2H₂O)是一种水溶性的硼酸盐,主要用作染料、洗涤剂、消光剂、增塑剂、绝缘剂、涂料等。

硼族元素及其化合物约公元前200年,古埃及、罗马、巴比伦曾用硼沙制造玻璃和焊接黄金。
法国化学家盖·吕萨克用金属钾还原硼酸制得单质硼。
硼在地壳中的含量为0.001%。
硼为黑色或银灰色固体。
晶体硼为黑色,硬度仅次于金刚石,质地较脆。
硼还由于其缺电子性造成其氢化物中硼原子拥有异常高的配位数,使之成为所有元素氢化物中结构最复杂的。
单质硼为黑色或深棕色粉末,熔点2076℃。
沸点3927℃。
单质硼有多种同素异形体,无定形硼为棕色粉末,晶体硼呈灰黑色。
晶态硼较惰性,无定形硼则比较活泼。
单质硼的硬度近似于金刚石,有很高的电阻,但它的导电率却随着温度的升高而增大,高温时为良导体。
硼共有14种同位素,其中只有两个是稳定的。
室温时为弱导电体;高温时则为良导体。
在自然界中主要以硼酸和硼酸盐的形式存在。
晶体结构晶态单质硼有多种变体,它们都以B12正二十面体为基本的结构单元。
这个二十面体由12个B原子组成,20个接近等边三角形的棱面相交成30条棱边和12个角顶,每个角顶为一个B原子所占据。
由于B12二十面体的连接方式不同,键也不同,形成的硼晶体类型也不同。
其中最普通的一种为α-菱形硼。
α-菱形硼是由B12单元组成的层状结构,α-菱形硼晶体中既有普通的σ键,又有三中心两电子键。
许多B原子的成键电子在相当大的程度上是离域的,这样的晶体属于原子晶体,因此晶态单质硼的硬度大,熔点高,化学性质也不活泼。
在α-菱形硼晶格中,每个二十面体通过处在腰部的6个B原子以三中心两电子键与在同一平面内的相邻的6个二十面体连接起来(其中虚线三角形表示三中心两电子键,键距203pm)。
这种二十面体组成的片层,层面结合靠的是二十面体的上下各3 个B原子以6个正常的B-B共价键(即两中心两电子键,键长171pm)同上下两层的6个附近的二十面体相连接,3个在上一层,3个在下一层。
在硼的二十面体结构单元中,B12的36个电子是如下分配的:在二十面体内有13个分子轨道,用去26个电子;每个二十面体同上下相邻的6个二十面体形成6个两中心两电子共价键,用去了6个电子;在二十面体腰部的6个B原子与同平面上周围相邻的6个三中心两电子键,用去了6×2/3=4个电子,结果总电子数是26+6+4=36。

第16章硼族元素16.1 硼族元素的通性16.1.1 硼族元素的通性包括硼、铝、镓、铟、铊五种元素。
硼在自然界中有硼镁矿、硼砂等;铝在地壳中的含量仅次于氧和硅,占第三位,主要以长石、云母、高岭土等硅酸盐形式存在。
镓、铟、铊比较分散,没有单独矿藏,与其他矿物共生。
硼的原子半径最小,核电荷对外层电子的吸引较强,为非金属,其余四种元素为金属,从硼到铝是由非金属突变到金属,不是逐渐过渡的。
●硼族元素氧化物的酸碱性递变规律:硼的氧化物呈酸性,铝和镓的氧化物为两性,铟和铊的氧化物是碱性的。
●硼族元素的价电子构型为ns2np1,一般氧化态为+III。
“惰性电子对效应”,随着原子序数的递增,生成低氧化态的(+I)的倾向增强。
镓、铟、铊在一定的条件下能显示出+I氧化态,特别是Tl ,其+I氧化态常见,Tl(+I)的化合物具有较强的离子健特征。
●硼、铝两元素亲氧特性表现得突出。
●硼族元素价电子轨道(ns和np)数为4,而价电子仅为3,为缺电子原子,它们所形成的化合物有些为缺电子化合物。
有空的价键轨道,这些化合物有很强的接受电子的趋势,容易形成聚合分子(如:Al2Cl6)和配合物(如:HBF4)。
在此过程中,中心原子价轨道由sp2杂化过渡到sp3杂化,相应分子从平面结构过渡到立体结构。
硼原子最高配位数为4,而其它元素外层d轨道可参与成键,最高配位数可以为6。
16.2 硼族元素的单质及其化合物硼在自然界主要以含氧化合物的形式存在。
硼的重要矿石有硼砂Na2B4O7·10H2O,方硼石2Mg3B8O15•MgCl2,硼镁矿Mg2B2O5•H2O等。
铝在自然界分布很广,主要以铝矾土矿形式存在,它是一种含有杂质的水合氧化铝矿。
镓、铟、铊在自然界单独矿物,以杂质的形式分散在其它矿物中。
16.2.1 硼族元素的单质1. 单质硼(1) 单质硼的结构单质硼有多种同素异形体,包括无定形硼和晶体硼。
无定形硼为棕色粉末,晶体硼呈黑灰色。