第2章硼族元素
- 格式:ppt
- 大小:3.31 MB
- 文档页数:53
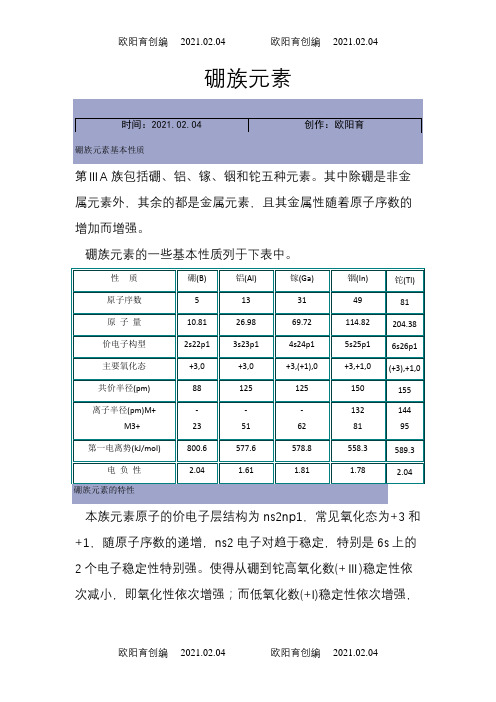
硼族元素第ⅢA族包括硼、铝、镓、铟和铊五种元素。
其中除硼是非金属元素外,其余的都是金属元素,且其金属性随着原子序数的增加而增强。
硼族元素的一些基本性质列于下表中。
本族元素原子的价电子层结构为ns2np1,常见氧化态为+3和+1,随原子序数的递增,ns2电子对趋于稳定,特别是6s上的2个电子稳定性特别强。
使得从硼到铊高氧化数(+Ⅲ)稳定性依次减小,即氧化性依次增强;而低氧化数(+I)稳定性依次增强,其还原性依次减弱。
例如:Tl(Ⅲ)是很强的氧化剂,而Tl(Ⅰ)很稳定,其化合物具有较强的离子键特性。
+Ⅲ氧化态的硼族元素具有相当强的形成共价键的倾向。
硼因原子半径较小,电负性较大,使其共价倾向最强,其它的硼族元素成键时表现为极性共价键。
硼族元素的价电子层有4条轨道(ns、npx、npy、npz),而只有3个价电子,这种价电子层中价轨道数超过价电子数的原子称为缺电子原子,中心原子价轨道数超过成键电子对数的化合物称为缺电子化合物。
如本族+Ⅲ价单分子化合物BF3、AlCl3等。
缺电子原子在形成共价键时,往往采用接受电子形成双聚分子或稳定化合物和形成多中心键(即较多中心原子靠较少电子结合起来的一种离域共价键)的方式来弥补成键电子的不足。
硼族元素电势图下面列出了硼族元素的标准电极电势图。
硼元素硼原子的价电子构型是2s22p1,它能提供成键的电子是2s12p1x2p1y,还有一个空轨道。
硼在化合物的分子中配位数为4还是3,取决于sp3或sp2杂化轨道中σ键的数目。
同硅一样,它不能形成多重键,而倾向于形成聚合体,例如通过B-O-B链形成B2O3或H3BO3或硼酸盐的庞大“分子”。
硼原子成键有三大特性:(1)共价性—以形成共价化合物为特征;(2)缺电子性—除了作为电子对受体易与电子对供体形成σ配键以外,还有形成多中心键的特征;(3)多面体习性—晶态硼和许多硼的化合物为多面体或多面体的碎片而成笼状或巢状等结构。
这种多面体习性同它能形成多种类型的键有关。



第五章 p 区元素(一)第二节硼族元素5.2.1-2 硼族元素概述及单质硼族元素概述Group IIIA: B Al Ga In Tl硼铝镓铟铊硼族元素的价电子构型与氧化态稳定性变化硼单质硼成键特征:1. B主要以共价键成键:B 原子半径小,I1、I2、I3大。
B sp2杂化:BX3、B(OH)3sp3杂化: BF4-、 BH4-、 B(OH)4-2. 缺电子性质(ns2np1)价轨道数4 2s2p x2p y2p z价电子数3 2s22p1BF3 + F- = BF4-Lewis酸Lewis碱酸碱加合物3. B氧化态为+3.4. 具有多中心缺电子键,形成多面体:硼晶体中有B-B-B ,硼烷中有B-B-B ,或B-H-B3c - 2e 键 (3c-2e bond)6. B 与Si 的相似性(r 与Z *竞争结果)对角线规则 5. B 是亲F 、亲O 元素:键能/kJ·mol -1 B-O 561~690;Si-O 452; C-O 358B-F 613; Si-F 565Li Be BC Na Mg Al Si硼单质同素异形体无定形硼晶形硼棕色粉末黑灰色化学活性高硬度大熔点,沸点都很高。
晶形硼中最重要的为α-菱形硼(B12),属于原子晶体α-菱形硼(B12)的结构单元是正二十面体,形成多中心缺电子键。
硼单质的制备钽、钨或氮化硼表面(1) -菱形硼12 BI3══════ B12(c) + 18 I2(g)800~1100 ℃(2)无定形硼Na2B4O7·10H2O + 2HCl = 4H3BO3 + 2NaCl + 5H2O 2H3BO3 = B2O3 +3 H2O (800 K)B2O3 + Mg = 3MgO + 2B (800 K)单质硼的化学性质2 B + 3F 2 = 2 BF 34 B + 3O 2 = 2 B 2O 32 B + N 2 = 2 BN2 B +3 Cl 2 = 2 BCl 32 B +3 S = B 2S 32 B + 6 H 2O(g) = 2 B(OH)3 + 3 H 2↑B + 3 HNO 3(浓) = B(OH)3 + 3 NO 2↑2 B +3 H 2SO4 (浓) = 2 B(OH)3 + 3 SO 2↑2 B + 2 NaOH +3 KNO 3 = 2 NaBO 2+3 KNO 2+H 2O晶体硼惰性。

化学竞赛无机化学绝密课件硼族元素-(含多场合)化学竞赛无机化学绝密课件硼族元素摘要:本文主要介绍了化学竞赛中无机化学部分的重要知识点——硼族元素。
通过对硼族元素的概述、性质、化合物以及应用等方面的详细讲解,旨在帮助参赛者更好地掌握这一部分内容,提高化学竞赛成绩。
一、硼族元素概述硼族元素位于元素周期表的第二族,包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铍(Tl)等元素。
硼族元素在自然界中分布广泛,其中硼和铝是地壳中含量较多的元素。
硼族元素在化学性质上具有一定的相似性,但在物理性质和应用方面存在较大差异。
二、硼族元素的性质1.电子结构:硼族元素的原子结构中,最外层电子数为3个,因此它们在化学反应中容易失去3个电子,形成+3价离子。
2.金属性和非金属性:从上到下,硼族元素的金属性逐渐增强,非金属性逐渐减弱。
硼和铝具有较强的非金属性,而铟和铍的金属性较强。
3.离子半径:硼族元素的离子半径随着原子序数的增加而增大,这是因为原子核对最外层电子的吸引力逐渐减弱。
4.电负性:硼族元素的电负性随着原子序数的增加而减小,这是因为原子核对最外层电子的吸引力逐渐减弱。
三、硼族元素的化合物1.氧化物:硼族元素与氧元素形成的氧化物具有多种类型,如硼酸、氧化铝、氧化镓等。
这些氧化物在工业、医药等领域具有广泛的应用。
2.硼化物:硼族元素与金属元素形成的硼化物具有高熔点、高硬度和良好的导电性等特点,如碳化硼、氮化硼等。
3.氢化物:硼族元素与氢元素形成的氢化物在有机合成中具有重要应用,如硼氢化钠、硼氢化铝等。
4.硼酸盐:硼酸盐是一类重要的无机化合物,如硼砂、硼酸铝等。
它们在玻璃、陶瓷、洗涤剂等领域具有广泛应用。
四、硼族元素的应用1.金属铝:铝是硼族元素中应用最广泛的元素,广泛应用于建筑、交通、包装、电力等领域。
铝具有良好的导电性、导热性和轻质等特点,是国民经济的重要支柱产业。
2.硼化合物:硼化合物在农业、医药、化工等领域具有重要应用。