盐水中氯化钠含量测定方法的探讨
- 格式:pdf
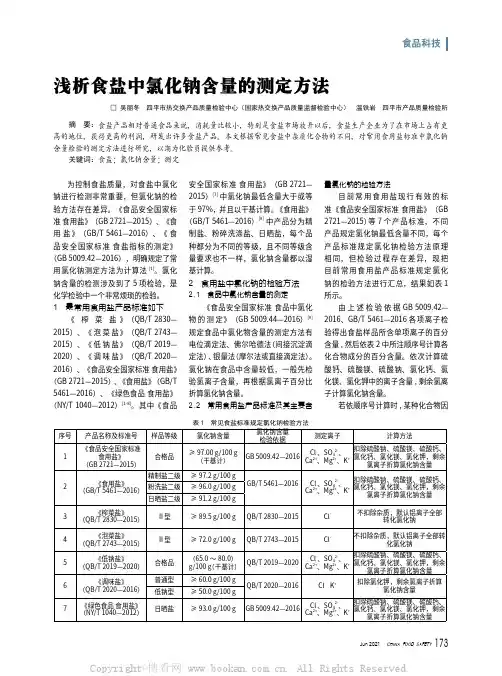
- 大小:169.91 KB
- 文档页数:2

实验二十三 生理盐水中氯化钠含量的测定(银量法)一、实验目的(1)学习银量法测定氯的原理和方法;(2)掌握莫尔法的实际应用。
二、实验原理银量法是指以生成难溶银盐(如、、和)的反应为基础的沉AgCl AgBr AgI AgSCN 淀滴定法成为银量法。
银量法需要借助指示剂来确定滴定终点。
根据作用指示剂的不同,银量法又分为莫尔法。
佛尔哈德法和法扬司法。
本实验是在中性溶液中以为指示剂(莫尔法),用标准溶液来测定的42CrO K 3AgNO -Cl 含量:(白)↓=+-+AgCl Cl Ag (砖红色)↓=++42-24CrO Ag CrO Ag 由于的溶解度小于,沉淀将首先从溶液中析出。
根据分布沉淀原AgCl 4AgCrO AgCl 理进行的计算表明,开始沉淀时已定量沉淀,稍一过量,即与4AgCrO AgCl 3AgNO 离子生成砖红色沉淀,指示终点到达。
-24CrO 实验过程中,应注意以下两点:(1)应控制好指示剂的用量。
因为用量太大时使终点提前到达导致负误差,而用42CrO K 量太小时终点拖后导致正误差。
(2)应控制好溶液的酸度。
因为离子在水溶液中存在下述平衡,-24CrO ⇌+-+O H CrO 324OH HCrO 24+-酸性太强,平衡右移,导致离子浓度下降和终点拖后。
但在碱性太强的溶液中,-24CrO 离子又会生成沉淀:+Ag O Ag 2 ↓=+-+AgOH 2OH 2Ag 2 OH O Ag AgOH 222+↓=所以莫尔法要求溶液的pH 值在6.5~10.5之间。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂仪器:烧杯,电子分析天平,容量瓶(100mL ),坩埚,煤气灯,锥形瓶(250mL ),酸式滴定管(50mL ),移液管(25mL )。
试剂:(s ,A.R.),(s ,A.R.),(5%)溶液,生理盐水样品。
3AgNO NaCl 42CrO K 四、实验步骤1.0.1mol/L 标准溶液的配制3AgNO 标准溶液可直接用分析纯的结晶配制,但由于不稳定,见光3AgNO 3AgNO 3AgNO 易分解,故若要精确测定,则要基准物来标定。


生理盐水中氯化钠含量的测定文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-生理盐水中氯化钠含量的测定2010/10/15一、目的要求:1、学习银量法测定氯的原理和方法;2、掌握莫尔法的实际应用二、实验原理:银量法需借助指示剂来确定终点,根据所用指示剂的不同,银量法又分为莫尔法佛尔哈德法和法扬司法。
本实验在中性溶液中以K2CrO4为指示剂,用AgNO3标准溶液来测定Cl-的含量:Ag+ + Cl-= AgCl↓(白色)Ag+ + CrO42-= Ag2CrO4↓(砖红色)由于AgCl的溶解度小于Ag2CrO4的溶解度,所以在滴定过程中AgCl先沉淀出来,当AgCl定量沉淀后,微过量的AgNO3溶液便与CrO42-生成砖红色Ag2CrO4沉淀,指示出滴定的终点。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂:1)仪器:①酸式滴定管、移液管、容量瓶。
②锥形瓶(6个)、洗瓶。
③电子天平。
2)试剂:分析中,除非另有说明,限用分析纯试剂、蒸馏水或相同纯度的水。
①AgNO3②NaCl()③K2CrO4(w为0.05)溶液④生理盐水样品四、实验步骤1)0.1mol/L AgNO3标准溶液的配制:AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见光易分解,故若要精确测定,则要基准物(NaCl)来标定。
称取1.702g AgNO3,加适量水溶解,转移到100ml容量瓶中,用水稀释至刻度线。
2)标定:准确称取0.0585g NaCl,分别置于三个锥形瓶中,各加25ml水使其溶解。
加1mlK 2CrO4溶液。
在充分摇动下,用AgNO3溶液滴定至溶液刚出现稳定的砖红色。
记录 AgNO3溶液的用量。
重复滴定二次。
计算AgNO3溶液的浓度。
表一:各物质加入质量和滴定到终点的体积24AgNO3(滴定前 ml)413.222.33)测定生理盐水中NaCl的含量:用移液管精确移取已稀释的生理食盐水25ml置于三个锥形瓶中,各加入1ml K2CrO4指示剂,用标准 AgNO3溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。

浅析食盐中氯化钠含量的测定方法食盐是我们日常生活中常用的调味品,它的主要成分是氯化钠。
因此,准确测定食盐中氯化钠的含量对于保障食盐质量至关重要。
本文将对食盐中氯化钠含量的测定方法进行浅析。
测定食盐中氯化钠含量的方法有多种,包括测定氯离子的重量法、电位滴定法、离子选择性电极法等。
下面将对其中几种方法进行介绍:首先是测定氯离子重量法。
该方法主要是通过溶解样品中的氯化钠,然后用银盐溶液滴定,从而测定氯离子的含量。
具体步骤如下:首先,称取一定质量的食盐样品,将其溶解在适当的溶剂中;然后,取适量的银盐溶液,滴定至反应终点,即出现沉淀反应停止;最后,根据滴定过程中银盐溶液的消耗量计算氯离子的含量。
优点是操作简单,准确度高,但需要较长时间进行滴定。
其次是电位滴定法。
电位滴定法是通过滴定电位的变化来测定氯离子含量的方法。
具体步骤如下:首先,将食盐样品溶解,得到容量适当的溶液;然后,将电位滴定仪连接到电极系统上,溶液中插入玻璃电极和参比电极;随后,使用一定速度滴入滴定液,记录下电位变化;最后,根据电位的变化和标准曲线计算氯离子的含量。
该方法速度快,精确度高,但需要专门的仪器设备,并且对实验人员的操作技能要求较高。
最后是离子选择性电极法。
该方法通过使用选择性电极来测定氯离子的含量。
具体步骤如下:首先,制备食盐样品溶液;然后,将离子选择性电极插入溶液中,记录下电位变化;最后,根据电位的变化和标准曲线计算氯离子的含量。
该方法操作简单,准确度高,但同样需要专门的仪器设备,并且对实验人员的操作技能要求较高。
综上所述,测定食盐中氯化钠含量的方法有多种,每种方法都有其适用的场合和优缺点。
在实际应用中,应根据需要选择最合适的方法进行测定。
无论采用哪种方法,都需要在实验操作中保持仪器设备的干净和准确,遵循标准操作流程,以获得准确可靠的测定结果。


食盐中氯化钠的测定
食盐中氯化钠的测定是一项重要的化学实验,通过它可以了解食盐中氯化钠的含量。
本文旨在介绍氯化钠的测定方法及其实施步骤,以便大家了解如何正确地进行氯化钠的测定。
食盐中氯化钠的主要测定方法是电量法、滴定法、弱碱性试液法、离子浓度法等。
其中,电量法是最常用的测定方法,用于测定食盐中氯化钠的含量及其对应百分比。
实验室用微量氯化钠溶液,其电解态盐溶液与等渗选择电极及三极式恒流电源组成电量室,测定食盐中氯化钠的电量。
氯化钠的滴定法也有不同的实施步骤。
首先,将要测定的样品放入实验杯中,然后加入对应的反应液,如酸浓度调节剂、碱浓度调节剂、滴定剂等,搅拌均匀后取出。
接下来,将滴定液加入到样品中,然后观察滴定剂反应生成淡黄色悬液,并及时记录滴定液加量。
最后,把滴定剂的加入量换算成氯化钠的浓度,即可得出样品中氯化钠的含量。
另外还有一种弱碱性试液法,这种方法只需准备弱碱性试液,并把它混合到样品中,然后观察氯化钠的沉淀量来计算样品中氯化钠的含量。
此外,有一种简便可行的测定方法离子浓度法,它以电导率测定法为基础,用电导仪来测定样品中离子的电导率,以此来计算浓度,从而计算氯化钠的含量。
总之,以上就是氯化钠的测定方法及其实施步骤,每种方法都有
其特定的用途,以便根据实际需要,选择适合的方法来测定食盐中的氯化钠含量。
只要科学的处理样品,准确的调节测试参数,就可以精确测定出氯化钠的含量,从而帮助人们获得更安全健康的食盐。

食盐中氯化钠的测定食盐是人类日常饮食中不可或缺的营养物质,是人类抗病能力和营养状态的重要保证。
现今,食盐也被广泛用于食品的调味,改变食物的口感和质地,是厨房必备的调料之一。
而且,食盐中的氯化钠也被用于消毒灭菌,工业场所也会使用氯化钠来消毒水,质量检测是不可少的重要步骤。
因此,我们可以通过对日常食物中的氯化钠含量进行测定,从而掌握食物质量,确保食物安全。
然而,如何准确地测定食盐中氯化钠含量,仍然是一个有待解决的问题。
为了解决这个问题,我们首先要知道氯化钠是一种白色结晶,其化学式为NaCl,亦即钠离子和氯离子的比例为1:1。
氯化钠溶于水,当溶液电导率升高时,氯化钠含量也会相应增加。
测定氯化钠的方法有很多,常见的有离子表面法、电导率法、分光光度法、分析化学法、等温重量法等。
其中,离子表面法测定食盐中氯化钠,是将悬浮液中的离子进行示差电位滤样,通过把滤饼置入培养基中,观察试管膜上细菌的生长情况来测定氯化钠含量,是一种简便、快速、准确的测试方法。
另外,电导率法也是测量食盐中氯化钠含量的常见方法。
通过测量不同溶液的电导率来推断溶液中氯化钠的含量,电导率越高,表明氯化钠含量越高。
此外,分光光度法也是常用的测定氯化钠含量的方法之一。
该方法通过通过在一定波长下透过溶液中NaCl吸收的光,来测定溶液中氯化钠含量。
由于NaCl可以在一定波长下吸收光,所以只需要使用一定种光度仪,就可以测定溶液中NaCl的含量。
分析化学法是测定食物中氯化钠含量的最为准确的方法之一,其原理是先将食物中的氯化钠提取出来,再进行分析检测。
如此可以比较准确地判断食物中氯化钠的含量,以及营养素的构成及比例。
最后,等温重量法是测定食物中氯化钠含量的最为简便的方法。
该方法是指将样品中的氯化钠充分溶解在水中,然后将其称量,得出其含量。
综上所述,可以看出,对食物中氯化钠含量的测定有着多种不同的方法,每种方法都有其特定的优缺点,应根据不同场合和要求灵活选择合适的测定方法。


浅析食盐中氯化钠含量的测定方法食盐是每日饮食中不可缺少的调味品,其中含有大量的氯化钠。
为了控制氯化钠的含量,有必要对其进行准确的测定和分析。
本文旨在通过总结研究方法,浅析食盐中氯化钠含量的测定方法。
一、氯化钠的分析方法1.离子选择电极法离子选择电极法是常见测定食盐中氯化钠含量的一种方法,其原理是根据电位的变化,结合离子选择电极的特性,综合评价样品中氯化钠含量的大小。
在同一电体系中,以氯离子的吸附强度为基础,通过量化的比较,检测出样品中的氯化钠含量。
该方法灵敏度高,测量结果可信度高,适用于食盐中氯化钠含量的测定。
2.蒸馏滴定测定蒸馏-滴定法是最常用的分析方法,也是最常用的测定食盐中氯化钠含量的方法。
原理是用硫酸钠溶液将样品中的氯化钠溶解后,借助蒸馏的方式将其从其他无机离子中分离出来,随后采用滴定的方式进行测量,从而测定食盐中氯化钠的含量。
该方法容易操作,测量结果准确可靠。
二、氯化钠含量的检测方法1.紫外分光光度法紫外分光光度法是一种常用的检测方法,是检测食盐中氯化钠含量的重要手段。
原理是利用紫外分光光度计测定样品吸收光谱,并根据氯化钠本身光谱特性,从而计算出样品中氯化钠的含量。
该方法灵敏度高,测量结果准确可靠。
2.原子吸收光谱法原子吸收光谱法也可以用于检测食盐中氯化钠含量。
原理是根据氯化钠的原子吸收特性,利用原子吸收仪测量样品中的痕量氯化钠,精确测定出样品中的氯化钠含量。
该方法不仅灵敏度高,而且测量结果可靠,是检测食盐中氯化钠含量的理想方法。
综上所述,离子选择电极法与蒸馏-滴定法可以用于测定食盐中氯化钠含量,而紫外分光光度法和原子吸收光谱法则可用于检测食盐中氯化钠含量。
不论采用哪种方法,都要注意控制实验条件,保证测量结果的准确性和可靠性,为食品安全提供可靠的数据保障。

食盐中氯化钠的测定食盐在我们的日常生活中十分重要,它不仅可以增加食物的色泽、风味、美味,而且还能补充人体所需的氯化钠。
当我们购买食盐时,除了要注意它是否合格、优质外,还要了解它是否含有太多的氯化钠,因为过多的氯化钠可能对我们的健康有一定的影响。
因此,了解食盐中原始氯化钠的含量也就显得尤为重要了。
要定性测定食盐中氯化钠的含量,可以使用传统的上滤法、电解法、比重法和滴定法,其中,以上滤法和滴定法应用最为广泛。
上滤法是以氯化钠溶液和蒸馏水混合比例,将混合液以静态萃取方式放入滤管中,滤下部分滤液置于回流装置中,进行循环,滤液中的氯化钠逐渐溶出,最终得到用于测定的滤液,在滤液中物质比较稳定,可用于测定氯化钠的含量。
滤管由釉土和玻璃等制成,其中,釉土滤管的加热效率较高,是一种可重复使用的滤管,而玻璃滤管的加热效率较低,因此也需要定期更换,否则会降低测定的准确性。
滴定法是将待测液(食盐溶液)加热分解,将氯化钠以离子形式溶解测定,然后进行滴定,最终得到氯化钠的含量,这是一种易操作、准确度高的测定方法。
烧杯滴定法,是将待测液放入干燥的烧杯中,用5000比例滴定液或稀硝酸滴定液进行滴定,经滴定即可得出氯化钠的含量。
除上述方法外,还有一种新的技术方法,即利用原子荧光光谱进行测定,它不需要对溶液进行滴定,也不需要使用烧杯、滤筒等实验器材,只需将待测液滴落到原子荧光光谱仪上,就可以测得样品中氯化钠的含量,并将获取的测量值与标准值进行比较,从而评估样品是否合格。
以上就是食盐中氯化钠含量测定的几种方法,我们在进行检测时,可以根据实际情况选择使用哪一种方法,但是要注意多种方法的准确性、可靠性和操作的难易程度,同时要确保检测结果的准确性,以保证食盐的质量安全,为我们的健康作出好的保驾护航。
浅析食盐中氯化钠含量的测定方法食盐是我们日常生活中经常使用的一种调味品,其主要成分是氯化钠。
了解食盐中氯化钠的含量对于我们正确掌握食盐的用量和健康非常重要。
下面将对食盐中氯化钠含量的测定方法进行浅析。
一、化学滴定法化学滴定法是测定食盐中氯化钠含量的最常用方法之一、其基本原理是在适当条件下,用标准溶液滴定食盐中氯化钠的量。
常用的滴定剂有银硝酸钠溶液和铁(Ⅲ)铵硫酸溶液。
1.银硝酸钠滴定法银硝酸钠滴定法是用银硝酸钠溶液与食盐溶液中的氯化钠发生沉淀反应,通过滴定溶液的体积来确定氯化钠的含量。
滴定方程式如下:NaCl+AgNO3→AgCl↓+NaNO3在滴定过程中,使用自准电极测定反应的终点,使银离子与氯离子完全滴定,产生白色沉淀。
此时溶液变成乳白色,标志着反应终点的达到。
2.铁(Ⅲ)铵硫酸滴定法铁(Ⅲ)铵硫酸滴定法是使用铁(Ⅲ)铵硫酸溶液与食盐溶液中的氯化钠发生滴定反应,通过滴定剂的消耗量来确定氯化钠的含量。
滴定方程式如下:2NaCl+FeNH4(SO4)2+6H2O→FeCl3+2NH4Cl+2H2SO4在滴定过程中,使用指示剂来判断反应终点。
一般使用第一种木莲黄或者二苯甲酮作为指示剂,滴定至溶液颜色由淡黄色转变为淡红色即可。
二、电导率法电导率法是通过测定溶液中的电导率来确定食盐中氯化钠的含量。
氯化钠是强电解质,其溶液具有良好的电导性。
1.电导法测定电导法测定食盐中氯化钠的含量是利用溶液中电导率与溶液中的电解质浓度成正比的关系。
首先将食盐样品溶解于水中,然后使用电导率计测定溶液的电导率。
通过根据导电性和电解质浓度的关系,可以计算出食盐样品中氯化钠的含量。
2.双电极电导法测定双电极电导法测定食盐中氯化钠的含量是使用特定的电导电极进行测定。
电导电极由两个电极组成,一个用于浸泡在样品中,另一个用于去除试液中的气泡。
通过测定样品与纯水之间的电导率差异,就可以计算食盐样品中氯化钠的含量。
三、比重法比重法是利用食盐溶液的比重与其中氯化钠的含量成正比的关系来测定食盐中氯化钠的含量。
实验五生理盐水中氯化钠的含量测定一、实验目的了解:沉淀滴定法测定氯化钠含量的基本过程和特点。
理解:沉淀滴定的基本原理。
掌握:沉淀滴定法的基本操作技术。
二、实验原理1. 莫尔法中性或弱碱性溶液中,以K 2CrO 4为指示剂,用AgNO 3标准溶液滴定氯化物。
AgCl 的溶解度<Ag 2CrO 4的溶解度,因此溶液中首先析出AgCl 沉淀,当达到终点后,过量的AgNO 3与CrO 42-生成砖红色沉淀。
Ag ++Cl-AgCl (白色)2Ag ++ CrO 42-Ag 2CrO 4(砖红色)2. 佛尔哈德法在含Cl -的酸性溶液中,加入一定量过量的Ag +标准溶液,定量生成AgCl 沉淀后过量的Ag +以铁铵矾为指示剂,用NH 4SCN 标准溶液进行返滴定,由Fe(SCN)2+络离子的红色,指示滴定终点,主要反应如下:Ag ++Cl −=AgCl (白色),K ap =1.8×1.8×1010-10 Ag ++SCN −=AgSCN (白色),K ap =1.0×1.0×1010-12 Fe 3++ SCN −=Fe(SCN) 2+(红色),K l =138 指示剂用量大小对滴定有影响,一般控制Fe 3+浓度为0.015mol·0.015mol·LL -1为宜。
滴定时,控制氢离子浓度为0.1~1 mol·L -1,激烈摇动溶液,并加入硝基苯(有毒!)保护AgCl 沉淀,使其与溶液隔开,防止AgCl 沉淀与SCN -发生交换反应而消耗滴定剂。
3. 法扬司法用AgNO 3滴定Cl -,以荧光黄作指示剂,荧光黄先在溶液中解离(pH 为7~10):HFIn H ++FIn −FIn −在溶液中呈黄绿色。
在溶液中呈黄绿色。
在化学计量点前在化学计量点前AgCl 沉淀吸附Cl −,这时FIn −不被吸附,溶液呈黄绿色。
当滴定达到化学计量点时,稍过量的Ag +被AgCl 沉淀吸附形成AgCl AgCl ··Ag +,而AgCl ·A g Ag +强烈吸附FIn −,使其结构发生变化而呈粉红色,以此指示滴定终点。
生理盐水中氯化钠含量的测定2010/10/15一、目的要求:1、学习银量法测定氯的原理和方法;2、掌握莫尔法的实际应用二、实验原理:银量法需借助指示剂来确定终点,根据所用指示剂的不同,银量法又分为莫尔法佛尔哈德法和法扬司法。
本实验在中性溶液中以K2CrO4为指示剂,用AgNO3标准溶液来测定Cl-的含量:Ag+ + Cl-= AgCl↓(白色)Ag+ + CrO42-= Ag2CrO4 ↓(砖红色)由于AgCl的溶解度小于Ag2CrO4的溶解度,所以在滴定过程中AgCl先沉淀出来,当AgCl定量沉淀后,微过量的AgNO3溶液便与CrO42-生成砖红色Ag2CrO4沉淀,指示出滴定的终点。
本法也可用于测定有机物中氯的含量。
三、仪器与试剂:1)仪器:①酸式滴定管、移液管、容量瓶。
②锥形瓶(6个)、洗瓶。
③电子天平。
2)试剂:分析中,除非另有说明,限用分析纯试剂、蒸馏水或相同纯度的水。
①AgNO3②NaCl()③K2CrO4(w为0.05)溶液④生理盐水样品四、实验步骤1)0.1mol/L AgNO3标准溶液的配制:AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见光易分解,故若要精确测定,则要基准物(NaCl)来标定。
称取1.702g AgNO3,加适量水溶解,转移到100ml容量瓶中,用水稀释至刻度线。
2)标定:准确称取0.0585g NaCl,分别置于三个锥形瓶中,各加25ml水使其溶解。
加1ml K2CrO4溶液。
在充分摇动下,用AgNO3溶液滴定至溶液刚出现稳定的砖红色。
记录 AgNO3溶液的用量。
重复滴定二次。
计算AgNO3溶液的浓度。
表一:各物质加入质量和滴定到终点的体积瓶号 1 2 3NaCl(g)0.0585 0.0583 0.0583K2CrO4(ml) 1 1 1蒸馏水(ml)25 25 25n(NaCl)(mol)0.001 0.000997 0.000997AgNO3(滴定前 ml) 4 13.2 22.3AgNO3(滴定后 ml)12.9 22.3 31.3消耗AgNO3体积(ml)8.9 9.1 9.03)测定生理盐水中NaCl的含量:用移液管精确移取已稀释的生理食盐水25ml置于三个锥形瓶中,各加入1ml K2CrO4指示剂,用标准 AgNO3溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。
盐水中氯化钠含量的测定盐是我们日常生活不可或缺的调味品,但盐要不当使用也会对我们身体健康造成威胁。
因此,盐水中氯化钠含量的测定变得尤为重要。
本文将介绍盐水中氯化钠含量的测定方法及其指导意义。
一、测定方法1. 实验器材:分析天平、容量瓶、滴定管、滴定管架、磁力搅拌器、滴定指示剂、氯化钠样品。
2. 实验步骤:(1)称取一定质量的氯化钠样品,并将其转移到一个已知容积的容量瓶中。
使用少量的去离子水将其稀释,彻底搅拌溶解。
(2)取出一定体积的氯化钠溶液,转移到滴定瓶中。
(3)取出少量酚酞滴定指示剂,转移到滴定瓶中。
使用磁力搅拌器将其均匀混合。
(4)用0.1mol/L AgNO3标准溶液滴定氯化钠溶液,直到颜色转变为红色,即为滴定终点。
(5)重复实验三次,取平均值计算氯化钠的含量。
二、指导意义盐水中氯化钠含量的测定,对于人们正确的认识盐的用量十分重要。
有研究表明,过量摄入盐可能会导致高血压、心脏病等疾病发生。
因此,科学、合理的控制盐的摄入量变得尤为重要。
通过盐水中氯化钠含量的测定,我们可以了解我们的盐的摄入量是否超标。
同时,我们可以根据此测定结果,合理控制我们的食盐用量,从而减少健康风险。
此外,盐水中氯化钠含量的测定还对食品加工行业和制药行业具有重要意义。
食品加工企业需要测定其产品中的盐含量,制药企业需要测定药品中盐的含量,以控制产品质量,从而保障消费者的健康与安全。
综上所述,盐水中氯化钠含量的测定具有重要的科研、健康和工业意义。
对于我们每个人来说,正确使用盐、科学控制用盐量是长期健康生活的保障。
食盐中氯化钠的测定1.食盐中氯化钠的测定一、实验原理食盐是人们日常饮食中不可或缺的重要物质,其中含有不可缺少的微量元素硒和钠等,而氯化钠是食盐中占主要成份的一种。
本实验利用了盐酸银溶液作为滴定试剂,将氯化钠滴定出来,通过银氯电位表记录所得数据,从而确定了食盐中的氯化钠的含量。
二、实验准备1.准备好实验用具,包括100ml烧杯、牛皮纸、称量瓶、布滤器、真空吸管、滴定管及其他辅助性设备。
2.装备盐酸银溶液、KSCN溶液、无水乙醇和食盐等。
3.用于计量的秤子应具备分辨率为0.0001g的能力。
4.准备银氯电位表,并在表上标志出初始电位。
三、实验步骤1.用称量瓶将约50克食盐量定好,再将其倒入100ml的烧杯内,加入20ml的无水乙醇以及少量的温水捣。
2.用真空吸管将捣的食盐浆滤出,将滤出的渣放回烧杯内,搅拌均匀后通过再次滤出,以致其中的粗杂质被滤液完全吸附住。
3.把试液加入滴定管内,并在滴定管上接好100ml盐酸银溶液,再以牛皮纸封口。
4.持续观察滴定管内液位变化并记录电位,直至该滴定液位不再变化,而且滴定液位处于滴定液2ml以上位置。
5.用KSCN溶液滴定出银溶解度,并记录滴定位置,准确测量食盐中氯化钠的含量。
四、实验结果通过上面的步骤,在将食盐进行滴定的时候,观察出的结果是:起始电位为3.25V,而滴定结束的电位为1.7V,即得到了测定结果:食盐中氯化钠的含量为11.71%,在此基础上可知食盐总含盐量为94.32%。
五、安全措施1.请务必穿着实验服在实验室进行,请注意实验中避免接触有害物质,如遇到石灰粉、碱等物质请立即停止实验并进行清洗。
2.请做好防触电、防燃烧、防溅染的安全措施,避免烧伤、接触触电或玻璃器皿摔碎的危害。
3.请注意每一步的配液,记录数据,务必控制实验参数,避免误操作。
4.实验过程中任何违反安全措施的行为,均应立即纠正并给予处罚。
实训项目十六生理盐水中氯化钠的含量测定一、实验目的1. 掌握银量法测定氯的原理;2. 学会用莫尔法测定氯化钠含量的方法;3. 了解沉淀滴定法的基本操作技术。
二、实验原理银量法是指以生成难溶性银盐为基础的沉淀滴定法,根据所选的指示剂不同,银量法可分为莫尔法、弗尔哈德法和法扬斯法。
本实验选用中性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液直接滴定,测定含Cl-卤化物的含量。
滴定Cl-时,由于AgCl的溶解度小于Ag2CrO4的溶解度,首先析出AgCl白色沉淀,当Cl-被Ag+定量沉淀完全后,稍过量的Ag+与CrO42-生成砖红色沉淀,从而指示滴定终点。
滴定反应式如下:终点前:Ag+ + Cl- ⇌AgCl↓(白)终点时:Ag+ + Cr2O72-⇌Ag2CrO4↓(砖红色)实验过程中,应注意以下两点:(1)指示剂的用量莫尔法是以Ag2CrO4砖红色沉淀的出现来判断滴定终点的,如果K2CrO4的浓度过大,终点将提前出现;浓度过小,滴定终点将延后,均影响滴定的准确度。
实验证明,K2CrO4的浓度以0.005mol·L-1为宜。
(2)应控制好溶液的pH值莫尔法只适用于中性或弱碱性(pH=6.5~10.5)条件下进行,在酸性溶液中,Ag2CrO4会分解。
Ag2CrO4 + H+ ⇌2 Ag+ + HCrO4-2HCrO4-⇌Cr2O72- + H2O在碱性溶液中,Ag+会生成Ag2O沉淀。
Ag+ + HO- ⇌AgOH↓2AgOH →AgO2↓+ H2O三、仪器与试剂(1)仪器酸式滴定管、移液管、容量瓶、锥形瓶、洗瓶、电子天平。
(2)试剂AgNO3(A.R.)、NaCl(A.R.)、K2CrO4(w为5%)。
四、实验步骤1.实训内容0.1mol/L AgNO3标准溶液的配制和标定、NaCl含量的测定及结果计算。
2.实训方法AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见光易分解,故若要精确测定,则要基准物(NaCl)来标定。
盐 水
盐水中氯化钠含量测定方法的探讨
马文雁
(济宁中银电化有限公司 272121)
《氯碱盐水分析规程》1暂行规定是我厂盐水现
行质量标准,它用银量法测定其中氯化钠含量,本文
介绍用汞量法测定,并与银量法进行比较分析讨论。
1 银量法测定盐水中NaCl含量
在中性溶液中,以铬酸钾做指示剂,用硝酸银标
准溶液滴定,测定氯离子。
吸取粗盐水滤液25mL于250mL容量瓶中,加
水稀释至刻度,摇匀备用。
吸取制备液10mL于
250mL三角瓶中。
滴加1~2滴011%酚酞溶液,若
溶液显微红色,以0.1mol/L H2SO4溶液中和至微红
色消失。
再加1mL5%K2CrO4指示剂,加水至约
50mL,在充分摇动下,用0.1%AgNO3标准溶液滴
定至溶液变为稳定的淡红色悬浊液,经充分摇动后不
消失即为终点。
2 汞量法测定盐水中NaCl含量
211 实验试剂和溶液
(1)硝酸汞标准溶液:c〔1/2Hg(NO3)2〕=
0.0250mol/L
(2)溴酚蓝乙醇溶液:011%
(3)二苯卡巴腙乙醇溶液:015%
(4)硝酸溶液:2mol/L
212 氯化钠含量的分析
样品溶液呈酸性时,强电离的硝酸汞标准溶液将
氯离子转化为弱电离的氯化汞,以二苯卡巴腙与稍过
量的汞离子生成紫红色络合物判断终点。
吸取粗盐水滤液25mL于1000mL容量瓶中,加
水稀释至刻度,摇匀,备用。
吸取制备液10mL于
150mL三角瓶中,加3滴溴酚蓝,滴加2mol/L硝酸至
溶液由蓝色变为黄色,再过量1滴,加1mL二苯卡巴
腙,在充分摇动下,用0.0250mol/L硝酸汞标准溶液
滴定至溶液由黄色变为紫红色,同时做空白试验。
NaCl含量(X)按下式计算:
(X)NaCl=c×(V-V0)×0.05844
25×10/1000
×1000+
K
式中:c—硝酸汞标准溶液之物质质量浓度, mol/L
V—硝酸汞标准溶液用量,mL
V0—空白试验硝酸汞标准溶液用量,mL
0.05844—与100mL硝酸汞标准溶液{c〔Hg(NO3)2〕=1.0000m ol/L}相当的以克表示的氯化钠之质量K—氯化钠浓度的温度较正值3(见表1)。
表1 氯化钠浓度的温度校正值
测定温度
/℃K/
(g/L)测定温度
/℃K/
(g/L)测定温度
/℃K/
(g/L)测定温度
/℃K/
(g/L) 10-1.3019-0.1428+1.2237+2.66
11-1.18200.0029+1.3638+2.84
12-1.0621+0.1630+1.5039+3.02
13-0.9422+0.3231+1.6640+3.20
14-0.8223+0.4832+1.8241+3.30
15-0.7024+0.6433+1.9842+3.52
16-0.5625+0.8034+2.1443+3.68
17-0.4226+0.9435+2.3044+3.89
18-0.2827+1.0836+2.4845+4.00
本表来源《氯碱工业盐水分析规程》1暂行。
3 分析讨论
311 结果及误差计算
根据所得数据进行误差估算,其算术平均值珚X= (∑
n
i
X i)/n i,均方根偏差σ=ρ(X i-珚X)2/(n-1),n 为测定次数。
盐水中氯化钠含量测定数据处理(见表2)。
表2 盐水中氯化钠含量测定数据
方 法实测值误差平均值珚X均方根误差银
量
法
297.00
297.03
297.45
297.18
297.60
297.250.174
汞
量
法
297.15
297.14
297.21
297.30
297.17
297.190.065
从表2可以看出,汞量法比银量法有更高的精密度。
312 分析讨论
由于粗盐水中含有一定量的铵盐,要求溶液酸度
工业盐的快速分析
冯进祥
(济宁中银电化有限公司 272121)
摘 要 叙述了原盐测定方法国标G B5462-85的改进情况。
关键词 工业盐 分析 改进
氯碱工业使用工业盐量非常大,而工业盐质量的优劣直接影响到产品成本。
因此,对原盐的质量把关是非常重要的。
目前,用于原盐测定的方法是采用国标G B5462-85中规定的方法,由于该法测定所需时间较长,不能满足原盐质量把关的高频率测定。
本文着重叙述对该方法的改进,在保证准确度下使测定速度大大加快。
1 G B5462-85规定的原盐测定方法
由于氯碱工业使用大量的原盐,而原盐质量的优劣不仅会影响生产正常运行,而且会直接影响产品的成本。
因此,对原盐质量把关就很重要。
对原盐监测是把关的手段,目前的原盐测定是按G B5462-85中规定的方法进行的。
该方法主要测定氯化钠、水分、水不溶物及水溶性杂质等四项指标,其中,氯化钠含量和水不溶物两项指标更为使用厂家所重视。
氯化钠含量的测定是称取25g盐样,称准至0.001g,置于400mL烧杯中,加水200mL,加热溶解、冷却后移入500mL容量瓶中,定容、摇均。
必要时过滤,吸取25.00mL样品溶液于250mL的容量瓶中,加水稀至刻度,摇均。
然后吸取25.00mL移入150mL烧杯中,加入4滴铬酸钾溶液,在充分搅拌下用0.1mol/L 的硝酸银标准溶液滴定,直至呈现稳定的淡桔红色悬浊液为止。
通过硝酸银标液的用量计算出氯离子的含量来,再扣除水溶性杂质的影响就可算出氯化钠的含量来。
水不溶物的测定是称取10g样品,称准至0.001g,置于烧杯中,加150mL水,搅拌加热近沸至样品全部溶解,静止;用已恒重的中速定量滤纸过滤,将带有不溶物的滤纸于110±2℃烘至恒重,通过前后的质量差,计算出该盐的水不溶物含量。
在上述氯化钠含量的测定方法中有“有必要时过滤”这样一句话,那么什么是“有必要时”呢?有必要时就是对原盐直观看很脏,水不溶物较高时。
在原盐
范围较窄,p H值为615~712。
当溶液的p H值高时,便有相当数量的N H3释出,形成了Ag(N H3)+及Ag (N H3)+2,使AgCl与Ag2CrO4的溶解度增大。
又因Ag+在碱性溶液中会生成灰黑色Ag2O沉淀而影响滴定。
当溶液的p H值较低时,Ag2CrO4易溶解于酸,使滴定结果偏高。
粗盐水中的CO2-3等能与Ag+生成微溶性络合物干扰测定。
生成的AgCl沉淀能吸附Cl-,因此滴定时须剧烈振荡溶液。
在络合平衡中溶液的酸度影响络合物的稳定性。
配位体的浓度则影响络合物各级存在形式的分布。
由于Hg2+-Cl-体系的各级稳定常数分别为lg K1= 6.74、lg K2=6.48、lg K3=1.85、lg K4=1.00,可见lg K2与lg K3有较大差别。
从汞(Ⅱ)氯络合物分布曲线及珔n图中可知,当lg〔Cl-〕约为-5~-3时,HgCl2分布系数δ(HgCl2)≈100%,珔n-lg〔Cl-〕曲线中出现一明显转折,此时平均配位数珔n≈2相应于形成HgCl2络合物。
汞(Ⅱ)氯络合物分布曲线及珔n图见图1。
图1 汞(Ⅱ)氯络合物分布曲线及珔n图
盐水的密度和比容随温度变化,汞量法和银量法所测分析结果都须进行温度校正。
由以上分析可见:在测定粗盐水中氯化钠含量时,银量法误差较大,汞量法可克服。
4 结 论
银量法做为经典的氯化物分析方法广泛应用于工业分析中,但由于粗盐水中杂质离子较多,汞量法以其较强的选择性、较高的准确度和精密度而更适合粗盐水分析。
(1998-10-24收稿)。