第18章-平衡态的气体动理论-例题及练习题
- 格式:ppt
- 大小:354.00 KB
- 文档页数:14

气体动理论一、填空题1.(本题3分)某气体在温度为T = 273 K时,压强为p=1.0×10-2atm,密度ρ = 1.24×10-2 kg/m3,则该气体分子的方均根速率为____________。
(1 atm = 1.013×105 Pa)答案:495m/s2.(本题5分)某容器内分子密度为1026m-3,每个分子的质量为3×10-27kg,设其中1/6分子数以速率v=200m/s垂直向容器的一壁运动,而其余5/6分子或者离开此壁、或者平行此壁方向运动,且分子与容器壁的碰撞为完全弹性的。
则(1)每个分子作用于器壁的冲量ΔP=_____________;(2)每秒碰在器壁单位面积上的分子数n0=___________;(3)作用在器壁上的压强p=_____________;答案:1.2×10-24kgm/s×1028m-2s-14×103Pa3.(本题4分)储有氢气的容器以某速度v作定向运动,假设该容器突然停止,气体的全部定向运动动能都变为气体分子热运动的动能,此时容器中气体的温度上升0.7K,则容器作定向运动的速度v=____________m/s,容器中气体分子的平均动能增加了_____________J。
(普适气体常量R=8.31J·mol-1·K-1,波尔兹曼常k=1.38×10-23J·K-1,氢气分子可视为刚性分子。
)答案::1212.4×10-234.(本题3分)体积和压强都相同的氦气和氢气(均视为刚性分子理想气体),在某一温度T下混合,所有氢分子所具有的热运动动能在系统总热运动动能中所占的百分比为________。
答案:62.5%5.(本题4分)根据能量按自由度均分原理,设气体分子为刚性分子,分子自由度为i,则当温度为T时,(1)一个分子的平均动能为_______。

化学平衡移动的实质是浓度、温度、压强等客观因素对正、逆反应速率变化产生不同的影响,使V 正≠正≠V V 逆,原平衡状态发生移动,根据平衡移动原理分析解决问题。
解决问题。
【例题分析】【例题分析】一、平衡移动与反应速率一、平衡移动与反应速率例1、某温度下,反应N 2O 4=2NO 2-Q 在密闭容器中达到平衡,下列说法不正确的是的是A 、体积减小时将使反应速率增大、体积减小时将使反应速率增大B 、体积不变时加入少许NO 2,将使正反应速率减小,将使正反应速率减小C 、体积不变时加入少许N 2O 4,再度平衡时颜色变深,再度平衡时颜色变深D 、体积不变时升高温度,再度平衡时颜色变深、体积不变时升高温度,再度平衡时颜色变深 分析:分析:A A 、B 是结合化学反应速率变化判断而设置的选项,是结合化学反应速率变化判断而设置的选项,C C 、D 是结合化学平衡移动判断而设置的选项,速率变化与平衡移动是测试中的两个不同的侧面在分析中要加以区分。
A 、体积减小使反应物浓度及生成物浓度都增大,体积减小使反应物浓度及生成物浓度都增大,所以无论正反所以无论正反应还是逆反应速率都增大。
应还是逆反应速率都增大。
B B 、体积不变时增加NO 2的瞬间反应物的浓度不变,生成物的浓度增大,正反应速率不变,逆反应速率增大。
成物的浓度增大,正反应速率不变,逆反应速率增大。
C C 、体积不变时加入少许N 2O 4再度平衡,无论平衡如何移动各物质浓度均增大,颜色一定加深。
再度平衡,无论平衡如何移动各物质浓度均增大,颜色一定加深。
D D 、体积不变升高温度,平衡向吸热(正反应)方向移动,颜色一定加深。
答案:答案:B B 例2、右图是可逆反应A+2B=2C+3D 的化学反应速率与化学平衡随外界条件改变(先降压后加压)而变化的情况,由此可推断变(先降压后加压)而变化的情况,由此可推断 A 、正反应是放热反应、正反应是放热反应 B 、若A 、B 是气体,则D 是液体或固体是液体或固体 C 、逆反应是放热反应、逆反应是放热反应 D 、A 、B 、C 、D 均为气体均为气体分析:分析:通过降温线处通过降温线处V 正>V 逆可知化学平衡向正反应方向移动,逆可知化学平衡向正反应方向移动,进而得知正进而得知正反应方向为放热反应。

化学平衡状态和平衡移动 经典习题1.已知反应CO(g)+H 2O(g)催化剂CO 2(g)+H 2(g) ΔH <0。
在一定温度和压强下于密闭容器中,反应达到平衡。
下列叙述正确的是( )A .升高温度,K 增大B .减小压强,n (CO 2)增加C .更换高效催化剂,α(CO)增大D .充入一定量的氮气,n (H 2)不变答案 D解析 A 项,ΔH <0,正反应放热,升高温度平衡向逆反应方向移动,平衡常数减小,错误;B 项,比较方程式气体的计量数关系,反应前气体的化学计量数之和等于反应后气体的计量数之和,则减小压强,平衡不移动,n (CO 2)不变,错误;C 项,催化剂能改变反应速率,但不会引起化学平衡的移动,所以α(CO)不变,错误;D 项,充入一定量的氮气,相当于混合气体压强减小,平衡向气体体积增大的方向移动,但该反应前后气体体积不变,平衡不移动,n (H 2)不变,正确。
2.一定条件下,CH 4与H 2O(g)发生反应:CH 4(g)+H 2O(g)CO(g)+3H 2(g)。
设起始n (H 2O )n (CH 4)=Z ,在恒压下,平衡时CH 4的体积分数φ(CH 4)与Z 和T (温度)的关系如图所示。
下列说法正确的是( )A .该反应的焓变ΔH >0B .图中Z 的大小为a >3>bC .图中X 点对应的平衡混合物中n (H 2O )n (CH 4)=3 D .温度不变时,图中X 点对应的平衡在加压后φ(CH 4)减小答案 A解析 A 项,由图可知,随温度的升高,CH 4的体积分数减小,说明平衡向正反应方向移动,正反应为吸热反应,正确;B 项,Z 越大,说明n (H 2O )n (CH 4)大,相当于增加H 2O 的量,平衡正向移动,CH 4的体积分数减小,所以b >3>a ,错误;C 项,起始时n (H 2O)=3x mol ,n (CH 4)=x mol ,随平衡的建立,消耗的n (CH 4)=n (H 2O)=a mol ,平衡时n (H 2O )n (CH 4)=3x -a x -a≠3,错误;D 项,加压,平衡向逆反应方向移动,CH 4体积分数增大,错误。

内容提要一、平衡态 理想气体物态方程 1.气体的物态参量气体的体积、压强和温度三个物理量称为气体的物态参量.在国际单位制中,体积的单位是立方米,符号为3m 。
压强的单位是帕[斯卡],符号为Pa ,760m m Hg Pa 101.013 atm 15=⨯=。
热力学温度的单位是开[尔文],符号为K ,273.15T t =+。
2. 理想气体物态方程:mpV RT M=二、理想气体的压强公式 温度的微观本质 1.热动平衡的统计规律(1)分子按位置的分布是均匀的:d d N Nn V V== (2)各方向运动概率均等:0x y z ===v v v ;222213x y z ===v v v v 2.理想气体压强的微观公式:2kt 12 33p mn n ε==v3.理想气体物态方程:p nkT =4.理想气体分子的平均平动动能与温度的关系:2kt 013 22m kT ε==v 三、能量均分定理和理想气体的内能1.刚性分子自由度2.能量均分定理气体处于平衡态时,分子任何一个自由度的平均能量都相等,均为12kT ,这就是能量按自由度均分定理。
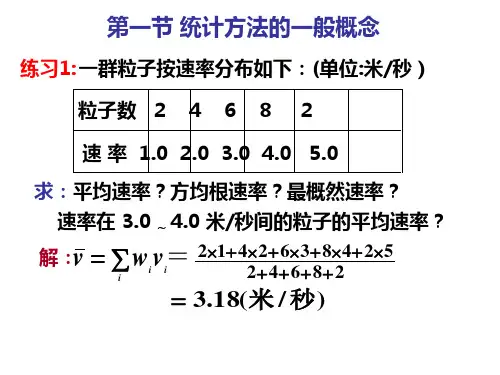
3.理想气体的内能:2m iE RT M =四、麦克斯韦气体速率分布定律 1.麦氏分布函数:1d ()d Nf N =v v物理意义:气体在温度为T的平衡状态下,速率在v附近单位速率区间的分子数占总数的百分比。
2.三种统计速率(1)最概然速率:p==v(2)平均速率:==v(3==习题精选一、选择题1.对于一定质量的理想气体,以下说法正确的是( )A、如果体积减小,气体分子在单位时间内作用于器壁单位面积的总冲量一定增大B、如果压强增大,气体分子在单位时间内作用于器壁单位面积的总冲量一定增大C、如果温度不变,气体分子在单位时间内作用于器壁单位面积的总冲量一定不变D、如果密度不变,气体分子在单位时间内作用于器壁单位面积的总冲量一定不变2.关于温度的意义,下列说法正确的是 ( )(1)气体的温度是分子平均平动动能的量度(2)气体的温度是大量气体分子热运动的集体表现,具有统计意义(3)温度的高低反映物质内部分子运动剧烈程度的不同(4)从微观上看,气体的温度表示每个气体分子的冷热程度A、(1)、(2)、(4)B、(1)、(2)、(3)C、(2)、(3)、(4)D、(1)、(2)3.如图12-1所示,一气室被可以左右移动的隔板分成相等的两部分,一边装氧气,另一边装氢气,两种气体的质量相同、温度一样。

气体动理论练习1一、选择题1. 在一密闭容器中,储有A、B、C三种理想气体,处于平衡状态。
A种气体的分子数密度为n1,它产生的压强为p1,B种气体的分子数密度为2n1,C种气体的分子数密度为3n1,则混合气体的压强p为( )A. 3p1;B. 4p1;C. 5p1;D. 6p1.2. 若理想气体的体积为V,压强为p,温度为T,一个分子的质量为m,k为玻尔兹曼常量,R为普适气体常量,则该理想气体的分子数为( )A. pVm⁄; B. pVkT⁄; C. pV RT⁄; D. pV mT⁄。
3. 一定量某理想气体按pV2=恒量的规律膨胀,则膨胀后理想气体的温度( )A. 将升高;B. 将降低;C. 不变;D. 升高还是降低,不能确定。
二、填空题1. 解释下列分子动理论与热力学名词:(1) 状态参量:;(2) 微观量:;(3) 宏观量:。
2. 在推导理想气体压强公式中,体现统计意义的两条假设是:(1) ;(2) 。
练习2一、选择题1. 一个容器内贮有1摩尔氢气和1摩尔氦气,若两种气体各自对器壁产生的压强分别为p1和p2,则两者的大小关系是( )A. p1>p2;B. p1<p2;C. p1=p2;D. 不能确定。
2. 两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数为n,单位体积内的气体分子的总平动动能为E kV⁄,单位体积内的气体质量为ρ,分别有如下关系( )A. n不同,E kV⁄不同,ρ不同;B. n不同,E kV⁄不同,ρ相同;C. n相同,E kV⁄相同,ρ不同;D. n相同,E kV⁄相同,ρ相同。
3. 有容积不同的A、B两个容器,A中装有刚体单原子分子理想气体,B中装有刚体双原子分子理想气体,若两种气体的压强相同,那么,这两种气体的单位体积的内能E A和E B的关系( )A. E A<E B;B. E A>E B;C. E A=E B;D.不能确定。

4.测验题4.1 选择题4.1.1 温度与气体动理论1 一瓶氦气和一瓶氮气质量密度相同,分子平均平动动能相同,而且它们都处于平衡态,则它们()(A)温度相同、压强相同。
(B)温度、压强都不同。
(C)温度相同,但氦气的压强大于氮气的压强。
(D)温度相同,但氦气的压强小于氮气的压强。
3 一定量的理想气体,在温度不变的情况下,当容积增大时,分子的平均碰撞次数Z和平均自由程λ的变化情况是()(A)Z减小而λ不变(B)减小而λ增大(C)Z增大而λ减小132(D)Z不变而 增大4 摩尔数相同的氦(He)和氢(H2),其压强和分子数密度相同。
则它们的()(A)分子平均速率相同;(B)分子平均动能相等;(C)内能相等;(D)平均平动动能相等。
5 在标准状态下,若氧气(视为刚性双原子分子的理想气体)和氦气的体积比V1/V2=1/2,则其E1/E2为()(A)1/2 (B)5/3 (C)5/6(D)3/106 一定量的理想气体盛于容器中,则该气体分子热运动的平均自由程仅决定于()(A)压强P(B)体积V(C)温度T(D)分子的平均碰撞频率7 在下面四种情况中,何种将一定能133134使理想气体分子平均碰撞频率增大?( )(A )增大压强,提高温度(B )增大压强,降低温度(C )降低压强,提高温度(D )降低压强,保持温度不变8 图示的曲线分别表示了氢气和氦气在同一温度下的麦克斯韦分子速率的分布情况。
由图可知,氢气分子的最可几速率为( )(A )1000m/s(B )1414m/s(C )1732m/s(D )2000m/s 9 气体分子速率分布函数为:Ndv dN v f =)(,设v p 为最概然速率,则⎰∞p v dv v f v )(2的物理意义是( )(A )表示速率处在v p →∞区间中的分子速(m/s)f (v ) 题8用图135 率平方的平均值;(B )表示速率处在v p →∞区间中的分子数;(C )表示速率处在v p →∞区间的概率;(D )表示速率处在v p →∞区间中所有的分子速率平方总和被总分子数除。


化学平衡移动周六专题一()1.在一定条件下的密闭容器中,发生反应:N2(g)+O2(g)2NO(g)△H=+180.5kJ/mol,下列说法正确的是:A.平衡后升高温度,混合气体中N2的含量降低B.当υ正(O2)=2υ逆(NO)时,反应达到化学平衡C.改变压强,平衡不移动的原因是化学反应速率不变D.1molN2(g)和1molO2(g)反应,达到平衡时吸收的热量为180.5kJ()2.在一定条件下,可逆反应:N2(g)+3H2(g)2NH3(g)△H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是:A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数()3.恒温、恒压下,amolA和bmolB在一个容积可变的容器中发生如下反应:A(g)+2B(g)2C(g),一段时间后达到平衡,生成nmolC.则下列说法中正确的是:A.物质A、B的转化率之比为a∶bB.当v正(A)=2v逆(B)时,可确定反应达到平衡C.起始时刻和达到平衡后容器中的压强比为(a+b)∶(a+b+)D.若起始时放入2amolA和2bmolB,则达到平衡时生成2nmolC()4.在一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为0),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是:A.C1:C2=3:1 B.平衡时,Y和Z的生成速率之比为2:3C.X、Y的转化率相等D.C1的取值范围为0<C1<0.24mol/L()5.体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生下列反应:2SO2(g)+O2(g)2SO3(g),并达到平衡。

《大学物理AII 》作业 平衡态的气体动理论班级 ________ 学号 ________ 姓名 _________ 成绩 _______一、判断题:(用“T ”表示正确和“F ”表示错误)[ F ] 1.温度的高低反映物质分子运动的剧烈程度,温度高说明每个气体分子运动的速率大。
解:温度是个统计概念,是大量分子热运动的集体表现。
把一个具有统计意义的概念同单个分子的运动对应起来是错误的。
[ F ] 2.若系统处于某温度不变的平衡态,各气体分子的热运动速率趋于同一值。
解:根据麦克斯韦速率分布律,平衡态时气体分子热运动速率从0-∞都有可能。
所以上述描述错误。
[ F ] 3.⎰21d )(v v v v vf ,表示在速率v 1~v 2区间内分子的平均速率。
解:21~v v 区间的分子数为 ()v v f NN v v v v d 2121~⎰=∆该区间内分子速率之和为NN v =⎰d ()v v vf v v d 21⎰,所以该区间分子的平均速率为()()()()⎰⎰⎰⎰⎰==∆→2121212121d d d d d v v v v v v v v v v vv f v v vf v v f N vv vf N N Nv [ F ] 3.若)(v f 为气体分子速率分布函数,N 为分子总数,则⎰21v v v )v (Nf d 表示在速率v 1~v 2区间内的分子出现的概率。
[ T ] 4.有两种组成成分和状态不同的理想气体,若它们的平均速率相等,则它们的最概然速率和方均根速率也相等。
解:根据三种速率的定义可以判断。
P265[ F ] 5.在气体动理论中,有时视理想气体分子为有质量而无大小的质点,有时视为有一定大小(体积)的刚性小球,这主要取决于组成气体分子结构的不同。
解:选择模型不同主要取决于所研究的问题。
二、选择题:1.对于麦克斯韦速率分布中最概然速率的正确理解,应是: [D](A) 最概然速率为分子速率分布中大部分气体分子具有的速率 (B) 最概然速率为分子速率分布中速率的最大值 (C) 最概然速率为分子速率分布函数的极大值(D) 最概然速率附近单位速率区间内的分子数最多解:“最概然”的意思是发生的可能性最大。

大学物理课后练习七气体动理论1班级: 学号: 姓名:一、选择题:1、置于容器内的气体,如果气体内各处压强相等,或气体内各处温度相同,则这两种情况下气体的状态(A )一定都是平衡态;(B )不一定都是平衡态;(C )前者一定是平衡态,后者一定不是平衡态;(D )后者一定是平衡态,前者一定不是平衡态。
( )2、处于平衡状态的A ,B ,C 三种理想气体,储存在一密闭容器中,A 种气体分子数密度为1n ,其压强为1p ,B 种气体分子数密度为12n ,C 种气体分子数密度为13n ,则混合气体压强为(A )16p ; (B )15p ; (C )13p ; (D )12p 。
( )3、下列各式中哪一式表示气体分子的平均平动动能?(式中M 为气体的质量,m 为气体分子质量,N 为气体分子总数目,n 为气体分子数密度,N 0为阿伏伽德罗常数,M mol 为摩尔质量)。
(A )32m pV M ; (B )mol 32m pV M ; (C )32npV ; (D )mol 032M N pV M。
( ) 4、一瓶氦气He 和一瓶氮气2N 密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A )温度相同,压强相同;(B )温度、压强都不相同;(C )温度相同,但氦气的压强大于氮气的压强;(D )温度相同,但氦气的压强小于氮气的压强。
( )5、若在固定容器内,理想气体分子速率都提高为原来的二倍,则(A )温度和压强都升高为原来的二倍;(B )温度升高为原来的二倍,压强升高为原来的四倍;(C )温度升高为原来的四倍,压强升高为原来的二倍;(D )温度与压强都升高为原来的四倍。
( )6、标准状态下,若氧气和氦气的体积比2/1/21=V V ,则其内能E 1 / E 2为(A )1/2; (B )5/6; (C )3/2; (D )1/3。
( )7、水蒸汽分解为同温度T 的氢气和氧气,即222H O H 0.5O →+,内能增加了多少?(A )50%; (B )25%; (C )66.7%; (D )0。
《大学物理学》气体动理论可能用到的数据:8.31/R J mol =; 231.3810/k J K -=⨯;236.0210/A N mol =⨯。
一、选择题12-1.处于平衡状态的一瓶氮气和一瓶氦气的分子数密度相同,分子的平均平动动能也相同,则它们( C )(A )温度,压强均不相同; (B )温度相同,但氦气的压强大于氮气的压强;(C )温度,压强都相同; (D )温度相同,但氦气的压强小于氮气的压强。
【分子的平均平动动能3/2kt kT ε=,仅与气体的温度有关,所以两瓶气体温度相同;又由公式P nkT =,n 为气体的分子数密度,知两瓶气体的压强也相同】2.容器中储有一定量的处于平衡状态的理想气体,温度为T ,分子质量为m ,则分子速度在x 方向的分量平均值为:(根据理想气体分子模型和统计假设讨论)( D )(A )x υB )x υC )x υ=m kT 23;(D )x υ=0。
【大量分子在做无规则的热运动,某一的分子的速度有任一可能的大小和方向,但对于大量分子在某一方向的平均值应为0】3.若理想气体的体积为V ,压强为P ,温度为T ,一个分子的质量为m ,k 为玻耳兹曼常量,R 为摩尔气体常量,则该理想气体的分子数为 ( B )(A )m PV /; (B ))/(kT PV ; (C ))/(RT PV ; (D ))/(mT PV 。
【由公式P nkT =判断,所以分子数密度为P n k T =,而气体的分子数为N nV =】 4.根据气体动理论,单原子理想气体的温度正比于( D )(A )气体的体积; (B )气体分子的压强;(C )气体分子的平均动量;(D )气体分子的平均平动动能。
【见第1题提示】5.有两个容器,一个盛氢气,另一个盛氧气,如果两种气体分子的方均根速率相等,那么由此可以得出下列结论,正确的是( A )(A )氧气的温度比氢气的高;(B )氢气的温度比氧气的高;(C )两种气体的温度相同; (D )两种气体的压强相同。
《大学物理》气体动理论练习题及答案解析一、简答题1、你能够从理想气体物态方程出发 ,得出玻意耳定律、查理定律和盖吕萨克定律吗? 答: 方程RT Mm pV '=描述了理想气体在某状态下,p ,V ,T 三个参量所满足的关系式。
对给定量气体(Mm '不变),经历一个过程后,其初态和终态之间有222111T V p T V p =的关系。
当温度不变时,有2211V p V p =,这就是玻意耳定律;当体积不变时,有2211T p T p =,这就是查理定律;当压强不变时,有2211T V T V =,这就是盖吕萨克定律。
由上可知三个定律是理想气体在经历三种特定过程时所表现出来的具体形式。
换句话说,遵从玻意耳定律、查理定律和盖吕萨克定律的气体可作为理想气体。
2、为什么说温度具有统计意义? 讲一个分子具有多少温度,行吗?答:对处于平衡态的理想气体来说,温度是表征大量分子热运动激烈程度的宏观物理量,是对大量气体分子热运动状态的一种统计平均,这一点从公式kT v m 23212=中的2v 计算中就可以看出(∑∑=iii Nv N v22),可见T 本质上是一种统计量,故说温度具有统计意义,说一个分子的T 是毫无意义的。
3、解释下列分子运动论与热力学名词:(1) 状态参量;(2) 微观量;(3) 宏观量。
答:(1)状态参量:在一定的条件下,物质系统都处于一定的状态下,每个状态都需用一组物理量来表征,这些物理量称为状态参量。
(2)微观量:描述个别分子运动状态的物理量。
(3)宏观量:表示大量分子集体特征的物理量。
4、一定量的理想气体处于热动平衡状态时,此热力学系统的不随时间变化的三个宏观量和不随时间变化的微观量分别有哪些?建议:本题“不随时间变化的微观量分别有哪些”不知道通过该设问需要学生掌握什么东西。
其实从微观角度来讲,分子的任何量,如分子速度,动能,动量,严格说来甚至质量也是变化的。
可能会有人回答为平均速度、平均速率、平均自有程等,但那又是一种统计行为,该值对应着某些宏观量,这只能称为统计量,与微观量和宏观量相区别。