选修三 2.2.4 配合物理论简介
- 格式:ppt
- 大小:320.50 KB
- 文档页数:12


第3课时配合物理论简介【学习目标导航】1.了解配位键的特点及配合物理论。
2.能说明简单配合物的成键情况。
【基础梳理】1.被称为配位键。
一方提供,一方有空轨道接受。
通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为,简称配合物。
2.Cu2++2NH3·H2O=== ;Cu(OH)2+4NH3===在[Cu(NH3)4]2+中Cu2+称为,NH3称为,4称为。
颜色是;[Fe(SCN)]2+的颜色是。
【互动探究】[思考探究]配位键实质是一种特殊的共价键,配位键的共用电子对由成键原子单方面提供,普通共价键的共用电子对则由成键原子双方共同提供,但实质是相同的。
问题思考:(1)NH+4中的配位键与其他三个N—H键的键参数是否相同?(2)配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些?(3)NH3和BF3可以通过配位键形成NH3·BF3,试分析提供孤电子对、空轨道的分别是哪种原子?你能写出NH3·BF3的结构式吗?(4)配制银氨溶液时,向AgNO3溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么?[认知升华]1.配合物的组成配合物[Cu(NH3)4]SO4的组成如下图表示。
(1)中心原子:提供空轨道能接受孤电子对的原子或金属阳离子。
配合物的中心原子一般是带正电荷的阳离子,最常见的是过渡金属的原子或离子。
(2)配体:含有孤电子对的原子、分子或阴离子。
①阴离子:如X-(卤素离子)、OH-、SCN-、CN-、RCOO-、PO3-4等。
②分子:如H2O、NH3、CO、醇、胺、醚等。
③原子:常为ⅤA、ⅥA、ⅦA族元素的原子。
(3)配位数:直接同中心原子配位的原子或离子的数目叫中心原子的配位数。
如[Fe(CN)6]4-中Fe2+的配位数为6,[Cu(NH3)4]Cl2中Cu2+的配位数为4。
(4)配合物离子的电荷数:等于中心原子或离子与配位体总电荷数的代数和。

第3课时配合物理论简介【学习目标】1.能正确叙述配位键概念及其形成条件;会分析配位化合物的形成及应用。
2.熟知几种常见的配离子:[Cu(H2O)4]2+、[Cu(NH3)4]2+、[Fe(SCN)2]+、[Ag(NH3)2]+等的颜色及性质。
【新知导学】一、配位键1.NH3、NH+4中共价键形成的比较(1)用电子式表示NH3、NH+4的形成①N原子与H原子以共价键结合成NH3分子:________________________________________________________________________;②NH3分子与H+结合成NH+4:________________________________________________________________________。
(2)②中共价键的形成与①相比较有何不同?2.由上述分析可知(1)配位键的概念是______________________________形成的共价键。
(2)配位键常用A―→B表示,其中A是___________________,B是___________________。
3.NH+4的立体构型是__________形,四个N—H键的键长________,键能________,试从原子轨道杂化的角度分析其原因:___________________________________________________________________________________________________________________。
【归纳总结】配位键的理解(1)配位键是一种特殊的共价键。
配位键中的共用电子对是由成键单方提供的,而其他的共价键的共用电子对是由成键双方提供的。
(2)配位键的形成条件①成键原子一方能提供孤电子对。
如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。

大学配合物知识点总结配合物是指由中心金属离子和一个或多个配体分子组成的化合物,它们通过共价键结合在一起。
配合物广泛存在于自然界和人类社会中,具有重要的生物学、医学、化工和化学等应用价值。
在大学化学课程中,配合物化学是一个重要的内容,学生需要掌握相关的知识点。
本文将从配合物的定义、结构、配体选择、化学性质、应用等方面对配合物的知识点进行总结。
一、配合物的定义配合物是由中心金属离子和一个或多个配体分子组成的化合物。
中心金属离子通常是过渡金属元素,如铁、铜、镍、铑等,也可以是稀土金属元素或其他金属元素。
配体是指能够与金属离子形成配位键的分子或离子,通常是具有多个孤对电子的化合物,如氨、水、羰基、氯离子等。
二、配合物的结构配合物的结构包括配体与中心金属离子之间的配位键和配位数、形成的几何构型等。
配位键是指配体分子与中心金属离子之间的共价键,通常是通过配体的孤对电子和金属离子的空轨道形成的。
配位数是指一个中心金属离子周围配位的配体分子或离子的数量,配合物的结构和性质受到配位数的影响。
几何构型是指配合物分子中配体和中心金属离子的空间排列方式,它决定了配合物的稳定性和化学性质。
三、配体选择配体的选择对于形成稳定的配合物至关重要。
常见的配体包括单原子配体和多原子配体。
单原子配体通常是一些含氮、氧、硫等元素的小分子,如氨、水、羰基等,它们能够形成较强的配位键。
多原子配体通常是含有若干原子的有机分子,如乙二胺、乙二酸等,它们能够形成多个配位键。
四、配合物的化学性质配合物具有许多独特的化学性质,包括溶解度、颜色、配位动力学和热力学性质等。
配合物通常具有较高的溶解度,尤其是在水溶液中,这是因为配合物分子中的配体能够形成氢键或其他非共价相互作用。
配合物的颜色是由于配体与中心金属离子之间的电子跃迁引起的,不同的配合物会表现出不同的颜色,因此可以通过颜色来鉴定不同的配合物。
配合物的配位动力学性质包括配体与中心金属离子的进和出,它受到配位键的强度和空间结构的影响。
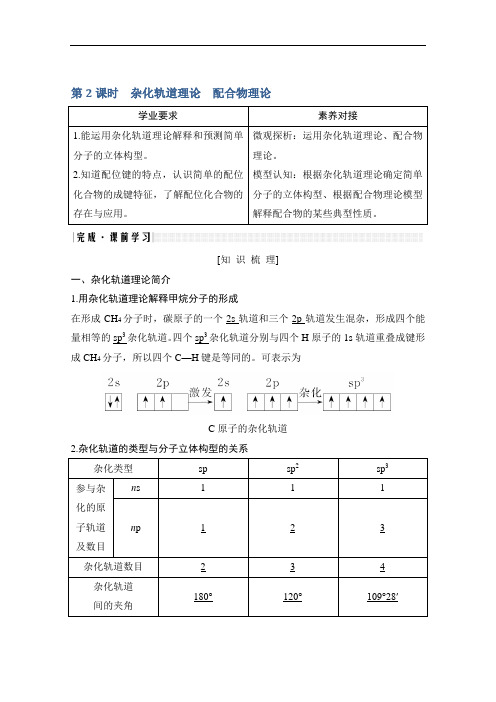
第2课时杂化轨道理论配合物理论学业要求素养对接1.能运用杂化轨道理论解释和预测简单分子的立体构型。
2.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。
微观探析:运用杂化轨道理论、配合物理论。
模型认知:根据杂化轨道理论确定简单分子的立体构型、根据配合物理论模型解释配合物的某些典型性质。
[知识梳理]一、杂化轨道理论简介1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为C原子的杂化轨道2.杂化轨道的类型与分子立体构型的关系杂化类型sp sp2sp3参与杂化的原子轨道及数目n s 1 1 1 n p 1 2 3杂化轨道数目 2 3 4 杂化轨道间的夹角180°120°109°28′杂化轨道示意图立体构型直线形平面三角形正四面体形实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4【自主思考】1.用杂化轨道理论分析CH4的杂化类型和呈正四面体形的原因?提示在形成CH4分子时,碳原子的一个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4个σ键之间作用力相等,键角相等形成正四面体形。
二、配合物理论简介1.配位键(1)概念:共用电子对由一个原子单方面提供而跟另一个原子共用的共价键,即“电子对给予-接受键”,是一类特殊的共价键。
(2)实例:在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
(3)表示:配位键可以用A→B来表示,其中A是提供孤电子对的原子,叫做配体;B是接受电子对的原子。
例如:①NH+4中的配位键表示为。



第2课时杂化轨道理论简介配合物理论简介1.了解杂化轨道理论的基本内容。
2.能根据有关理论判断简单分子或离子的立体构型。
(重点)3.了解配位键的特点及配合物理论,能说明简单配合物的成键情况。
(难点)杂化轨道理论简介1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为2.杂化轨道的类型与分子立体构型的关系杂化类型sp sp2sp3参与杂化的原子轨道及数目n s111 n p123杂化轨道数目234杂化轨道间的夹角180°120°109°28′杂化轨道示意图立体构型直线形平面三角形正四面体形实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4[思考探究]在形成多原子分子时,中心原子价电子层上的某些能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程,叫做轨道的杂化。
双原子分子中,不存在杂化过程。
例如sp杂化、sp2杂化的过程如下:问题思考:(1)观察上述杂化过程,分析原子轨道杂化后,数量和能量有什么变化?【提示】杂化轨道与参与杂化的原子轨道数目相同,但能量不同。
s轨道与p轨道的能量不同,杂化后,形成的一组杂化轨道能量相同。
(2)2s轨道与3p轨道能否形成sp2杂化轨道?【提示】不能。
只有能量相近的原子轨道才能形成杂化轨道。
2s与3p不在同一能级,能量相差较大。
(3)用杂化轨道理论解释NH3、H2O的立体构型?【提示】NH3分子中N原子的价电子排布式为2s22p3。
1个2s轨道和3个2p经杂化后形成4个sp3杂化轨道,其中3个杂化轨道中各有1个未成对电子,分别与H原子的1s轨道形成共价键,另1个杂化轨道中是成对电子,不与H原子形成共价键,sp3杂化轨道为正四面体形,但由于孤电子对的排斥作用,使3个N—H键的键角变小,成为三角锥形的立体构型。

第3课时配合物理论简介1.配位键:由一个原子(如A)单方面提供而跟另一个原子(如B)的键叫做配位键,常用符号A B表示。
配位键的成键条件是:给予体有,接受体有。
2.配位化合物:通常把(或原子)与某些(称为配位体)以键结合形成的化合物称为配位化合物。
3.配合物的组成:在配合物[Co(NH3)6]Cl3中,中心离子是,配位体是,中心离子和配位体构成了配合物的,通常把它们放在括号内,内界中配位体总数称为。
Cl-称为,内外界之间形成了键,在水中电离。
4.配合物的命名:[Zn(NH3)2]SO4内界名称为(Ⅱ),K3[Fe(CN)6]内界名称为,[Zn(NH3)4]Cl2命名为,K3[Fe(CN)6]命名为,Cu(NH3)4]SO4命名为,[Ag(NH3)2]OH命名为。
K[Pt(NH3)Cl3] 读作。
5. 向盛有硫酸铜水溶液的试管里逐渐加入氨水,先形成蓝色沉淀,继续加氨水沉淀溶解,得到深蓝色的透明溶液;离子方程式______________________________________________盛有氯化铁溶液(或任何含Fe3+的溶液)的试管中滴加1滴硫氰化钾(KSCN)溶液,实验现象是_____________离子方程式______________________________此现象可检验_______离子。
向盛有少量氯化钠水溶液的试管里滴少量硝酸银溶液,先生成白色沉淀,继续加入氨水沉淀溶解,得到无色透明的溶液。
请查阅资料,写出相关的离子方程式____________________ _______________________________________________________________________________配位化合物命名方法①命名配离子时,配位体的名称放在前,中心原子名称放在后。
②配位体和中心原子的名称之间用“合”字相连。
③中心原子为离子者,在金属离子的名称之后附加带圆括号的罗马数字,以表示离子的价态④配位数用中文数字在配位体名称之前。

第3课时配合物理论简介【学习目标】1、认识配位键,知道简单配合物的基本组成和形成条件。
2、记住常见配位化合物,了解配合物的结构与性质之间的关系;认识配合物在生产生活和科学研究方面的重要应用。
【回顾旧知】1.孤电子对:分子或离子中,的电子对。
2.共价键:。
【新知预习】共价键里还有一类特殊的叫配位键,与一般共价键的形成过程不同。
配合物理论简介一、配位键:一种特殊的共价键(1)概念:成键的两个原子一方提供,一方提供而形成的共价键。
以NH4+的形成为例说明配位键的形成:NH3分子的电子式中,N原子上有一对孤电子对,而H+的核外没有电子,1s是空轨道。
因此当NH3分子与H+靠近时,NH3分子中N 原子上的进入H+的,与H+共用。
H+与N原子间的共用电子由N原子单方面提供,不同于一般的共价键,是一种特殊的共价键,叫配位键。
(2)形成条件:其中一个原子提供。
另一原子提供空轨道。
可用电子式表示NH4+的形成过程:为了区别普通共价键与配位键,可用“→”表示配位键,箭头指向接受电子(提供空轨道)的原子,因此的结构式可表示为:从形成过程看,尽管一个N-H键与其它的三个不同,但形成NH4+后,这四个共价键的、、三个参数是完全相同的,表现的化学性质也完全相同,所以NH4+空间结构为,与CH4、CCl4相似。
〖课堂练习〗气态氯化铝(Al2Cl6)中具有配位键,分解原子间的共价键关系如图所示,将图中的配位键标上箭头。
二、配合物理论简介离子(或原子)与某些分子或离子以结合形成的化合物称为配位化合物,简称配合物,又叫络合物。
目前已知配合物的品种超过数百万,是一个庞大的化合物家族。
(1)有关配合物(配位化合物)的几个概念如:名称:硫酸四氨合铜(Ⅱ)理解要点:①配合物中的配体,提供孤电子对,可为中性分子或阴离子。
中心原子提供空轨道,可为阳离子也可为中性原子。
如Cu(H2O)42+(四水合铜离子)、Fe(H2O)62+(六水合亚铁离子)、Fe(H2O)63+(六水合铁离子)、Ni(CO)4(四羰基镍)、Fe(CO)5(五羰基铁)等。


