高中化学 选修三 配位化合物理论简介
- 格式:ppt
- 大小:984.50 KB
- 文档页数:27


配位化合物理论简介【学习目标】1、认识配位键,知道简单配合物的基本组成和形成条件。
2、记住常见配位化合物,了解配合物的结构与性质之间的关系;认识配合物在生产生活和科学研究方面的重要应用。
【回顾旧知】1.孤电子对:分子或离子中, 的电子对。
2.共价键:。
【新知预习】共价键里还有一类特殊的叫配位键,与一般共价键的形成过程不同。
四、配合物理论简介一、配位键:一种特殊的共价键1、概念:成键的两个原子一方提供,一方提供而形成的共价键。
以NH4+的形成为例说明配位键的形成:NH3分子的电子式中,N原子上有一对孤电子对,而H+的核外没有电子,1s是空轨道。
因此当NH3分子与H+靠近时,NH3分子中N原子上的进入H+的,与H+共用。
H+与N原子间的共用电子由N原子单方面提供,不同于一般的共价键,是一种特殊的共价键,叫配位键。
2、形成条件:其中一个原子提供。
另一原子提供空轨道。
可用电子式表示NH4+的形成过程: + H+为了区别普通共价键与配位键,可用“→”表示配位键,箭头指向接受电子(提供空轨道)的原子,因此的结构式可表示为:从形成过程看,尽管一个N-H键与其它的三个不同,但形成NH4+后,这四个共价键的、、三个参数是完全相同的,表现的化学性质也完全相同,所以NH4+空间结构为,与CH4、CCl4相似。
〖自学检测〗1.分析H3O+中的配位键成键情况(用电子式表示H3O+的形成过程)2.气态氯化铝(Al2Cl6)中具有配位键,分解原子间的共价键关系如图所示,将图中的配位键标上箭头。
二、配合物理论简介离子(或原子)与某些分子或离子以结合形成的化合物称为配位化合物,简称配合物,又叫络合物。
目前已知配合物的品种超过数百万,是一个庞大的化合物家族。
1、有关配合物(配位化合物)的几个概念如:[ Cu (NH3) 4 ] SO4名称:硫酸四氨合铜(Ⅱ)中心原子配体配位数内界外界理解要点:①配合物中的配体,提供孤电子对,可为中性分子或阴离子。


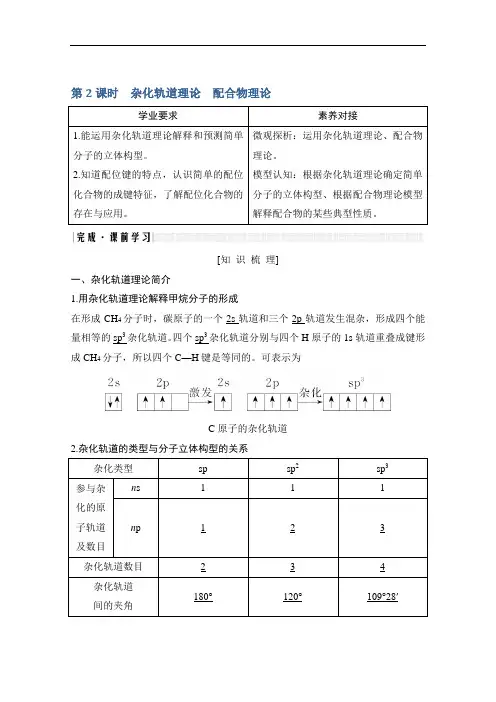
第2课时杂化轨道理论配合物理论学业要求素养对接1.能运用杂化轨道理论解释和预测简单分子的立体构型。
2.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。
微观探析:运用杂化轨道理论、配合物理论。
模型认知:根据杂化轨道理论确定简单分子的立体构型、根据配合物理论模型解释配合物的某些典型性质。
[知识梳理]一、杂化轨道理论简介1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为C原子的杂化轨道2.杂化轨道的类型与分子立体构型的关系杂化类型sp sp2sp3参与杂化的原子轨道及数目n s 1 1 1 n p 1 2 3杂化轨道数目 2 3 4 杂化轨道间的夹角180°120°109°28′杂化轨道示意图立体构型直线形平面三角形正四面体形实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4【自主思考】1.用杂化轨道理论分析CH4的杂化类型和呈正四面体形的原因?提示在形成CH4分子时,碳原子的一个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4个σ键之间作用力相等,键角相等形成正四面体形。
二、配合物理论简介1.配位键(1)概念:共用电子对由一个原子单方面提供而跟另一个原子共用的共价键,即“电子对给予-接受键”,是一类特殊的共价键。
(2)实例:在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
(3)表示:配位键可以用A→B来表示,其中A是提供孤电子对的原子,叫做配体;B是接受电子对的原子。
例如:①NH+4中的配位键表示为。

第一节配位化合物的基本概念一.知识储备1.配合物的定义1.定义由中心体(原子或离子)和配位体(阴离子或分子)以配位键的形式结合而形成的具有特定组成和形状的分子,称为配位化合物,简称配合物。
[Ag(NH3)2]Cl、[Cu(NH3)4]SO4、[Ni(CO)4]等皆为配合物,其中[Ag(NH3)2]+、[Cu(NH3)4]2+称为配离子,[Ni(CO)4]称为配分子。
2.配合物特征(1)含有配位键(中心体与配位体间以配位键相结合);(2)配离子或配分子是不可分割的整体(存在于固体或溶液中)。
2.配合物的组成[Ni(CO)4]——只有内界1.中心体(离子或原子):大多数是带正电的阳离子,也有中性原子,甚至是金属阴离子,其必备的条件是具有空轨道。
(1)多数为副族金属离子:(2)中性原子:如Ni(CO)4、Fe(CO)5等中的Ni、Fe原子。
(3)金属阴离子:如Fe(CO)42-中的Fe2-。
(4)高氧化态的金属(主族金属元素)和非金属元素的离子:如[AlF6]3-中的Al3+,[SiF6]2-中的Si(Ⅳ),PF6-中的P(Ⅴ)等。
碱金属和碱土金属的离子作为中心体的能力要比副族金属离子弱得多。
2.配位体(简称配体):含有孤对电子或π键电子对以及多个不定域电子的分子或离子。
如:阴离子X-、OH-、SCN-、CN-等和中性分子H2O、NH3、CO、醇、胺、醚等都含有至少一对孤电子,它们都可作为配体;乙烯C2H4、苯C6H6、环戊二烯C5H5等都含有π键电子对或多个不定域电子,它们也可以作为配体,称为π配体。
(1)配位原子:配体中直接同中心离子(或原子)配合的原子。
例如:NH3中的N原子、CO和CN-中的C原子等。
常见的配位原子是位于周期表中p区的非金属元素的原子——ⅣA、ⅤA、ⅥA、ⅦA,如C、N、P、O、S、F、Cl、Br、I等。
(2)配体的类型:①单齿配体:只含有一个配位原子的配体,如:NH3、H2O、X-、CO等。

配位化合物配位化合物编辑配位化合物(coordination compound)简称配合物,也叫错合物、络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
包含由中心原子或离子与几个配体分子或离子以配位键相结合而形成的复杂分子或离子,通常称为配位单元。
凡是含有配位单元的化合物都称做配位化合物。
研究配合物的化学分支称为配位化学。
配合物是化合物中较大的一个子类别,广泛应用于日常生活、工业生产及生命科学中,近些年来的发展尤其迅速。
它不仅与无机化合物、有机金属化合物相关连,并且与现今化学前沿的原子簇化学、配位催化及分子生物学都有很大的重叠。
目录1术语2历史3基本组成4命名方法5命名规则6价键介绍7基本分类8主要性质9基本结构构型异构现象立体异构几何异构光学异构结构异构10理论11反应配体交换反应氧化还原反应12应用1术语编辑讨论经典配位化合物时,常会提到以下的术语:配位键、配位共价键:配位化合物中存在的化学键,由一个原子提供成键的两个电子,成为电子给予体,另一个成键原子则成为电子接受体。
参见酸碱反应和路易斯酸碱理论。
配位单元:化合物含有配位键的一部分,可以是分子或离子。
配离子:含有配位键的离子,可以是阳离子或阴离子。
内界、外界:内界指配位单元,外界与内界相对。
配体、配位体、配位基:提供电子对的分子或离子。
配位原子:配体中,提供电子对的原子。
中心原子、金属原子:一般指接受电子对的原子。
配位数:中心原子周围的配位原子个数。
螯合物:含有螯合配体的配合物。
此外,含有多个中心原子的配合物称为多核配合物,连接两个中心原子的配体称为桥联配体,以羟基桥联的称为羟联,以氧基桥联的称为氧联。
2历史编辑人们很早就开始接触配位化合物,当时大多用作日常生活用途,原料也基本上是由天然取得的,比如杀菌剂胆矾和用作染料的普鲁士蓝。
最早对配合物的研究开始于1798年。

有机化学基础知识点配位化合物的结构和性质配位化合物是有机化学中一个重要的研究领域,它形成于配位键的形成和金属离子的配位,具有独特的结构和性质。
既然我们谈到了有机化学基础知识点,让我们来深入了解一下配位化合物的结构和性质。
一、配位化合物结构的基本特点配位化合物通常由一个中心金属离子和一些称为配体的分子或离子组成。
配体通常是有机化合物,具有不同的配位原子,如氮、氧、硫等。
它们通过配位键与中心金属离子结合。
1. 配位键的形成配位键是指配体的一个或多个配位原子与中心金属离子之间的共有电子对。
配位键的形成通常是由配位原子上的孤对电子(孤对电子是未参与共价键形成的电子对)与金属离子形成的。
例如,以水合铜离子Cu(H2O)6^2+为例,氧原子上的孤对电子直接与铜离子形成了配位键。
2. 配位数与配位体配位数是指配位原子或配体与中心金属离子之间的配位键数量。
根据配位数的不同,配位体可以分为双齿配体、三齿配体、四齿配体等。
例如,以乙二胺(NH2CH2CH2NH2)为配体的四氯合铜(II)配合物[CuCl2(NH2CH2CH2NH2)2]的配位数是六。
3. 配位化合物的空间构型配位化合物的空间构型由配位体的取向和排布所决定。
常见的空间构型有正方形平面型、八面体型等。
这些不同的空间构型会影响到化合物的性质和反应性。
二、配位化合物的性质配位化合物由于金属离子与配体之间的配位键的形成,使其具有一些独特的性质。
1. 形成稳定的络合化合物由于配位键的形成,配位化合物通常具有较高的稳定性。
这使得它们在催化、溶剂选择性和聚合物合成等方面具有广泛的应用。
2. 形成具有特定功能的配位聚合物配位化合物的结构可以通过合适的选择和设计配体,形成具有特定功能的配位聚合物。
这些聚合物在催化、传感、光电子等领域中有广泛的应用。
3. 光谱性质配位化合物常常具有丰富的光谱性质,如紫外可见吸收光谱、红外光谱、荧光光谱等。
这些光谱性质对于研究配位化合物的结构和反应机制具有重要意义。

高中化学配位化学知识点归纳总结配位化学是化学中一个重要的分支领域,主要研究金属与配体之间的相互作用、配合物的结构、性质和反应机理等内容。
在高中化学课程中,学生通常会接触到与配位化学相关的一些基本概念和理论。
本文将对高中化学配位化学的知识点进行归纳总结,以便学生们更好地理解和应用此部分内容。
一、配位键和配位数配位键是指金属离子与配体之间形成的键。
在配位化合物中,金属离子与配体通过共价键或者均衡键形成配位键。
金属离子和配体之间的配位键数量被称为配位数,常用符号为CN。
常见的配位数有2,4,6等。
二、配体配体是指能够与金属离子形成配位键的小分子或者离子。
配体通常通过给出一对电子与金属离子形成配位键,其中配位键电子对可以是成键电子对、孤立电子对或者共享电子对。
常见的配体包括水分子(H2O)、氨分子(NH3)、硝酸根离子(NO3-)等。
在配合物中,一个或者多个配体与金属离子形成配位键,形成了配合物的结构。
三、配合物的结构配合物的结构受到金属离子和配体之间配位键的类型和数目的影响。
常见的配合物结构有以下几种:1. 线性结构:当金属离子的配位数为2时,配合物的结构呈线性结构。
2. 正方形平面结构:当金属离子的配位数为4时,配合物的结构呈正方形平面结构。
3. 八面体结构:当金属离子的配位数为6时,配合物的结构呈八面体结构。
4. 五边形平面结构:当金属离子的配位数为5时,配合物的结构呈五边形平面结构。
四、配位反应配位反应是指配合物中金属离子与配体之间发生的化学反应。
常见的配位反应有配体置换反应和配合物的还原氧化反应。
在配体置换反应中,一个配体离开配合物,而另一个新的配体进入配合物。
此类反应常用于合成新的配合物或者改变已有配合物的性质。
在配合物的还原氧化反应中,金属离子的氧化态或还原态发生变化,配位键和配位数也可能发生改变。
此类反应常见于电化学反应或催化反应中。
五、配位化学的应用配位化学在生物学、药物学、环境科学等领域具有广泛的应用。