最新红外测试峰值对照图
- 格式:doc
- 大小:92.50 KB
- 文档页数:6

红外各基团特征峰对照表在化学和材料科学领域,红外光谱分析是一种非常重要的研究手段。
通过对物质在红外区域的吸收光谱进行分析,可以获取有关分子结构和化学键的信息。
而红外各基团特征峰对照表则是解读红外光谱的关键工具。
红外光谱的原理基于分子对红外光的吸收。
当红外光照射到分子时,分子中的化学键会以特定的频率振动。
如果红外光的频率与化学键的振动频率匹配,就会发生吸收,从而在光谱上产生特征峰。
不同的基团具有不同的化学键和结构,因此会在特定的波数位置产生特征吸收峰。
下面我们来详细了解一些常见基团的特征峰。
首先是羟基(OH)基团。
在红外光谱中,自由羟基(未形成氢键)的伸缩振动通常出现在 3650 3600 cm⁻¹范围内。
而形成氢键的羟基伸缩振动则会向低波数方向移动,一般在 3550 3200 cm⁻¹之间。
羰基(C=O)基团也是常见且重要的。
酮类中的羰基伸缩振动一般在 1715 cm⁻¹左右,醛类中的羰基伸缩振动则稍高,大约在 1730cm⁻¹。
羧酸中的羰基由于与羟基形成氢键,其伸缩振动出现在 1700 1680 cm⁻¹。
酯类中的羰基伸缩振动通常在 1735 1725 cm⁻¹。
氨基(NH₂)基团的特征峰也有其特点。
伯胺中氨基的伸缩振动在3500 3300 cm⁻¹,有两个吸收峰;仲胺中的氨基伸缩振动则只有一个吸收峰,位于 3400 3300 cm⁻¹。
碳碳双键(C=C)的伸缩振动通常在 1680 1620 cm⁻¹。
而碳碳三键(C≡C)的伸缩振动则出现在 2260 2100 cm⁻¹。
苯环的特征吸收峰比较复杂。
苯环的骨架振动在1600 1585 cm⁻¹、1500 1450 cm⁻¹有多个吸收峰。
烷烃中的 CH 伸缩振动在 2960 2850 cm⁻¹,弯曲振动在 1470 1375 cm⁻¹。

主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~11403.33~3.523.37~3.473.49~3.526.71~7.418.00~8.77中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~9653.23~3.335.90~6.137.00~7.759.90~15.410.05~10.1510.99~11.0513.70~15.3810.20~10.36中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~3.034.41~4.767.94~8.0315.50~16.25中中强四、取代苯类CH伸泛频峰骨架振动(CC)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~6653.23~3.335.00~6.006.25±0.086.67±0.106.33±0.046.90±0.108.00~10.0010.99~15.03变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~86012.99~13.7012.99~13.7012.35~13.3311.12~11.6311.63~12.5012.35~13.3311.44~11.9811.30~11.6311.63~12.5011.63~12.5011.63~12.5011.56~12.35~11.63极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)C—O伸O—H弯(面外)3700~32001410~12601260~1000750~6502.70~3.137.09~7.937.94~10.0013.33~15.38变弱强强液态有此峰OH伸缩频率游离OH分子间氢键分子内氢键OH弯或C—O伸伯醇(饱和)仲醇(饱和)叔醇(饱和)酚类(ФOH)OH伸OH伸OH伸(单桥)OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)Ф—O伸3650~35903500~33003570~3450~14001250~1000~14001125~1000~14001210~11001390~13301260~11802.74~2.792.86~3.032.80~2.90~7.148.00~10.00~7.148.89~10.00~7.148.26~9.097.20~7.527.94~8.47强强强强强强强强强中强锐峰钝峰(稀释向低频移动*)钝峰(稀释无影响)六、醚类C—O—C伸1270~1010 7.87~9.90 强或标C—O伸脂链醚脂环醚芳醚(氧与芳环相连)C—O—C伸C—O—C伸(反称)C—O—C伸(对称)=C—O—C伸(反称)=C—O—C伸(对称)CH伸1225~10601100~1030980~9001270~12301050~1000~28258.16~9.439.09~9.7110.20~11.117.87~8.139.52~10.00~3.53强强强强中弱氧与侧链碳相连的芳醚同脂醚O—CH3的特征峰七、醛类(—CHO)CH伸C=O伸CH弯(面外)2850~27101755~1665975~7803.51~3.695.70~6.0010.2~12.80弱很强中一般~2820及~2720cm-1两个带饱和脂肪醛α,β-不饱和醛芳醛C=O伸C=O伸C=O伸~1725~1685~1695~5.80~5.93~5.90强强强八、酮类OC C=O伸C—C伸泛频1700~16301250~10303510~33905.78~6.138.00~9.702.85~2.95极强弱很弱脂酮饱和链状酮α,β-不饱和酮β二酮芳酮类Ar—CO C=O伸C=O伸C=O伸C=O伸C=O伸1725~17051690~16751640~15401700~16301690~16805.80~5.865.92~5.976.10~6.495.88~6.145.92~5.95强强强强强C=O与C=C共轭向低频移动谱带较宽二芳基酮1-酮基-2-羟基(或氨基)芳酮脂环酮四环元酮五元环酮六元、七元环酮C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1670~1660 1665~1635~1775 1750~1740 1745~1725 5.99~6.02 6.01~6.12~5.63 5.71~5.75 5.73~5.80 强强强强强九、羧酸类(—COOH )OH 伸C =O 伸OH 弯(面内)C —O 伸OH 弯(面外)3400~2500 1740~1650 ~1430 ~1300 950~9002.94~4.00 5.75~6.06 ~6.99 ~7.69 10.53~11.11中强弱中弱在稀溶液中,单体酸为锐峰在~3350cm -1;二聚体为宽峰,以~3000cm -1为中心脂肪酸R —COOH α,β-不饱和酸芳酸C =O 伸C =O 伸C =O 伸1725~1700 1705~1690 1700~16505.80~5.88 5.87~5.91 5.88~6.06强强强氢键十、酸酐链酸酐C =O 伸(反称)C =O 伸(对称)C —O 伸1850~1800 1780~1740 1170~1050 5.41~5.56 5.62~5.75 8.55~9.52 强强强共轭时每个谱带降20 cm-1环酸酐(五元环)C =O 伸(反称)C =O 伸(对称)C —O 伸1870~1820 1800~1750 1300~1200 5.35~5.49 5.56~5.71 7.69~8.33 强强强共轭时每个谱带降20cm-1十一、酯类C OR OC =O 伸(泛频)C =O 伸C —O —C 伸~3450 1770~1720 1280—1100~2.90 5.65~5.81 7.81~9.09弱强强多数酯C =O 伸缩振动正常饱和酯α,β-不饱和酯δ-内酯γ-内酯(饱和)β-内酯C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1744~1739 ~1720 1750~1735 1780~1760 ~1820 5.73~5.75 ~5.81 5.71~5.76 5.62~5.68 ~5.50 强强强强强十二、胺NH 伸NH 弯(面内)C —N 伸NH 弯(面外)3500~3300 1650~1550 1340~1020 900~650 2.86~3.03 6.06~6.45 7.46~9.80 11.1~15.4 中中强伯胺强,中;仲胺极弱伯胺类仲胺类叔胺类NH 伸(反称、对称)NH 弯(面内)C —N 伸NH 伸NH 弯(面内)C —N 伸C —N 伸(芳香)3500~3400 1650~1590 1340~1020 3500—3300 1650—1550 1350—1020 1360~10202.86~2.94 6.06~6.29 7.46~9.80 2.86—3.03 6.06—6.45 7.41—9.80 7.35~9.80中、中强、中中、弱中极弱中、弱中、弱双峰一个峰十三、酰胺(脂肪与芳香酰胺数据类似)NH伸C=O伸NH弯(面内)C—N伸3500~31001680~16301640~15501420~14002.86~3.225.95~6.136.10~6.457.04~7.14强强强中伯酰胺双峰仲酰胺单峰谱带Ⅰ谱带Ⅱ谱带Ⅲ伯酰胺仲酰胺叔酰胺NH伸(反称)(对称)C=O伸NH弯(剪式)C—N伸NH2面内摇NH2面外摇NH伸C=O伸NH弯+C—N伸C—N伸+NH弯C=O伸~3350~31801680~16501650~16201420~1400~1150750~600~32701680~16301570~15151310~12001670~1630~2.98~3.145.95~6.066.06~6.157.04~7.14~8.701.33~1.67~3.095.95~6.136.37~6.607.63~8.335.99~6.13强强强强中弱中强强中中两峰重合两峰重合十四、氰类化合物脂肪族氰α、β芳香氰α、β不饱和氰C≡N伸C≡N伸C≡N伸2260~22402240~22202235~22154.43~4.464.46~4.514.47~4.52强强强十五、硝基化合物R—NO2 Ar—NO2NO2伸(反称)NO2伸(对称)NO2伸(反称)NO2伸(对称)1590~15301390~13501530~15101350~13306.29~6.547.19~7.416.54~6.627.41~7.52强强强强波波配体和16Mn:通过比较配体与配合物的红外光谱图(附录图1.3)发现配体在1626.5 cm-1、1624.1 cm-1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中3260.8 cm-1、3042 cm-1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm-1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,1580.1 cm-1处的吸收峰归属为丁烯中C=C的特征吸收峰,1487.3 cm-1处的吸收峰为–C=N–N=C–基团产生[16-17]。
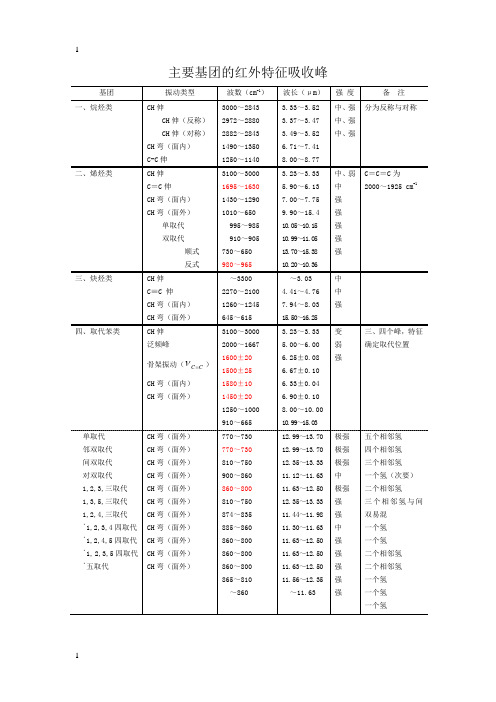
主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~11403.33~3.523.37~3.473.49~3.526.71~7.418.00~8.77中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~9653.23~3.335.90~6.137.00~7.759.90~15.410.05~10.1510.99~11.0513.70~15.3810.20~10.36中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~3.034.41~4.767.94~8.0315.50~16.25中中强四、取代苯类CH伸泛频峰骨架振动(CC=ν)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~6653.23~3.335.00~6.006.25±0.086.67±0.106.33±0.046.90±0.108.00~10.0010.99~15.03变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~86012.99~13.7012.99~13.7012.35~13.3311.12~11.6311.63~12.5012.35~13.3311.44~11.9811.30~11.6311.63~12.5011.63~12.5011.63~12.5011.56~12.35~11.63极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢波波配体和16M n:通过比较配体与配合物的红外光谱图(附录图1.3)发现配体在1626.5 cm−1、1624.1 cm−1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中3260.8 cm−1、3042 cm−1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm−1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,1580.1 cm−1处的吸收峰归属为丁烯中C=C的特征吸收峰,1487.3 cm−1处的吸收峰为–C=N–N=C–基团产生[16-17]。

.红外各基团特征峰对照表一、红外吸收光谱中的重要区段:1) O-H 、N-H 伸缩振动区 (3750~3000 cm -1 )2) 不饱和碳上的 C-H 伸缩振动区 (3300~3000 cm -1 )不饱和碳 (三键和双键、苯环 )上的 C-H 的伸缩振动在 3300~3000 cm-1 区域中出现不同的吸收峰。
3) C-H 伸缩振动区 (3000~2700 cm -1 )饱和碳上的 C-H 伸缩振动 (包括醛基上的 C-H)4) 叁键和累积双键区 (2400~2100 cm -1 )波数在 2400~2100 cm-1 区域内的谱带较少。
5) 羰基的伸缩振动区 (1900~1650 cm -1 )羰基的吸收最常见出现的区域为1755~1670 cm -1 。
由于羰基的电偶极矩较大,一般吸收都很强烈,常成为IR 光谱中的第一强峰。
6) 双键伸缩振动区 (1690~1500 cm -1 )该区主要包括 C=C ,C=N ,N=N , N=O 等的伸缩振动以及苯环的骨架振C=C动 ( σ )。
7) X-H 面内弯曲振动及 X-Y 伸缩振动区 (1475~1000 cm -1 )这个区域主要包括 C-H 面内弯曲振动 , C-O 、 C-X( 卤素 )等伸缩振动 , 以及C-C 单键骨架振动等。
该区域是指纹区的一部分。
8)C-H 面外弯曲振动区( 1000~650 cm -1)烯烃、芳烃的 C-H 面外弯曲振动(σC-H )在 1000~650cm -1区。
苯环邻二取代: 770~735cm-1 ;苯环间二取代:710~690、810~750cm-1;苯环对二.取代: 830~810cm-1具体对照表如下所示:(其中: VS:很强; W :弱; S:强; VW :很弱; m :中等; w :宽)1、O-H 、N-H 伸缩振动区( 3750 — 3000 cm-1 )基团类型ν波数 /cm -1 峰的强度νO-H 3700~320 VS游离νO-H 0 VS,尖锐吸收带分子间氢键3700~3500 VS,尖锐吸收带二分子缔合S,宽吸收带多分子缔合3550~345 VS,宽吸收带羧基υO-H0 VS,尖锐吸收带分子内氢键3500~320νN-H W ,尖锐吸收带W ,尖锐吸收带游离3500~250缔合可变酰胺3570~3453500~330.3500~3103500~3302、C-H 伸缩振动区( 3300 — 3000 cm -1)基团类型ν波数 /cm -1 峰的强度- C≡C-H ~3300 VS-C=C-H 3100~3000 MAr-H 3050~3010 M3、C-H 伸缩振动区( 3000 — 2700 cm -1)基团类型ν波数 /cm -1 峰的强度-CH 3 2960 及 2870 VS-CH 2 - 2930 及 2850 VS≡C-H 2890 W-CHO 2720 W4、叁键和累积双键区( 2400 — 2100 cm -1)基团类型ν波数/cm-1峰的强度可编辑.R-C≡C-H 2140~2100 m`RC≡ CR2260~2190 可变RC≡ CR 无吸收SR- C≡N2260~2120SR-N=N=N 2160~2120SR-N=C=N-R 2155~2130S-C=C=C- ~1950-C=C=O ~2150-C=C=N ~2000 SO=C=O ~2349R-N=C=O2275~22505、羰基的伸缩振动区( 1900 — 1650 cm -1)基团类型ν波数/cm-1峰的强度可编辑饱和脂肪醛1740~1720 S α ,-β不饱和脂肪醛1705~1680 S芳香醛1715~1690 S饱和脂肪酮1725~1705 S α ,-β不饱和脂肪酮1685~1665 Sα- 卤代酮1745~1725 S芳香酮1700~1680 S 脂环酮 (四员环 ) 1800~1750 S(五员环 ) 1780~1700 S(六员环 ) 1760~1680 S酯 (非环状 ) 1740~1710 S 六及七员环内酯1750~1730 S五员环内酯1780~1750 S酰卤1815~1720 S酸酐1850~1800 S酰胺1780~17401700~1680 (游离)1660~1640 (缔合)6、双键伸缩振动区( 1690 — 1500 cm -1)基团类型ν波数/cm-1峰的强度-C=C- 1680~1620 不定苯环骨架1620~1450不定-C=N 1690~1640不定-N=N= 1630~1575S-NO 2 1615~1510S1390~13207、X-H 面内弯曲振动及X-Y 伸缩振动区( 1475 — 1000 cm -1)键的振动类型波数 /cm -1峰的强度烷基δas 1460δs1380 双峰强度约相等 (1:1) -CH 31385 及 1375 峰强度比 1:2双峰-C(CH 3)21395 及 1365 双峰S -C(CH 3)31200~1000 S 醇νC-O1065~1015 S伯醇1100~1010 1150~1100 S仲醇1300~1200 S叔醇1220 ~1130 S 酚νC-O1275~1060 S 醚νC-O1150~1060 S 脂肪醚1275~1210 S 芳香醚1225~1200 S 乙烯醚1300~1050 S酯1360~1020 S 胺νC-N8、C-H 面外弯曲振动区( 1000 — 650 cm -1)基团类型ν波数 /cm -1 峰的强度(σC-H )1000~650 不定苯环邻二取代770~735不定苯环间二取代710~690 、苯环对二取代810~750cm-830~810不定二、指纹区和官能团区从第 1-6 区的吸收都有一个共同点,每一红外吸收峰都和一定的官能团相对应,此区域从而称为官能团区。

红外测试峰值对照图 WEIHUA system office room 【WEIHUA 16H-WEIHUA WEIHUA8Q8-主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~1140~~~~~中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~965~~~~~~~~中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~~~~中中强四、取代苯类CH伸泛频峰骨架振动(CC=ν)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~665~~±±±±~~变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~860~~~~~~~~~~~~~极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)C—O伸O—H弯(面外)3700~32001410~12601260~1000750~650~~~~变弱强强液态有此峰波波配体和16M n:通过比较配体与配合物的红外光谱图(附录图发现配体在cm1、cm?1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中cm?1、3042 cm1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm?1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,cm1处的吸收峰归属为丁烯中C=C的特征吸收峰, cm1处的吸收峰为–C=N–N=C–基团产生[16-17]。

红外光谱特征峰对照表
以下是一些常见的有机分子在红外光谱中的特征峰,用于参考:烷基C-H 伸缩振动:约2920-2850 cm^-1
烷基C-H 弯曲振动:约1470 cm^-1
芳香环C-H 伸缩振动:约3050-3000 cm^-1
羧基C=O 伸缩振动:约1725 cm^-1
酯基C=O 伸缩振动:约1750-1735 cm^-1
醛基C=O 伸缩振动:约1740-1720 cm^-1
羟基O-H 伸缩振动:约3600-3200 cm^-1(宽而弱)
胺基N-H 伸缩振动:约3500-3200 cm^-1
烷基C-C 伸缩振动:约1480-1420 cm^-1
芳香环C=C 伸缩振动:约1600-1580 cm^-1
卤代烃C-X 伸缩振动(X=Cl, Br, I):约800-600 cm^-1
需要注意的是,这些特征峰的位置和强度可能受到其他因素的影响,如分子中其它官能团的存在、分子的构象等。
因此,特征峰的确切位置可能会有所偏移,只能作为参考。
主要基团的红外特征吸收峰反式985 910~905 730~650 980~965三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~~~~中中强四、取代苯类CH伸泛频峰骨架振动(CC=ν)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000~~±±±±~~变弱强三、四个峰,特征确定取代位置910~665单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~860~~~~~~~~~~~~~极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)3700~3200~~变弱液态有此峰波波配体和16Mn:通过比较配体与配合物的红外光谱图(附录图发现配体在 cm1、 cm?1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中 cm1、3042 cm?1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm1处的吸收峰归属为酚羟基ν(O–H)伸缩振动, cm?1处的吸收峰归属为丁烯中C=C的特征吸收峰, cm1处的吸收峰为–C=N–N=C–基团产生[16-17]。
红外各基团特征峰对照表一、红外吸收光谱中的重要区段:-1)(3750〜3000 cm 1) O-H>N-H 伸缩振动区“)(3300〜3000 cm 2)不饱和碳上的C-H 伸缩振动区不饱和碳(三键和双键、苯环)上的C-H的伸缩振动在3300〜3000 cm-1 区域中出现不同的吸收峰。
-1)(3000〜2700 cm 3) C-H伸缩振动区饱和碳上的C-H伸缩振动(包括醛基上的C-H)-1)(2400〜2100 cm4)卷键和累积双键区波数在2400〜2100 cm-1区域内的谱带较少。
-1)(1900^1650 cm 5)按基的伸缩振动区心山于按基的电偶极矩较1755〜1670 cm 拨基的吸收最常见出现的区域为大,一般吸收都很强烈,常成为IR光谱中的笫—强峰。
-1) 6)双键伸缩振动区(1690〜1500 cm该区主要包括C=C, C=N, N=N, N=O等的伸缩振动以及苯环的骨架振动(o )。
c=c-i)伸缩振动区(1475〜1000 CH1X-Y7) X-H面内弯曲振动及这个区域主要包括C-H面内弯曲振动,C-O、C-X(卤素)等伸缩振动,以及C-C单键骨架振动等。
该区域是指纹区的一部分。
-11000〜650 cm面外弯曲振动区(C-H8))」区。
苯环邻二取)在1000〜650 emo C-H烯桂、芳炷的C・H面外弯曲振动(•□;苯环对二取代:、770〜735cm810〜750cm;苯环间二取代:710〜690代:-i 830〜810cm 具体对照表如下所示:(其中:VS:很强;W:弱;S:强;VW:很弱;m:中等;w:宽)-峰的强波基团类V3700〜320o・V,尖锐吸收3700〜350游。
・分子间氢V,尖锐吸收3550〜345二分子缔3500〜320,宽吸收多分子缔V3500〜250,宽吸收竣。
23570〜345,尖锐吸收分子内氢N-,尖锐吸收3500〜3300游离W,尖锐吸收带3500〜3100缔合3500〜3300可变酰胺-13300—3000 cm 伸缩振动区(2、C-H)-1峰的强度波数/cm基团类型vVS 〜3300-C三C・HM・C=C・H 3100〜3000M3050〜3010Ar-H-13000—2700 cmC-H 伸缩振动区(3、)"基团类型v波数/cin峰的强度VS-CH 2960 及28703VS -CH 及2850 - 293(hW2890 =C-HW -CHO 2720-12400—2100 CHK卷键和累积双键区(4)」基团类型波数/cm v峰的强度mR-C=C-H2140-2100 RC三CR 2260〜2190可变RC=CR无吸收S R-C±N2260〜2120SR-N=N=N 2160-2120SR-N=C=N-R2155 〜2130S-C=C=C-〜1950-C=C=O〜2150〜2000-C=C=N0=00 〜2349R-N=C=O 2275〜2250S-11900—1650 cm>拨基的伸缩振动区(5)-i峰的强度/cm波数基团类型vS 1740〜1720饱和脂肪醛Sa ,P-不饱和脂肪醛1705〜1680S 1715〜1690芳香醛S 1725〜1705饱和脂肪酮S1685〜1665不饱和脂肪酮a , P- S 1745〜1725 a -卤代酮S1700-1680 芳香酮S 1800〜1750 )(脂环酮四员环S(五员环)1780〜1700S1760〜1680 (六员环)S1740〜1710 )酯(非环状S 1750〜1730六及七员环内酯S 1780〜1750五员环内酯S1815〜1720 酰卤S1850〜1800 1780〜1740 酸酊(游离)1700〜1680 酰胺1660〜1640 (缔合)-11690—1500 cm>双键伸缩振动区(6)1680〜1620-C=C・不定1620〜1450苯环骨架1690〜1640 -C=N 不定1630〜1575 -N=N=不定-N1615 〜1511390〜1320.1波数峰的强度/cmv基团类型1000〜650 )(不定OC-H770〜735 苯环邻二取代-810〜750cm、710〜690不定苯环间二取代830〜810 不定苯环对二取代二、指纹区和官能团区从第1・6区的吸收都有一个共同点,每一红外吸收峰都和一定的官能团相对应, 此区域从而称为官能团区。
红外峰值对照表红外峰值对照表一、背景介绍近年来,红外光谱分析技术在许多领域得到了广泛应用,为科学家们研究物质的性质和结构提供了重要的参考依据。
在红外光谱中,峰值是指特定波数的吸收或发射峰出现的位置,对于解读红外光谱数据具有重要意义。
为了方便科研工作者对红外光谱数据的分析和解读,特编制了一份红外峰值对照表,供大家参考使用。
二、红外峰值对照表(以下列举部分常见的红外峰值,具体波数可根据需求进行调整)1. 3300-3500 cm-1-O-H(醇、酚)、N-H(胺)2. 3000-3300 cm-1-C-H(烷烃)3. 1760-1820 cm-1C=O(酮、醛)4. 1710-1750 cm-1C=O(羧酸)5. 1600-1640 cm-1C=C(烯烃)6. 1450 cm-1CH2(脂肪族)7. 1150 cm-1C-O(醚、醇)8. 900-1200 cm-1C-H(芳香族)9. 700-900 cm-1C-Cl(氯代烷烃)10. 650 cm-1C-S(硫代烷烃)以上为常见的红外峰值示例,这些峰值对于不同化学物质和功能基团具有一定的特异性,因此在红外光谱分析中扮演着重要角色。
科研人员在实验过程中,通过观察红外光谱图谱中的峰值分布情况,可以推断样品的组成和结构,进一步进行定性和定量分析。
三、红外峰值分析的意义与应用1. 结构确定:根据红外峰值对化合物和功能基团进行鉴定和定性分析,可确定化合物的结构和组成。
2. 反应监测:红外光谱法可用来监测反应过程中化合物的结构变化和官能团的转化,有助于反应机理的研究与探索。
3. 药物分析:红外光谱可用于药物的鉴定、质量控制和药效评价,为药物开发和生产提供重要依据。
4. 环境污染监测:通过红外光谱分析,可以检测和鉴定环境中的有机物质,有助于了解污染源及其成因,为环境保护提供科学依据。
五、总结与展望红外峰值对照表作为一种常用的工具,在红外光谱分析中具有重要的应用价值。
主要基团的红外特征吸收峰
基团振动类型波数(cm-1)波长(μm)强度备注
一、烷烃类CH伸
CH伸(反称)
CH伸(对称)
CH弯(面内)
C-C伸3000~2843
2972~2880
2882~2843
1490~1350
1250~1140
3.33~3.52
3.37~3.47
3.49~3.52
6.71~
7.41
8.00~8.77
中、强
中、强
中、强
分为反称与对称
二、烯烃类CH伸
C=C伸
CH弯(面内)
CH弯(面外)
单取代
双取代
顺式
反式3100~3000
1695~1630
1430~1290
1010~650
995~985
910~905
730~650
980~965
3.23~3.33
5.90~
6.13
7.00~7.75
9.90~15.4
10.05~10.15
10.99~11.05
13.70~15.38
10.20~10.36
中、弱
中
强
强
强
强
强
C=C=C为
2000~1925 cm-1
三、炔烃类CH伸
C≡C 伸
CH弯(面内)
CH弯(面外)
~3300
2270~2100
1260~1245
645~615
~3.03
4.41~4.76
7.94~8.03
15.50~16.25
中
中
强
四、取代苯类CH伸
泛频峰
骨架振动(
C
C=
ν)
CH弯(面内)
CH弯(面外)3100~3000
2000~1667
1600±20
1500±25
1580±10
1450±20
1250~1000
910~665
3.23~3.33
5.00~
6.00
6.25±0.08
6.67±0.10
6.33±0.04
6.90±0.10
8.00~10.00
10.99~15.03
变
弱
强
三、四个峰,特征
确定取代位置
单取代
邻双取代
间双取代
对双取代
1,2,3,三取代
1,3,5,三取代1,2,4,三取代
﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
770~730
770~730
810~750
900~860
860~800
810~750
874~835
885~860
860~800
860~800
860~800
865~810
~860
12.99~13.70
12.99~13.70
12.35~13.33
11.12~11.63
11.63~12.50
12.35~13.33
11.44~11.98
11.30~11.63
11.63~12.50
11.63~12.50
11.63~12.50
11.56~12.35
~11.63
极强
极强
极强
中
极强
强
强
中
强
强
强
强
强
五个相邻氢
四个相邻氢
三个相邻氢
一个氢(次要)
二个相邻氢
三个相邻氢与间
双易混
一个氢
一个氢
二个相邻氢
二个相邻氢
一个氢
一个氢
一个氢
波波配体和16M n:通过比较配体与配合物的红外光谱图(附录图1.3)发现配体在1626.5 cm−1、1624.1 cm−1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中3260.8 cm−1、3042 cm−1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm−1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,1580.1 cm−1处的吸收峰归属为
丁烯中C=C的特征吸收峰,1487.3 cm−1处的吸收峰为–C=N–N=C–基团产生[16-17]。
与配体的红外(附录图1.3)光谱图相比,在3426 cm-1处出现的新的宽吸收峰,可归属为水分子的伸缩振动峰υ(HO-H)。
而配合物(1)中的红外光谱图中(附录图1.4) 3260.8 cm−1、3042 cm−1左右处已经不存在N-H的伸缩振动峰,且1626.5 cm−1、1624.1 cm−1处羰基的吸收峰红移至1603.3 cm−1,说明在配合物中配体脱掉质子后才跟金属反应参与配位。
而且,我们还可以看出:2709 cm−1处酚羟基的吸收峰蓝移至2974.7 cm−1,说明酚基氧也与金属离子配位。
1458 cm−1、1402 cm−1、1352 cm−1等处为苯环的吸收峰。
上述分析结果与配合物晶体结构分析结小璐:如图4.1,配体H6frshz的红外谱图在3440 cm-1的吸收峰可归属为水的吸收峰;1636cm-1处的吸收峰可归属为羰基C=O基团的伸缩振动ν(C-O)峰;1482、1378cm-1处的吸收峰可归属为吡啶环的特征吸收峰;1482、827、754cm-1处的吸收峰可归属为苯环的特征吸收峰[i-vi]
附录图4.2为配合物(8)的红外谱图,与配体相比,酚羟基-OH的伸缩振动峰已经不存在了,而且在配体中1636cm-1处的羰基伸缩振动发生红移至1597cm-1处,说明羰基氧发生配位,这与单晶解析的结果相一致。
配合物(9)与配合物(8)的红外谱图分析相似,见附录图4.3。
[i] A. García-Raso, J. J. Fiol, F. Bádenas, M. Quirós. X-ray diffraction structures of
two N-Salicylidene tryptophananato diaquocopper(II)complexes: erythro and threo somers [J]. Polyhedron, 1996, 15(24) : 4407-4413.
[ii] F. Mévellec, A. Roucoux, N. Noiret, H. Patin, L. Toupet. Synthesis, spectroscopic studied and moleculartructure of original halogeno-[S-methyl-3-(2-hydroxyphen-ylethylidene) dithiocarbazato] oxo–rhenium(V)complexes [J]. Polyhedron, 1999, 18 : 2537-2541.
[iii] H. Adams, G. Minardi, E. Mura, A. M. Pistuddi. A coordination polymer derived from the copper (II) complex of a bis-(salicylhydrazone) derived from iminodiacetic acid diethyl ester [J]. Inorganic Chemistry Communications, 2000, 3(1): 24-28.
[iv] M. A. Ali, A. H. Mirza, R. J. Butcher, M. T. H. Tarafder. Synthetic, spectroscopic, biological and X-raycrystallographic structural studies on a novel pyridine-nitrogen-bridgeddimeric nickel(II) complex of a pentadentate N3S2 ligand [J]. Inorg.Chim.Acta., 2001, 320 : 1-6.
[v] H. Adams, G. Minardi, E. Mura, A. M. Pistuddi , A coordination polymer derived from the copper(II) complex of a bis-(salicylhydrazone) derived from iminodiacetic acid diethylester [J]. Inorganic Chemistry Communications, 2000,
3(1) : 24-28.
[vi] S. N. Rao, K. Munshi, N. N. Rao, M. Bhadbhade, E. Suresh. Synthesis, spectral and X-ray structural characterization of [cis-MoO2(L)(solv)](L = salicylidene salicyloyl hydrazine) and its use as catalytic oxidant [J].Polyhedron, 1999, 18(19) : 2491-2497.。