红外测试峰值对照图
- 格式:doc
- 大小:79.50 KB
- 文档页数:5

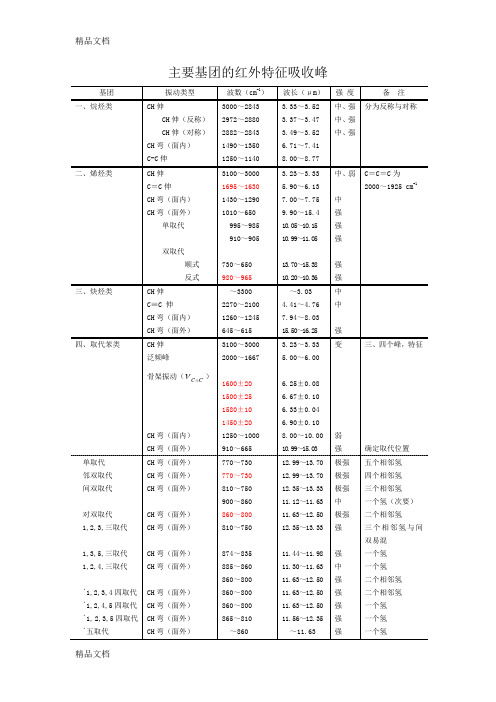
主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~11403.33~3.523.37~3.473.49~3.526.71~7.418.00~8.77中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~9653.23~3.335.90~6.137.00~7.759.90~15.410.05~10.1510.99~11.0513.70~15.3810.20~10.36中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~3.034.41~4.767.94~8.0315.50~16.25中中强四、取代苯类CH伸泛频峰骨架振动(CC)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~6653.23~3.335.00~6.006.25±0.086.67±0.106.33±0.046.90±0.108.00~10.0010.99~15.03变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~86012.99~13.7012.99~13.7012.35~13.3311.12~11.6311.63~12.5012.35~13.3311.44~11.9811.30~11.6311.63~12.5011.63~12.5011.63~12.5011.56~12.35~11.63极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)C—O伸O—H弯(面外)3700~32001410~12601260~1000750~6502.70~3.137.09~7.937.94~10.0013.33~15.38变弱强强液态有此峰OH伸缩频率游离OH分子间氢键分子内氢键OH弯或C—O伸伯醇(饱和)仲醇(饱和)叔醇(饱和)酚类(ФOH)OH伸OH伸OH伸(单桥)OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)Ф—O伸3650~35903500~33003570~3450~14001250~1000~14001125~1000~14001210~11001390~13301260~11802.74~2.792.86~3.032.80~2.90~7.148.00~10.00~7.148.89~10.00~7.148.26~9.097.20~7.527.94~8.47强强强强强强强强强中强锐峰钝峰(稀释向低频移动*)钝峰(稀释无影响)六、醚类C—O—C伸1270~1010 7.87~9.90 强或标C—O伸脂链醚脂环醚芳醚(氧与芳环相连)C—O—C伸C—O—C伸(反称)C—O—C伸(对称)=C—O—C伸(反称)=C—O—C伸(对称)CH伸1225~10601100~1030980~9001270~12301050~1000~28258.16~9.439.09~9.7110.20~11.117.87~8.139.52~10.00~3.53强强强强中弱氧与侧链碳相连的芳醚同脂醚O—CH3的特征峰七、醛类(—CHO)CH伸C=O伸CH弯(面外)2850~27101755~1665975~7803.51~3.695.70~6.0010.2~12.80弱很强中一般~2820及~2720cm-1两个带饱和脂肪醛α,β-不饱和醛芳醛C=O伸C=O伸C=O伸~1725~1685~1695~5.80~5.93~5.90强强强八、酮类OC C=O伸C—C伸泛频1700~16301250~10303510~33905.78~6.138.00~9.702.85~2.95极强弱很弱脂酮饱和链状酮α,β-不饱和酮β二酮芳酮类Ar—CO C=O伸C=O伸C=O伸C=O伸C=O伸1725~17051690~16751640~15401700~16301690~16805.80~5.865.92~5.976.10~6.495.88~6.145.92~5.95强强强强强C=O与C=C共轭向低频移动谱带较宽二芳基酮1-酮基-2-羟基(或氨基)芳酮脂环酮四环元酮五元环酮六元、七元环酮C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1670~1660 1665~1635~1775 1750~1740 1745~1725 5.99~6.02 6.01~6.12~5.63 5.71~5.75 5.73~5.80 强强强强强九、羧酸类(—COOH )OH 伸C =O 伸OH 弯(面内)C —O 伸OH 弯(面外)3400~2500 1740~1650 ~1430 ~1300 950~9002.94~4.00 5.75~6.06 ~6.99 ~7.69 10.53~11.11中强弱中弱在稀溶液中,单体酸为锐峰在~3350cm -1;二聚体为宽峰,以~3000cm -1为中心脂肪酸R —COOH α,β-不饱和酸芳酸C =O 伸C =O 伸C =O 伸1725~1700 1705~1690 1700~16505.80~5.88 5.87~5.91 5.88~6.06强强强氢键十、酸酐链酸酐C =O 伸(反称)C =O 伸(对称)C —O 伸1850~1800 1780~1740 1170~1050 5.41~5.56 5.62~5.75 8.55~9.52 强强强共轭时每个谱带降20 cm-1环酸酐(五元环)C =O 伸(反称)C =O 伸(对称)C —O 伸1870~1820 1800~1750 1300~1200 5.35~5.49 5.56~5.71 7.69~8.33 强强强共轭时每个谱带降20cm-1十一、酯类C OR OC =O 伸(泛频)C =O 伸C —O —C 伸~3450 1770~1720 1280—1100~2.90 5.65~5.81 7.81~9.09弱强强多数酯C =O 伸缩振动正常饱和酯α,β-不饱和酯δ-内酯γ-内酯(饱和)β-内酯C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1744~1739 ~1720 1750~1735 1780~1760 ~1820 5.73~5.75 ~5.81 5.71~5.76 5.62~5.68 ~5.50 强强强强强十二、胺NH 伸NH 弯(面内)C —N 伸NH 弯(面外)3500~3300 1650~1550 1340~1020 900~650 2.86~3.03 6.06~6.45 7.46~9.80 11.1~15.4 中中强伯胺强,中;仲胺极弱伯胺类仲胺类叔胺类NH 伸(反称、对称)NH 弯(面内)C —N 伸NH 伸NH 弯(面内)C —N 伸C —N 伸(芳香)3500~3400 1650~1590 1340~1020 3500—3300 1650—1550 1350—1020 1360~10202.86~2.94 6.06~6.29 7.46~9.80 2.86—3.03 6.06—6.45 7.41—9.80 7.35~9.80中、中强、中中、弱中极弱中、弱中、弱双峰一个峰十三、酰胺(脂肪与芳香酰胺数据类似)NH伸C=O伸NH弯(面内)C—N伸3500~31001680~16301640~15501420~14002.86~3.225.95~6.136.10~6.457.04~7.14强强强中伯酰胺双峰仲酰胺单峰谱带Ⅰ谱带Ⅱ谱带Ⅲ伯酰胺仲酰胺叔酰胺NH伸(反称)(对称)C=O伸NH弯(剪式)C—N伸NH2面内摇NH2面外摇NH伸C=O伸NH弯+C—N伸C—N伸+NH弯C=O伸~3350~31801680~16501650~16201420~1400~1150750~600~32701680~16301570~15151310~12001670~1630~2.98~3.145.95~6.066.06~6.157.04~7.14~8.701.33~1.67~3.095.95~6.136.37~6.607.63~8.335.99~6.13强强强强中弱中强强中中两峰重合两峰重合十四、氰类化合物脂肪族氰α、β芳香氰α、β不饱和氰C≡N伸C≡N伸C≡N伸2260~22402240~22202235~22154.43~4.464.46~4.514.47~4.52强强强十五、硝基化合物R—NO2 Ar—NO2NO2伸(反称)NO2伸(对称)NO2伸(反称)NO2伸(对称)1590~15301390~13501530~15101350~13306.29~6.547.19~7.416.54~6.627.41~7.52强强强强波波配体和16Mn:通过比较配体与配合物的红外光谱图(附录图1.3)发现配体在1626.5 cm-1、1624.1 cm-1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中3260.8 cm-1、3042 cm-1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm-1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,1580.1 cm-1处的吸收峰归属为丁烯中C=C的特征吸收峰,1487.3 cm-1处的吸收峰为–C=N–N=C–基团产生[16-17]。
主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~11403.33~3.523.37~3.473.49~3.526.71~7.418.00~8.77中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~9653.23~3.335.90~6.137.00~7.759.90~15.410.05~10.1510.99~11.0513.70~15.3810.20~10.36中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~3.034.41~4.767.94~8.0315.50~16.25中中强四、取代苯类CH伸泛频峰骨架振动(CC=ν)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~6653.23~3.335.00~6.006.25±0.086.67±0.106.33±0.046.90±0.108.00~10.0010.99~15.03变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~86012.99~13.7012.99~13.7012.35~13.3311.12~11.6311.63~12.5012.35~13.3311.44~11.9811.30~11.6311.63~12.5011.63~12.5011.63~12.5011.56~12.35~11.63极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢波波配体和16M n:通过比较配体与配合物的红外光谱图(附录图1.3)发现配体在1626.5 cm−1、1624.1 cm−1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中3260.8 cm−1、3042 cm−1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm−1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,1580.1 cm−1处的吸收峰归属为丁烯中C=C的特征吸收峰,1487.3 cm−1处的吸收峰为–C=N–N=C–基团产生[16-17]。

红外测试峰值对照图 WEIHUA system office room 【WEIHUA 16H-WEIHUA WEIHUA8Q8-主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~1140~~~~~中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~965~~~~~~~~中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~~~~中中强四、取代苯类CH伸泛频峰骨架振动(CC=ν)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~665~~±±±±~~变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~860~~~~~~~~~~~~~极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)C—O伸O—H弯(面外)3700~32001410~12601260~1000750~650~~~~变弱强强液态有此峰波波配体和16M n:通过比较配体与配合物的红外光谱图(附录图发现配体在cm1、cm?1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中cm?1、3042 cm1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm?1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,cm1处的吸收峰归属为丁烯中C=C的特征吸收峰, cm1处的吸收峰为–C=N–N=C–基团产生[16-17]。

红外光谱特征峰对照表
以下是一些常见的有机分子在红外光谱中的特征峰,用于参考:烷基C-H 伸缩振动:约2920-2850 cm^-1
烷基C-H 弯曲振动:约1470 cm^-1
芳香环C-H 伸缩振动:约3050-3000 cm^-1
羧基C=O 伸缩振动:约1725 cm^-1
酯基C=O 伸缩振动:约1750-1735 cm^-1
醛基C=O 伸缩振动:约1740-1720 cm^-1
羟基O-H 伸缩振动:约3600-3200 cm^-1(宽而弱)
胺基N-H 伸缩振动:约3500-3200 cm^-1
烷基C-C 伸缩振动:约1480-1420 cm^-1
芳香环C=C 伸缩振动:约1600-1580 cm^-1
卤代烃C-X 伸缩振动(X=Cl, Br, I):约800-600 cm^-1
需要注意的是,这些特征峰的位置和强度可能受到其他因素的影响,如分子中其它官能团的存在、分子的构象等。
因此,特征峰的确切位置可能会有所偏移,只能作为参考。

主要基团的红外特征吸收峰反式985 910~905 730~650 980~965三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~~~~中中强四、取代苯类CH伸泛频峰骨架振动(CC=ν)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000~~±±±±~~变弱强三、四个峰,特征确定取代位置910~665单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~860~~~~~~~~~~~~~极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)3700~3200~~变弱液态有此峰波波配体和16Mn:通过比较配体与配合物的红外光谱图(附录图发现配体在 cm1、 cm?1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中 cm1、3042 cm?1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm1处的吸收峰归属为酚羟基ν(O–H)伸缩振动, cm?1处的吸收峰归属为丁烯中C=C的特征吸收峰, cm1处的吸收峰为–C=N–N=C–基团产生[16-17]。

表15.1 典型有机化合物的重要基团频率(/cm-1)化合物基团X-H伸缩振动区叁键区双键伸缩振动区部分单键振动和指纹区烷烃-CH3asCH:2962±10(s) asCH:1450±10(m)sCH:2872±10(s)sCH:1375±5(s)-CH2-asCH:2926±10(s)CH:1465±20(m)sCH:2853±10(s)CH:2890±10(s)CH:~1340(w)烯烃CH:3040~3010(m) C=C:1695~1540(m) CH:1310~1295(m)CH:770~665(s)CH:3040~3010(m) C=C:1695~1540(w) CH:970~960(s)炔烃-C≡C-HCH:≈3300(m) C≡C:2270~2100(w)芳烃CH:3100~3000(变)泛频:2000~1667(w)C=C:1650~1430(m)2~4个峰CH:1250~1000(w) CH:910~665单取代:770~730(vs)≈700(s)邻双取代:770~735(vs) 间双取代:810~750(vs)725~680(m)900~860(m) ~对双取代:860~790(vs)醇类R-OHOH:3700~3200(变) OH:1410~1260(w)CO:1250~1000(s)OH:750~650(s) 酚类Ar-OHOH:3705~3125(s) C=C:1650~1430(m) OH:1390~1315(m)CO:1335~1165(s)脂肪醚R-O-R'CO:1230~1010(s)酮C=O:≈1715(vs)醛CH:≈2820,≈2720(w)双峰C=O:≈1725(vs)羧酸OH:3400~2500(m) C=O:1740~1690(m) OH:1450~1410(w)CO:1266~1205(m)酸酐C=O:1850~1880(s)C=O:1780~1740(s)CO:1170~1050(s)酯泛频C=O:≈3450(w) C=O:1770~1720(s) COC:1300~1000(s)胺-NH2NH2:3500~3300(m)双峰NH:1650~1590(s,m) CN(脂肪):1220~1020(m,w)CN(芳香):1340~1250(s)-NHNH:3500~3300(m) NH:1650~1550(vw) CN(脂肪):1220~1020(m,w)CN(芳香):1350~1280(s)酰胺asNH:≈3350(s) C=O:1680~1650(s) CN:1420~1400(m)sNH:≈3180(s) NH:1650~1250(s) NH2:750~600(m)NH:≈3270(s) C=O:1680~1630(s)NH+CN:1750~1515(m)CN+NH:1310~1200(m)C=O:1670~1630酰卤C=O:1810~1790(s)腈-C≡NC≡N:2260~2240(s)硝基化合物R-N02NO2:1565~1543(s) NO2:1385~1360(s)CN:920~800(m)Ar-NO2NO2:1550~1510(s) NO2:1365~1335(s)CN:860~840(s)不明:≈750(s)吡啶类CH:≈3030(w) C=C及C=N:1667~1430(m) CH:1175~1000(w) CH:910~665(s)嘧啶类CH:3060~3010(w) C=C及C=N:1580~1520(m) CH:1000~960(m) CH:825~775(m)* 表中vs,s,m,w,vw用于定性地表示吸收强度很强,强,中,弱,很弱。
红外光谱的八个峰区(二)分子式的确定:分子式应具有合理的不饱和度;同时符合氮规则。
利用同位素确定分子式。
由于存在同位素,质谱图中除了有质量为M的分子离子峰外,还有质量为M+1,M+2等的同位素峰。
计算其(M+1)/M、(M+2)/M的强度百分比,查表则可确定化合物的化学式。
或者对于分子式CxHyOmNzSv:I(M+1)/(M)×100%=1.1x+0.37z+0.8vI(M+1)/(M)×100%=(1.1x)2/200+0.2m+4.4v即可确定分子式。
另外:分子中含1个Cl:M:M+2=3:1分子中含2个Cl:M:M+2:M+4=9:6:1分子中含1个Br:M:M+2=1:1分子中含2个Br:M:M+2:M+4=1:2:1分子中含1个Cl和1个Br:M:M+2:M+4=3:4:1例:化合物的质谱图如下,推到其分子式。
解:设:分子离子峰:7373–58 = 15 合理(1.9/31) 100 = 1.1x+0.37z,z=1, x=5, y=73–14–60= –1 (不合理)z=1, x=4, y=73–14–48=11 (合理)分子式 C4H11N, Ω =0(三)结构式的确定:化合物生成离子的质量及强度,与该化合物本身的结想是从总体到个体,由主峰到次峰,逐步分析)以下是质谱图解析的一般过程:A.考察谱图特点。
主要考察两个方面:分子离子峰的相对强度和谱图全貌特点。
根据分子离子峰确定分子量,同时可以初步判断化合物类型及是否含有Cl、Br、S等元素。
如果分子离子峰为基峰,碎片离子较少而且相对强度较低,可以断定是一个高度稳定的分子.B.根据从分子离子峰及同位素峰确定化合物的组成式。
C.由组成式计算化合物的不饱和度,可确定化合物中环和双键的数目,有助于判断化合物的结构。
计算方法如下:不饱和度U=四价原子数 - 一价原子数/2 + 三价原子数/2 + 1D.研究高质量端离子峰。
红外各基团特征峰对照表一、红外吸收光谱中的重要区段:-1)(3750〜3000 cm 1) O-H>N-H 伸缩振动区“)(3300〜3000 cm 2)不饱和碳上的C-H 伸缩振动区不饱和碳(三键和双键、苯环)上的C-H的伸缩振动在3300〜3000 cm-1 区域中出现不同的吸收峰。
-1)(3000〜2700 cm 3) C-H伸缩振动区饱和碳上的C-H伸缩振动(包括醛基上的C-H)-1)(2400〜2100 cm4)卷键和累积双键区波数在2400〜2100 cm-1区域内的谱带较少。
-1)(1900^1650 cm 5)按基的伸缩振动区心山于按基的电偶极矩较1755〜1670 cm 拨基的吸收最常见出现的区域为大,一般吸收都很强烈,常成为IR光谱中的笫—强峰。
-1) 6)双键伸缩振动区(1690〜1500 cm该区主要包括C=C, C=N, N=N, N=O等的伸缩振动以及苯环的骨架振动(o )。
c=c-i)伸缩振动区(1475〜1000 CH1X-Y7) X-H面内弯曲振动及这个区域主要包括C-H面内弯曲振动,C-O、C-X(卤素)等伸缩振动,以及C-C单键骨架振动等。
该区域是指纹区的一部分。
-11000〜650 cm面外弯曲振动区(C-H8))」区。
苯环邻二取)在1000〜650 emo C-H烯桂、芳炷的C・H面外弯曲振动(•□;苯环对二取代:、770〜735cm810〜750cm;苯环间二取代:710〜690代:-i 830〜810cm 具体对照表如下所示:(其中:VS:很强;W:弱;S:强;VW:很弱;m:中等;w:宽)-峰的强波基团类V3700〜320o・V,尖锐吸收3700〜350游。
・分子间氢V,尖锐吸收3550〜345二分子缔3500〜320,宽吸收多分子缔V3500〜250,宽吸收竣。
23570〜345,尖锐吸收分子内氢N-,尖锐吸收3500〜3300游离W,尖锐吸收带3500〜3100缔合3500〜3300可变酰胺-13300—3000 cm 伸缩振动区(2、C-H)-1峰的强度波数/cm基团类型vVS 〜3300-C三C・HM・C=C・H 3100〜3000M3050〜3010Ar-H-13000—2700 cmC-H 伸缩振动区(3、)"基团类型v波数/cin峰的强度VS-CH 2960 及28703VS -CH 及2850 - 293(hW2890 =C-HW -CHO 2720-12400—2100 CHK卷键和累积双键区(4)」基团类型波数/cm v峰的强度mR-C=C-H2140-2100 RC三CR 2260〜2190可变RC=CR无吸收S R-C±N2260〜2120SR-N=N=N 2160-2120SR-N=C=N-R2155 〜2130S-C=C=C-〜1950-C=C=O〜2150〜2000-C=C=N0=00 〜2349R-N=C=O 2275〜2250S-11900—1650 cm>拨基的伸缩振动区(5)-i峰的强度/cm波数基团类型vS 1740〜1720饱和脂肪醛Sa ,P-不饱和脂肪醛1705〜1680S 1715〜1690芳香醛S 1725〜1705饱和脂肪酮S1685〜1665不饱和脂肪酮a , P- S 1745〜1725 a -卤代酮S1700-1680 芳香酮S 1800〜1750 )(脂环酮四员环S(五员环)1780〜1700S1760〜1680 (六员环)S1740〜1710 )酯(非环状S 1750〜1730六及七员环内酯S 1780〜1750五员环内酯S1815〜1720 酰卤S1850〜1800 1780〜1740 酸酊(游离)1700〜1680 酰胺1660〜1640 (缔合)-11690—1500 cm>双键伸缩振动区(6)1680〜1620-C=C・不定1620〜1450苯环骨架1690〜1640 -C=N 不定1630〜1575 -N=N=不定-N1615 〜1511390〜1320.1波数峰的强度/cmv基团类型1000〜650 )(不定OC-H770〜735 苯环邻二取代-810〜750cm、710〜690不定苯环间二取代830〜810 不定苯环对二取代二、指纹区和官能团区从第1・6区的吸收都有一个共同点,每一红外吸收峰都和一定的官能团相对应, 此区域从而称为官能团区。
(详细版)红外各官能团特征峰对照表
本文档旨在提供红外各官能团特征峰的对照表。
以下是各种常见官能团的红外特征峰及其对应的波数范围:
羟基官能团
- 醇:3330 – 3280 cm^-1
- 酚:3600 – 3200 cm^-1
羰基官能团
- 酮:1720 – 1710 cm^-1
- 酸:1710 – 1690 cm^-1
- 酯:1750 – 1735 cm^-1
- 醛:1740 – 1720 cm^-1
氨基官能团
- 氨:3350 – 3300 cm^-1
- 氨基丙烯酸:1660 – 1650 cm^-1
硫醇官能团
- 巯基:2550 – 2530 cm^-1
- 磺酸:1350 – 1200 cm^-1
硝基官能团
- 硝基酸:1560 – 1545 cm^-1
- 亚硝基:1650 – 1600 cm^-1
苯环官能团
- 间位取代:1600 – 1580 cm^-1
- 邻位取代:1530 – 1500 cm^-1
请注意,以上波数范围仅为常见情况下的大致范围,具体情况可能会有一定的变化。
此处列出的波数范围仅供参考,应结合实际红外光谱数据进行分析和判断。
红外各官能团的特征峰对照表将对化学分析、有机合成等领域的研究和实验提供重要参考。
望本文档能为相关领域的研究人员和实验人员提供便利。
---
注:本文档中列出的内容为常见情况下的特征峰和波数范围,但不排除有特殊情况的存在。
在进行具体分析时,请结合实际情况以及相关文献进行判断和验证。
傅里叶红外光谱对应的峰值
傅里叶红外光谱是一种常见的谱学分析方法,用于检测物质的结构和组成。
在傅里叶红外光谱中,不同波数的光谱峰对应着样品中不同的化学键和官能团。
因此,通过分析傅里叶红外光谱对应的峰值,可以确定样品的化学组成和结构。
在傅里叶红外光谱中,常见的光谱峰包括吸收带、弯曲振动带和拉伸振动带等。
各种光谱峰的出现位置和强度与样品的化学组成和结构密切相关。
例如,羧基、羟基和氨基等官能团会在傅里叶红外光谱中产生明显的光谱峰。
羧基的拉伸振动常在1700-1720cm^-1的波数范围内出现;羟基的拉伸振动则在3200-3600cm^-1的波数范围内出现;氨基则在3300-3500cm^-1的波数范围内出现。
此外,傅里叶红外光谱还可以用于鉴定有机化合物和无机化合物中特定的官能团和化学键,例如C=O和C-H等。
因此,分析傅里叶红外光谱对应的峰值是一种重要的化学分析方法,可以为化学物质的鉴定和分析提供重要的信息。
主要基团的红外特征吸收峰
基团振动类型波数(cm-1)波长(μm)强度备注
一、烷烃类CH伸
CH伸(反称)
CH伸(对称)
CH弯(面内)
C-C伸3000~2843
2972~2880
2882~2843
1490~1350
1250~1140
3.33~3.52
3.37~3.47
3.49~3.52
6.71~
7.41
8.00~8.77
中、强
中、强
中、强
分为反称与对称
二、烯烃类CH伸
C=C伸
CH弯(面内)
CH弯(面外)
单取代
双取代
顺式
反式3100~3000
1695~1630
1430~1290
1010~650
995~985
910~905
730~650
980~965
3.23~3.33
5.90~
6.13
7.00~7.75
9.90~15.4
10.05~10.15
10.99~11.05
13.70~15.38
10.20~10.36
中、弱
中
强
强
强
强
强
C=C=C为
2000~1925 cm-1
三、炔烃类CH伸
C≡C 伸
CH弯(面内)
CH弯(面外)
~3300
2270~2100
1260~1245
645~615
~3.03
4.41~4.76
7.94~8.03
15.50~16.25
中
中
强
四、取代苯类CH伸
泛频峰
骨架振动(
C
C=
ν)
CH弯(面内)
CH弯(面外)3100~3000
2000~1667
1600±20
1500±25
1580±10
1450±20
1250~1000
910~665
3.23~3.33
5.00~
6.00
6.25±0.08
6.67±0.10
6.33±0.04
6.90±0.10
8.00~10.00
10.99~15.03
变
弱
强
三、四个峰,特征
确定取代位置
单取代
邻双取代
间双取代
对双取代
1,2,3,三取代1,3,5,三取代1,2,4,三取代
﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
CH弯(面外)
770~730
770~730
810~750
900~860
860~800
810~750
874~835
885~860
860~800
860~800
860~800
865~810
~860
12.99~13.70
12.99~13.70
12.35~13.33
11.12~11.63
11.63~12.50
12.35~13.33
11.44~11.98
11.30~11.63
11.63~12.50
11.63~12.50
11.63~12.50
11.56~12.35
~11.63
极强
极强
极强
中
极强
强
强
中
强
强
强
强
强
五个相邻氢
四个相邻氢
三个相邻氢
一个氢(次要)
二个相邻氢
三个相邻氢与间
双易混
一个氢
一个氢
二个相邻氢
二个相邻氢
一个氢
一个氢
一个氢
波波配体和16M n:通过比较配体与配合物的红外光谱图(附录图1.3)发现配体在1626.5 cm−1、1624.1 cm−1处有吸收峰,可归属为羰基C=O的伸缩振动,而图中3260.8 cm−1、3042 cm−1处的吸收峰可归属为酰胺基的ν(N-H)伸缩振动,2709 cm−1处的吸收峰归属为酚羟基ν(O–H)伸缩振动,1580.1 cm−1处的吸收峰归属为丁烯中C=C的特征吸收峰,1487.3 cm−1处的吸收峰为–C=N–N=C–基团产生[16-17]。
与配体的红外(附录图1.3)光谱图相比,在3426 cm-1处出现的新的宽吸收峰,可归属为水分子的伸缩振动峰υ(HO-H)。
而配合物(1)中的红外光谱图中(附录图1.4) 3260.8 cm−1、3042 cm−1左右处已经不存在N-H的伸缩振动峰,且1626.5 cm−1、1624.1 cm−1处羰基的吸收峰红移至1603.3 cm−1,说明在配合物中配体脱掉质子后才跟金属反应参与配位。
而且,我们还可以看出:2709 cm−1处酚羟基的吸收峰蓝移至2974.7 cm−1,说明酚基氧也与金属离子配位。
1458 cm−1、1402 cm−1、1352 cm−1等处为苯环的吸收峰。
上述分析结果与配合物晶体结构分析结小璐:如图4.1,配体H6frshz的红外谱图在3440 cm-1的吸收峰可归属为水的吸收峰;1636cm-1处的吸收峰可归属为羰基C=O基团的伸缩振动ν(C-O)峰;
1482、1378cm-1处的吸收峰可归属为吡啶环的特征吸收峰;1482、827、754cm-1处的吸收峰可归属为苯环的特征吸收峰[i-vi]
附录图4.2为配合物(8)的红外谱图,与配体相比,酚羟基-OH的伸缩振动峰已经不存在了,而且在配体中1636cm-1处的羰基伸缩振动发生红移至1597cm-1处,说明羰基氧发生配位,这与单晶解析的结果相一致。
配合物(9)与配合物(8)的红外谱图分析相似,见附录图4.3。
[i] A. García-Raso, J. J. Fiol, F. Bádenas, M. Quirós. X-ray diffraction structures of
two N-Salicylidene tryptophananato diaquocopper(II)complexes: erythro and threo somers [J]. Polyhedron, 1996, 15(24) : 4407-4413.
[ii] F. Mévellec, A. Roucoux, N. Noiret, H. Patin, L. Toupet. Synthesis, spectroscopic studied and moleculartructure of original halogeno-[S-methyl-3-(2-hydroxyphen-ylethylidene) dithiocarbazato] oxo–rhenium(V)complexes [J]. Polyhedron, 1999, 18 : 2537-2541.
[iii] H. Adams, G. Minardi, E. Mura, A. M. Pistuddi. A coordination polymer derived from the copper (II) complex of a bis-(salicylhydrazone) derived from iminodiacetic acid diethyl ester [J]. Inorganic Chemistry Communications, 2000, 3(1): 24-28.
[iv] M. A. Ali, A. H. Mirza, R. J. Butcher, M. T. H. Tarafder. Synthetic, spectroscopic, biological and X-raycrystallographic structural studies on a novel pyridine-nitrogen-bridgeddimeric nickel(II) complex of a pentadentate N3S2 ligand [J]. ., 2001, 320 : 1-6.
[v] H. Adams, G. Minardi, E. Mura, A. M. Pistuddi , A coordination polymer derived from the copper(II) complex of a bis-(salicylhydrazone) derived from iminodiacetic acid diethylester [J]. Inorganic Chemistry Communications, 2000, 3(1) : 24-28.
[vi] S. N. Rao, K. Munshi, N. N. Rao, M. Bhadbhade, E. Suresh. Synthesis, spectral and X-ray structural characterization of [cis-MoO2(L)(solv)](L = salicylidene salicyloyl hydrazine) and its use as catalytic oxidant [J].Polyhedron, 1999, 18(19) : 2491-2497.。