2020年测定蛋白酶活力实验(课件)
- 格式:doc
- 大小:21.50 KB
- 文档页数:4
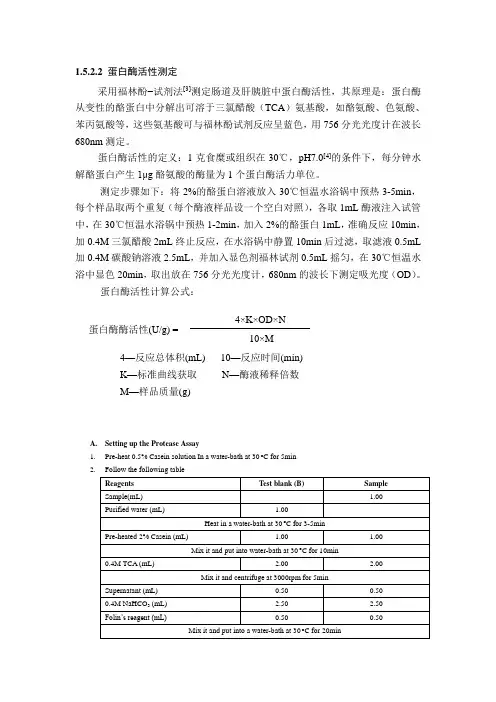
1.5.2.2 蛋白酶活性测定采用福林酚−试剂法[3]测定肠道及肝胰脏中蛋白酶活性,其原理是:蛋白酶从变性的酪蛋白中分解出可溶于三氯醋酸(TCA )氨基酸,如酪氨酸、色氨酸、苯丙氨酸等,这些氨基酸可与福林酚试剂反应呈蓝色,用756分光光度计在波长680nm 测定。
蛋白酶活性的定义:1克食糜或组织在30℃,pH7.0[4]的条件下,每分钟水解酪蛋白产生1μg 酪氨酸的酶量为1个蛋白酶活力单位。
测定步骤如下:将2%的酪蛋白溶液放入30℃恒温水浴锅中预热3-5min ,每个样品取两个重复(每个酶液样品设一个空白对照),各取1mL 酶液注入试管中,在30℃恒温水浴锅中预热1-2min ,加入2%的酪蛋白1mL ,准确反应10min ,加0.4M 三氯醋酸2mL 终止反应,在水浴锅中静置10min 后过滤,取滤液0.5mL 加0.4M 碳酸钠溶液2.5mL ,并加入显色剂福林试剂0.5mL 摇匀,在30℃恒温水浴中显色20min ,取出放在756分光光度计,680nm 的波长下测定吸光度(OD )。
蛋白酶活性计算公式:4—反应总体积(mL) 10—反应时间(min) K —标准曲线获取 N —酶液稀释倍数 M —样品质量(g)A. Setting up the Protease Assay1. Pre-heat 0.5% Casein solution In a water-bath at 30 o C for 5min2. Follow the following table蛋白酶酶活性(U/g) =4×K×OD×N 10×M3.4.Follow the following table to determine sample blank。

实验四、蛋白酶酶活力的测定一、原理以酪蛋白为反应底物,令蛋白酶在其最适宜条件下反应一定时间,用三氯乙酸终止反应后过滤或离心得上清液,用Folin比色法测上清液中蛋白酶解物的浓度,计算蛋白酶活力。
蛋白酶活力定义:在一定的条件下,每分钟水解酪蛋白生成与1μg酪氨酸相当的三氯醋酸可溶物所需的木瓜蛋白酶的量,为1个酶活力单位(u)。
二、材料、仪器与试剂(一)材料:木瓜蛋白酶(二)仪器:可见-紫外分光光度计、水浴锅、天平、具塞刻度试管(10、15ml)、漏斗、滤纸、试管架,容量瓶、移液管(1、10ml)、烧杯(25ml)、玻璃棒。
(三)试剂:1福林试剂(Folin试剂)市场购买的Folin试剂。
此溶液使用时加2倍蒸馏水稀释,即成已稀释3倍的福林试剂。
2、中性稀释液-pH7.2磷酸盐缓冲液称取磷酸二氢钠(NaH2PO4·2H2O)31.2g,定容至1000mL,即成0.2mol/L溶液(A液)。
称取磷酸氢二钠(Na2HPO4·12H2O)71.63g,定容至1000mL,即成0.2mol/L 溶液(B液)。
取A 液28mL 和B 液72mL,再用蒸馏水稀释1倍,即成0.1mol pH7.2的磷酸盐缓冲液。
3、酪蛋白溶液2g恒重的酪蛋白,用0.5mol/LNaOH溶液润湿后加入80ml pH7.2磷酸盐缓冲液,沸水浴溶解,冷却后,用1 mol/L盐酸调至pH 7.0,再用磷酸盐缓冲液定容至100ml,得浓度为2%的酪蛋白溶液。
临用现配。
4、三氯醋酸溶液称取三氯乙酸(CCL3COOH)65.4g,定容至1000mL,得0.4mol/L三氯乙酸(TCA)溶液5、酪氨酸标准溶液精确称取精确称取在105℃烘箱中烘至恒重的酪氨酸0.1000g,逐步加入6mL 1N盐酸使溶解,用0.2N盐酸定容至100mL,其浓度为1000μg/mL,再用水稀释5倍,得到200μg/mL的酪氨酸标准溶液。
取200μg/mL的标准酪氨酸溶液,配成不同浓度的溶液(0、20、40、60、80、100μg/mL)6、样品溶液称取木瓜蛋白酶0.100g, 置于研钵中,加入相应的缓冲液定容至50mL,得到稀释500倍的酶液(当天配制、稀释)。
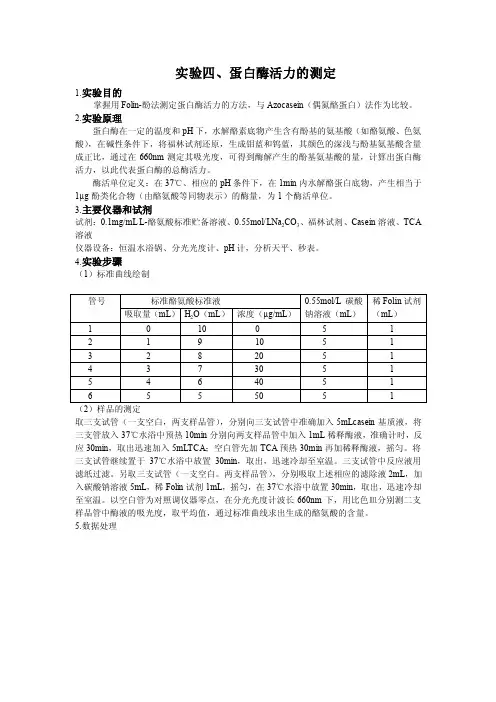
实验四、蛋白酶活力的测定1.实验目的掌握用Folin-酚法测定蛋白酶活力的方法,与Azocasein(偶氮酪蛋白)法作为比较。
2.实验原理蛋白酶在一定的温度和pH下,水解酪素底物产生含有酚基的氨基酸(如酪氨酸、色氨酸),在碱性条件下,将福林试剂还原,生成钼蓝和钨蓝,其颜色的深浅与酚基氨基酸含量成正比,通过在660nm测定其吸光度,可得到酶解产生的酚基氨基酸的量,计算出蛋白酶活力,以此代表蛋白酶的总酶活力。
酶活单位定义:在37℃、相应的pH条件下,在1min内水解酪蛋白底物,产生相当于1µg酚类化合物(由酪氨酸等同物表示)的酶量,为1个酶活单位。
3.主要仪器和试剂试剂:0.1mg/mL L-酪氨酸标准贮备溶液、0.55mol/LNa2CO3、福林试剂、Casein溶液、TCA 溶液仪器设备:恒温水浴锅、分光光度计、pH计,分析天平、秒表。
4.实验步骤(1)标准曲线绘制取三支试管(一支空白,两支样品管),分别向三支试管中准确加入5mLcasein基质液,将三支管放入37℃水浴中预热10min分别向两支样品管中加入1mL稀释酶液,准确计时,反应30min,取出迅速加入5mLTCA;空白管先加TCA预热30min再加稀释酶液,摇匀。
将三支试管继续置于37℃水浴中放置30min,取出,迅速冷却至室温。
三支试管中反应液用滤纸过滤。
另取三支试管(一支空白。
两支样品管),分别吸取上述相应的滤除液2mL,加入碳酸钠溶液5mL,稀Folin试剂1mL,摇匀,在37℃水浴中放置30min,取出,迅速冷却至室温。
以空白管为对照调仪器零点,在分光光度计波长660nm下,用比色皿分别测二支样品管中酶液的吸光度,取平均值,通过标准曲线求出生成的酪氨酸的含量。
5.数据处理。





实验:蛋白酶的活力测定一、实验目的1、学习蛋白酶活力的测定方法。
2、深入了解酶的活力和比活力的概念。
二、实验原理1、酶活力的大小,是以该酶在适宜的温度和pH下,酶催化一定时间后,反应底物的减少量或者反应产物的增加量来表示。
2、本实验蛋白酶的活力大小是以分解出的酪氨酸的量来表示,其单位为:每分钟内分解出1微克酪氨酸的酶量称为1单位。
3、本实验采用福林-酚与蛋白质水解出的酪氨酸生成兰色物,从兰色的深浅程度可以求知酪氨酸的多少,从而确定酶活力的大小。
4、在测酶活力前,先用福林-酚与用已知的不同浓度的酪氨酸作用,作出兰色深浅程度(用光密度表示)与酪氨酸浓度关系的标准曲线。
5、将酶与底物反应产生的产物与福林-酚试剂作用后测光密度,从标准曲线上查出相当于多少微克的酪氨酸,就可以计算出酶的单位了。
三、实验材料、仪器和试剂1.实验材料1398中性蛋白酶粗酶粉(上海新型发酵厂)、滤纸2.仪器(1)试管(1.5*15cm*24) (2)移液管(3)电热恒温水浴(4)721型分光光度计3.试剂(1)福林-酚试剂B(2)标准酪氨酸溶液称取50毫克酪氨酸(预先在105摄氏度烘至恒重),加0.2MHCL溶液后定容至100ml,在加水稀释5倍得到100微克/毫升的酪氨酸溶液。
(3)酪蛋白溶液称取酪蛋白2克,置150ml三角烧瓶中,加入0.2M磷酸氢二钠61ml,在水浴上搅拌使溶解,再加入39ml0.2M磷酸二氢钠,得到pH7的酪蛋白液,倾出上清液备用。
(4)0.4M三氯醋酸溶液(TCA)(5)0.4M碳酸钠溶液四、操作步骤1、酪氨酸标准曲线制作:按下列次序加入试剂,混合均匀,保温,然后在分光光度计上进行比色,测出650nm处的光密度值。
以酪氨酸浓度为横坐标,光密度值为纵坐标,作出标准曲线。
管号 1 2 3 4 5 62、蛋白酶活力测定 (1)浸出酶液称取0.5克酶粉加入40ml 水,在室温下放置1小时并时加搅动。
将酶浸出液过滤,取滤液1ml 用水稀释至20ml ,即为稀释1600倍的酶液。



测定蛋白酶活力实验一、实验目的1.加深了解酶活力的概念。
2.学习掌握测定蛋白酶活力的方法。
二、实验原理酶活力指酶催化某一特定反应的能力。
其大小可用在一定条件下酶催化反应进行一定时间后,反应体系中底物的减少量或产物的生成量来表示。
酶活力单位是表示酶活力大小的重要指标。
本实验规定酶活力单位(U)为一定条件下每分钟分解1μg 酪氨酸所需的酶量。
实验选用枯草杆菌蛋白酶水解酪蛋白产生酪氨酸的反应体系。
产物酪氨酸在碱性条件下与Folin-酚试剂反应生成蓝色化合物,该蓝色化合物在680nm 处有最大光吸收,其吸光值与酪氨酸含量呈正比。
因此通过测定一定条件下产物酪氨酸的含量变化,可计算出蛋白酶的活力。
三、仪器和试剂仪器:恒温水浴锅、分光光度计、试管及试管架、干燥滤纸、玻璃漏斗。
原料枯草杆菌蛋白酶:称取1g 枯草杆菌蛋白酶粉,用少量0.02mol/L,pH7.5磷酸缓冲液溶解并定容至100mL,震荡15分钟,使充分溶解,干纱布过滤,取滤液冰箱备用。
使用时视酶活力高低用缓冲液适当稀释。
试剂1. Folin-酚试剂:在2L 磨口回流瓶中加入钨酸钠(Na2WoO4. 2H2O)100g,钼酸钠(Na2WoO4. 2H2O)25g,蒸馏水700mL,85%磷酸50mL 以及浓盐酸100mL,充分混匀后,微火回流加热10小时。
再加入硫酸锂150g,蒸馏水50mL 和液溴数滴,摇匀后开口继续煮沸15min,以驱赶过剩的溴。
冷却后加蒸馏水定容至1000mL,过滤,溶液呈黄绿色,置于棕色试剂瓶中暗处贮藏。
使用前用标准NaOH 溶液、酚酞为指示剂标定酸度(约为2mol/L),然后加水稀释至1mol/L,即可使用。
2. 0.2mol/L 盐酸溶液3. 0.04mol/L 氢氧化钠溶液4. 0.55mol/L 碳酸钠溶液5. 10%三氯乙酸溶液6. 0.02mol/LpH7.5磷酸缓冲液:称取磷酸氢二钠(Na2HPO4 . 12H2O)7.16g,用水定容至100mL(A 液);称取磷酸二氢钠(Na2HPO4 .12H2O)3.12g,用水定容至100mL(B 液)。
2020年测定蛋白酶活力实验
(课件)
测定蛋白酶活力实验
一、实验目的ﻫ1.加深了解酶活力的概念.ﻫ2。
学习掌握测定蛋白酶活力的方法。
二、实验原理ﻫ酶活力指酶催化某一特定反应的能力。
其大小可用在一定条件下酶催化反应进行一定时间后,反应体系中底物的减少量或产物的生成量来表示。
酶活力单位是表示酶活力大小的重要指标。
本实验规定酶活力单位(U)为一定条件下每分钟分解1μg酪氨酸所需的酶量。
实验选用枯草杆菌蛋白酶水解酪蛋白产生酪氨酸的反应体系。
产物酪氨酸在碱性条件下与Folin-酚试剂反应生成蓝色化合物,该蓝色化合物在680nm 处有最大光吸收,其吸光值与酪氨酸含量呈正比.
因此通过测定一定条件下产物酪氨酸的含量变化,可计算出蛋白酶的活力.
三、仪器和试剂ﻫ仪器:ﻫ恒温水浴锅、分光光度计、试管及试管架、干燥滤纸、玻璃漏斗。
ﻫ原料ﻫ枯草杆菌蛋白酶:称取1g 枯草杆菌蛋白酶粉,用少量0.02mol/L,pH7.5磷酸缓冲液溶解并定容至100mL,震荡15分
钟,使充分溶解,干纱布过滤,取滤液冰箱备用。
使用时视酶活力高低用缓冲液适当稀释.ﻫ试剂ﻫ1. Folin-酚试剂:ﻫ在2L 磨口回流瓶中加入钨酸钠(Na2WoO4 . 2H2O)100g,钼酸钠(Na2WoO4. 2H2O)25g,蒸馏水700mL,85%磷酸50mL 以及浓盐酸100mL,充分混匀后,微火回流加热10小时。
再加入硫酸锂150g,蒸馏水50mL 和液溴数滴,摇匀后开口继续煮沸15min,以驱赶过剩的溴。
冷却后加蒸馏水定容至1000mL,过滤,溶液呈黄绿色,置于棕色试剂瓶中暗处贮藏。
使用前用标准NaOH 溶液、酚酞为指示剂标定酸度(约为2mol/L),然后加水稀释至1mol/L,即可使用.ﻫ2.0.2mol/L 盐酸溶液3.0.04mol/L 氢氧化钠溶液ﻫ4.0。
55mol/L 碳
10%三氯乙酸溶液酸钠溶液ﻫ5
.
6. 0.02mol/LpH7。
5磷酸缓冲液:称取磷酸氢二钠(Na2HPO4 . 12H2O)7。
16g,用水定容至100mL(A 液);称取磷酸二氢钠(Na2HPO4 .12H2O)3.12g,用水定容至100mL(B 液)。
取 A 液84mL,B液16mL 混合后,得到0.2mol/LpH
7.5磷酸缓冲液,可长期
7。
标准酪氨酸溶液存放。
临用时稀释10倍即可。
ﻫ
(50μg/mL):称取12.5mg 以烘干至恒重的酪氨酸,用0.2mol/L 盐酸约30mL溶解后,蒸馏水定容至250mL。
8。
酪蛋白溶液(0.5%):称取 1.25g 酪蛋白,用0.04mol/L氢氧化钠溶液(20mL)溶解,再用0.02mol/LpH7.5磷酸缓冲液定容到250mL。
ﻫ四、操作步骤(一)酪氨酸标准曲线的制作ﻫ取6支试管(标号0,1~5),按顺序分别加入0.00,0。
20,0.40,0。
60,0。
80和1.00mL 标准酪氨酸溶液,再用水补足到1.00mL,摇匀后各加入0.55mol/L碳酸钠5。
0mL,摇匀。
依次加入Fo lin—酚试剂 1.00mL,摇匀并计时,于30℃水浴锅中保温15min.然后680nm 处测定吸光值(以0号管作对照).以酪氨酸含量(μg)作横坐标,吸光值为纵坐标绘制标准曲线。
ﻫ(二)酶活力测定ﻫ1。
酶反应:取一支试管,加入2.0mL0.5%的酪蛋白溶液,于30℃水浴中预热5分钟,再加入1。
0mL已预热好的枯草杆菌蛋白酶液,立即计时,水浴中准确保温10min,从水浴中取出后,立即加入2。
0mL 的10%三氯醋酸溶液,摇匀静置数分钟,干滤纸过滤,收集滤液(样品液).另取一试管,先加入1.0mL 已预热好的枯草杆菌蛋白酶液和2.0mL的10%三氯醋酸溶液,摇匀,放置数分钟,再加入2.0mL0。
5%的酪蛋白溶液,然后于30℃水浴保温10min,同样干滤纸过滤,收集滤液(对照液)。
ﻫ以上两过程,应各做一次平行实验.ﻫ2.滤液中酪氨酸含量的测定取3支试管,分别加入1.0mL 水、A 液、B 液,然后各加入
5。
0 mL 0.55mol/L 碳酸钠溶液和1.00mLFolin-酚试剂,摇匀按标准曲线制作方法保温并测吸光度值。
根据吸光度值,由标准曲线查出A、B 液中酪氨酸含量差值,即可推算出酶的活力单位。
A 样
五、计算ﻫ品—样品液的吸光度值ﻫA对照—对照液的吸光度值ﻫK—标准曲线上A=1时对应的酪氨酸μg数V—酶促反应液的体积(本实验为5mL)ﻫT—酶促反应时间(本实验为10min)N—酶溶液稀释倍数
...... 感谢聆听 ......。