化学选修三配合物
- 格式:ppt
- 大小:1.01 MB
- 文档页数:46
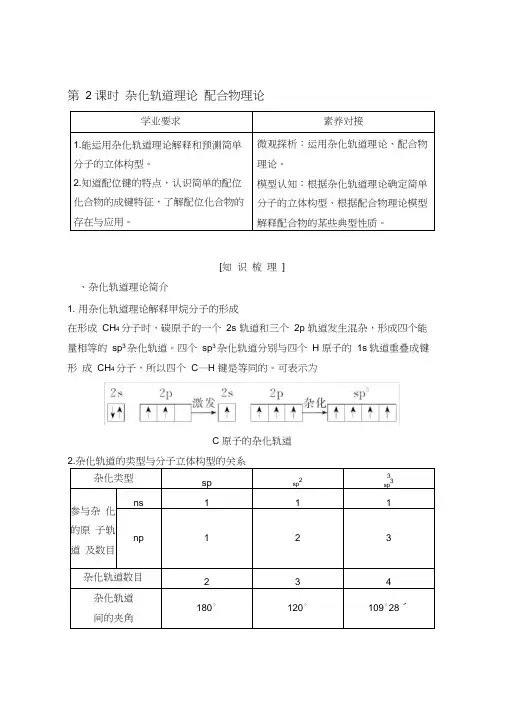
第 2 课时杂化轨道理论配合物理论[知识梳理]、杂化轨道理论简介1. 用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s 轨道和三个2p 轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H 原子的1s轨道重叠成键形成CH4分子,所以四个C—H 键是等同的。
可表示为C 原子的杂化轨道2.杂化轨道的类型与分子立体构型的关系【自主思考】1. 用杂化轨道理论分析CH4 的杂化类型和呈正四面体形的原因?提示在形成CH4分子时,碳原子的一个2s 轨道与三个2p轨道混杂,形成 4 个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4 个σ键之间作用力相等,键角相等形成正四面体形。
二、配合物理论简介1. 配位键(1) 概念:共用电子对由一个原子单方面提供而跟另一个原子共用的共价键,即“电子对给予-接受键”,是一类特殊的共价键。
(2) 实例:在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
(3) 表示:配位键可以用A→B来表示,其中 A 是提供孤电子对的原子,叫做配体; B 是接受电子对的原子。
例如:①NH 4+中的配位键表示为。
②[Cu(NH3)4]2+中的配位键表示为③[Cu(H2O)4]2+中的配位键表示为。
2. 配位化合物(1) 定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物,简称配合物。
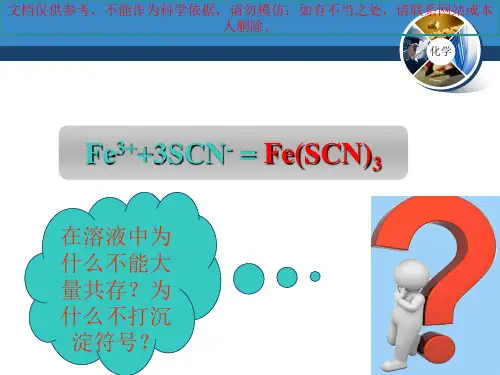
(2) 写出生成下列配合物的反应方程式:[Cu(H2O)4]Cl2:CuCl2+4H2O===[Cu(H2O)4]Cl2;Fe(SCN)3:Fe3++3SCN-===Fe(SCN)3。
(3) 配合物的稳定性配位键的强度有大有小,因而有的配合物很稳定,有的很不稳定。
许多过渡金属离子对多种配体具有很强的结合力,因而过渡金属配合物远比主族金属配合物多。
【自主思考】2. 配制银氨溶液时,向AgNO3 溶液中滴加氨水,先生成白色沉淀,后沉淀逐渐溶解,为什么?提示因为氨水呈弱碱性,滴入AgNO3 溶液中,会形成AgOH 白色沉淀,当氨水过量时,NH3分子与Ag+形成[Ag(NH3)2]+配离子,配离子很稳定,会使AgOH 逐渐溶解,反应过程如下:Ag++NH3·H2O===AgOH↓+NH4+AgOH +2NH 3===[Ag(NH 3)2]++OH-[自我检测]1. 判断正误,正确的打“√”;错误的打“×”。




第2课时杂化轨道理论配合物理论学业要求素养对接1.能运用杂化轨道理论解释和预测简单分子的立体构型。
2.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。
微观探析:运用杂化轨道理论、配合物理论。
模型认知:根据杂化轨道理论确定简单分子的立体构型、根据配合物理论模型解释配合物的某些典型性质。
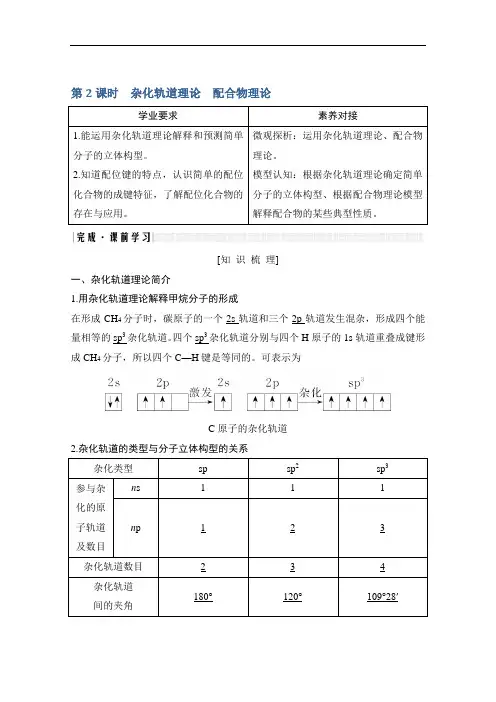
[知识梳理]一、杂化轨道理论简介1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为C原子的杂化轨道2.杂化轨道的类型与分子立体构型的关系杂化类型sp sp2sp3参与杂化的原子轨道及数目n s 1 1 1 n p 1 2 3杂化轨道数目 2 3 4 杂化轨道间的夹角180°120°109°28′杂化轨道示意图立体构型直线形平面三角形正四面体形实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4【自主思考】1.用杂化轨道理论分析CH4的杂化类型和呈正四面体形的原因?提示在形成CH4分子时,碳原子的一个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4个σ键之间作用力相等,键角相等形成正四面体形。
二、配合物理论简介1.配位键(1)概念:共用电子对由一个原子单方面提供而跟另一个原子共用的共价键,即“电子对给予-接受键”,是一类特殊的共价键。
(2)实例:在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
(3)表示:配位键可以用A→B来表示,其中A是提供孤电子对的原子,叫做配体;B是接受电子对的原子。
例如:①NH+4中的配位键表示为。

2020届高三化学选修三物质结构与性质常考题型——配位键和配合物键越强。
同时,中心原子的电荷数和配位数也会影响配位键的强弱。
4、配合物的稳定性:配合物的稳定性取决于配位键的强弱和配位数。
一般来说,配位键越强,配位数越大,配合物越稳定。
5、常见的配合物反应:1)配位键的形成和解离反应2)配合物的氧化还原反应3)配合物的置换反应6、配合物在实际应用中的作用:1)催化剂:如铂金催化剂、酶催化剂等2)药物:如金霉素、铁蛋白等3)染料:如紫外线吸收剂、荧光剂等4)其他:如氧气运输、水处理等在高三化学选修三中,物质结构与性质是一个重要的考试内容。
其中,配位键和配合物是经常出现的考题类型。
配位键是一种特殊的共价键,由一个原子提供孤电子对,另一原子提供空轨道而形成。
配合物是由中心原子和配位体组成的离子或分子,其中,中心原子一般是带正电荷的金属离子,而配位体则含有并提供孤电子对的分子或离子。
配合物在实际应用中有着广泛的作用,如催化剂、药物、染料、氧气运输等。
在研究过程中,需要掌握配位键和配合物的形成条件、强弱、稳定性以及常见的反应类型。
1、乙二胺能与金属离子形成配合物的原因是乙二胺提供孤对电子,金属离子提供空轨道。
其中与乙二胺形成的化合物稳定性相对较高的是Cu2+。
2、CuCl难溶于水但易溶于氨水的原因是氨提供孤对电子,与CuCl形成的配位键更强。
此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为[Cu(NH3)4]2+。
3、Co3在水中易被还原成Co2,而在氨水中可稳定存在的原因是氨提供孤对电子,与Co3形成的配位键更强。
4、对于中心离子为Hg2+等阳离子的配合物,配位体给出电子能力越强,则配位键就越强,配合物也就越稳定。
因此,HgI4^2-比HgCl4^2-更稳定,因为I元素的电负性比Cl元素大,I原子提供孤电子对的倾向更大,与Hg2+形成的配位键更强。
5、NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子。
教专题专题 4 分子空间结构与物质性质学单元第二单元配合物的形成和应用课节题第一课时配合物的形成题知识与技能〔1〕了解人类对配合物结构认识的历史〔2〕知道简单配合物的根本组成和形成条件教〔3〕了解配合物的结构与性质及其应用学过程与方法通过配位键作为配离子化学构型,构筑配合物结构平台的方目法逐渐深入地理解配合物的结构与性质之间的关系标情感态度通过学生认识配合物在生产生活和科学研究方面的广泛应与价值观用体会配位化学在现代科学中的重要地位,从而激发学生进一步深入地研究化学。
教学重点配合物结构和性质,配合物形成条件和过程实验解释教学难点配合物结构和性质,配合物形成条件和过程实验解释教学方法探究讲练结合教学准备教师主导活动学生主体活动[复习 ]教 1.以下微粒中同时有离子键和配位键的是4B、NaOH 3+D、MgOA、NH Cl C、H O学3+是H2O和+结合而成的微粒,其化学键属于P692. H O HA、配位键B、离子键C、氢键D、范德华力讨论后口答过[知识回忆 ]1.配位键2.杂化和杂化轨道类型程[导入 ]实验 1:硫酸铜中逐滴参加浓氨水实验 2:氯化铜、硝酸铜中逐滴参加浓氨水实验分析:[知识梳理 ]一、配合物的形成1、配合物: 由提供孤 子 的配体与接受孤 子 的中 察心原子以配位 合形成的化合物称 配位化合物 称 配合物。
理解 教 主 活 学生主体活2、配合物的 成从溶液中析出配合物 , 配离子 常与 有相反 荷的其他离子合成 , 称 配 。
配 的 成可以划分 内界和外界。
配离子属于内界, 配离子以外的其他离子属于外界。
内、外界之 以离子 合。
外界离子所 荷 数等于配离子的 荷数。
〔1〕中心原子:通常是 渡金属元素〔离子和原子〕 ,少数是非金属元素,例如: Cu 2+,Ag +,Fe 3+,Fe ,Ni ,B Ⅲ,P Ⅴ⋯⋯〔2〕配位体: 含孤 子 的分子和离子。
如:- ,OH -, CN -,H 2 ,3 , CO ⋯⋯ I O NH配位原子: 配位体中具有孤 子 的原子。

高中化学选修三判断配合物的配位数技巧与注意事项配合物的配位数是指直接同中心离子(或原子)配位的原子数目。
高中化学配合物的配位数可按如下方法判断:1.配合物的配位数等于配位原子及配位体的数目有两种情况:(1)配位原子数目、配位体数目、中心离子与配位原子形成的配位键键数均相等例如[Ag(NH 3 ) 2 ]NO 3 、[Cu(NH 3 ) 4 ]SO 4 、[Cu(H 2 O) 4 ] 2+ 、[Zn(NH 3 ) 4 ] 2+ 、K 3 [Fe(SCN) 6 ]、[FeF 6 ] 3- 、Ni(CO) 4 、Fe(CO) 5 、[Co(NH 3 ) 4 (H 2 O) 2 ]Cl 2 、[CrCl(H 2 O) 5 ]Cl 2 等配合物或配离子,它们配位体的数目以及中心离子与配位原子形成的配位键键数相等。
其中Ag+ 离子的配位数为2,Cu2+ 离子与Zn2+ 离子的配位数均为4,Fe3+ 离子的配位数为6。
Ni(CO)4 、Fe(CO)5 等羰基化合物中Ni、Fe 原子的配位数分别为4、5,[Co(NH 3 ) 4 (H 2 O) 2 ]Cl 2 、[CrCl(H 2 O) 5 ]Cl 2 中Co 2+ 离子与Cr 3+ 离子的配位数均为6。
(2)配位原子、配位体的数目均不等于中心离子与配位原子形成的配位键键数例如[BF 4 ] - 、[B(OH) 4 ] - 、[AlCl 4 ] - 、[Al(OH) 4 ] - 等配离子中,B、Al原子均缺电子,它们形成的化学键,既有共价键,又有配位键,配位数与配位键的键数不相等,配位数均为4。
又如Al 2 Cl 6 (下图)中Al原子的配位数为4。
再如酞菁钴的结构(下图),钴离子的配位数为4。
2.配位数等于配位原子的数目,但不等于配位体的数目存在多基配体时有这种情况,例如[Cu(en) 2 ]中的en是乙二胺(NH 2 CH 2 CH 2 NH 2 )的简写,属于双基配体,每个乙二胺分子有2个N 原子与Cu 2+ 离子配位,故Cu 2+ 离子的配位数是4而不是2。
《配合物》说课稿尊敬的各位评委、老师:大家好!今天我说课的内容是《配合物》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教学方法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析《配合物》是高中化学选修 3 物质结构与性质模块中的重要内容。
在此之前,学生已经学习了原子结构、分子结构等知识,为本节内容的学习奠定了基础。
本节教材主要介绍了配合物的概念、组成、形成条件以及一些常见的配合物。
通过对配合物的学习,学生能够更深入地理解物质的结构与性质之间的关系,进一步拓展对化学键的认识,为后续学习晶体结构等知识做好铺垫。
教材在内容编排上注重知识的系统性和逻辑性,通过实验探究、图表分析等方式,引导学生自主思考和探究,培养学生的科学思维和实验探究能力。
二、学情分析学生在之前的学习中已经具备了一定的化学基础知识和实验操作能力,但对于配合物这一较为抽象的概念,理解起来可能会有一定的困难。
因此,在教学过程中,需要通过生动形象的实例和实验,帮助学生建立起对配合物的直观认识。
此外,高中生已经具备了一定的逻辑思维能力和自主学习能力,但在分析问题和解决问题的能力上还有待提高。
在教学中,要注重引导学生进行思考和讨论,培养学生的创新思维和综合运用知识的能力。
三、教学目标1、知识与技能目标(1)理解配合物的概念,掌握配合物的组成。
(2)了解配合物的形成条件,能够书写常见配合物的化学式。
(3)认识一些常见的配合物,了解其在生产生活中的应用。
2、过程与方法目标(1)通过实验探究和观察分析,培养学生的实验操作能力和观察能力。
(2)通过对配合物形成过程的讨论和分析,培养学生的逻辑思维能力和分析问题的能力。
3、情感态度与价值观目标(1)激发学生学习化学的兴趣,培养学生的创新意识和探索精神。
(2)让学生体会化学知识在实际生活中的应用价值,增强学生对化学学科的热爱。
四、教学重难点1、教学重点(1)配合物的概念和组成。
(2)配合物的形成条件。
第2课时配合物的性质与应用[核心素养发展目标] 1.从微观角度理解配合物的形成对物质性质的影响。
2.了解配合物在生活、生产和科学实验中的应用。
一、配合物的形成对性质的影响1.颜色的改变当简单离子形成配离子时其性质往往有很大的差异。
颜色发生变化就是一种常见的现象,据此可以判断配离子是否生成。
如Fe3+与SCN-在溶液中可生成配位数为1~6的铁的硫氰酸根配离子(血红色),反应的离子方程式为Fe3++n SCN-===[Fe(SCN)n](3-n)+。
2.溶解度的改变一些难溶于水的金属氯化物、溴化物、碘化物、氰化物可以依次溶解于过量的Cl-、Br-、I -、CN-和氨中,形成可溶性的配合物。
(1)如难溶的AgCl可溶于过量的浓盐酸和氨水中,形成配合物,反应的离子方程式分别为AgCl+HCl(浓)===[AgCl2]-+H+;AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
(2)Cu(OH)2沉淀易溶于氨水中,反应的离子方程式为Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O。
3.溶液的酸碱性强弱的改变氢氟酸是一种弱酸,若通入BF3或SiF4气体,由于生成了HBF4、H2SiF6而使溶液成为强酸溶液。
配位体与中心原子配合后,可以使其酸性或碱性增强,如Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O碱性增强。
4.稳定性增强配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
例如,血红素中的Fe2+与CO分子形成的配位键比Fe2+与O2分子形成的配位键强,因此血红素中的Fe2+与CO分子结合后,就很难再与O2分子结合,血红素失去输送氧气的功能,从而导致人体CO中毒。
(1)中心原子和配位体之间通过配位键结合,一般很难电离。
(2)配位键越强,配合物越稳定。
当中心原子相同时,配合物的稳定性与配位体的性质有关。