第16章 氧族元素
- 格式:ppt
- 大小:3.28 MB
- 文档页数:116

元素化学测试题第⼗⼆章碱⾦属&碱⼟⾦属1、下列关于s区元素的性质叙述中,错误的是DA. 单质都有很强的还原性B. 碱⾦属及钙、锶、钡均可直接与H2作⽤⽣成⾦属氢化物C. K、Sr、Ba的硝酸盐可⽤于制作信号弹和烟花D. 单质均能溶于液氨⽣成蓝⾊的还原性溶液2、下列元素中,第⼀电离能最⼤的是AA. MgB. NaC. L iD. Be3、下列对溶解度⼤⼩判断正确的是DA. Be(OH)2> Mg(OH)2B. BaCrO4> MgCrO4C. LiF > LiClD.Na2CO3> NaHCO34、下列碳酸盐中,热稳定性最差的是BA. Li2CO3B. MgCO3C. Na2CO3D. K2CO35、下列各组氢氧化物的碱性强弱⽐较中,正确的是 CA.LiOH > NaOHB.Be(OH)2> LiOHC. Ba(OH)2 > Mg(OH)2D.Mg(OH)2> Ca(OH)26、下列物质中既能放出O2⼜能吸收CO2的是CA. H2O2B. K2CO3C. KO2D. KClO37、下列各对元素中,化学性质最相似的是D8、下列⾦属中,不适于⽤熔盐电解法制备的是BA.MgB.KC.LiD.Ba9、⾦属镁在空⽓中燃烧的⽣成物是 AA.MgO和Mg3N2B.MgO2C.MgO和MgO2D.MgO10、下列各组物质的熔点⾼低顺序错误的是DA. MgO > CaOB. CaO > NaFC. NaF > NaBrD. BeO > MgO第⼗三章硼族元素1. 下列化合物不属于缺电⼦化合物的是DA. BF3B. AlCl3C. B2H6D. H[BF4]2. 下列关于H3BO3的叙述中,错误的是BA. 中⼼B原⼦为sp2杂化B. H3BO3为三元弱酸C. H3BO3晶体具有解理性,可作为润滑剂D. H3BO3是典型的路易斯酸3. 下列叙述正确的是AA. 硼氧键的键能很⼤,使得硼可从许多稳定的氧化物中夺取氧B. 晶体硼的导电性随温度升⾼⽽减⼩,与⾦属导体相似C. 硼在空⽓中燃烧,只⽣成B2O3D. 硼在地壳中的矿藏丰富,包括游离态单质硼矿D. BI35. 下列关于硼氢化合物的叙述中,正确的是BA. ⼄硼烷还原性极强,但不易⽔解B. ⼄硼烷中的氢桥键为三中⼼⼆电⼦键C. ⼄硼烷中的B原⼦为sp2杂化,分⼦中存在三中⼼四电⼦⼤键D. 癸硼烷具有平⾯结构6. 下列氢氧化物不存在的是DA. Al(OH)3B. Ga(OH)3C. In(OH)3D. Tl(OH)37. 下列物质中,不属于两性氢氧化物的是DA. Be(OH)2B. Al(OH)3C. Ga(OH)3D. TlOH8. 硼酸盐Na2B4O7?10H2O的⽔溶液的pH最接近下列哪个数值?CA. 5.0B. 7.0C. 9.0D. 12.09. 下列元素中,不属于缺电⼦元素的是CA. ScB. AlC. GeD. V10. 下列⽆⽔卤化物可通过将其⽔合盐加热脱⽔⽽得到的是AA. CaCl2B. MgCl2C. BeCl2D. AlCl3A. +2氧化态的稳定性B. 单质的熔点C. ⼆氧化物的酸性D. 氢化物的稳定性2.下列叙述中,正确的是 CA. 碳和硅的单质在⾃然界中均可找到B. SiO2和单质Si在常温下均可与氢氟酸反应C. ⽯墨是⼀种典型的混合键型晶体D. 掺杂少量磷原⼦的晶体硅的内部结构中存在多余的空轨道,因此是良好的半导体材料3.下列各组分⼦或离⼦,空间构型不⼀致的是 CA. CO2和NO2+B. CO32?和NO3?C. CO2和NO2?D. CH4和SiH44.某⽩⾊固体易溶于⽔,加⼊BaCl2有⽩⾊沉淀产⽣,⽤HCl酸化,沉淀完全溶解,再加⼊过量NaOH⾄强碱性,并加热,有刺激性⽓体逸出。


⽆机化学第⼗六章氧族元素知识题第16章氧族元素16-1 写出下列物质的化学式。
(1)⽅铅矿;(2)朱砂;(3)闪锌矿;(4)黄铜矿;(5)黄铁矿;(6)芒硝;(7)海波;(8)保险粉解:(1)PbS (2)HgS (3)ZnS (4)CuFeS2 (5)FeS2 (6)Na2SO4·10H2O (7)Na2S2O3·5H2O(8)Na2S2O4·2H2O16-2 命名下列硫的含氧酸及盐。
(1)K2S2O7;(2)H2SO5;(3)K2S2O8;(4)Na2S2O3·5H2O;(5)Na2S2O4;(6)Na2SO3;(7)Na2S4O6;(8)Na2SO4·10H2O 解:(1)焦硫酸钾(2)过⼀硫酸(3)过⼆硫酸钾(4)五⽔合硫代硫酸钠(俗称海波)(5)连⼆亚硫酸钠(6)亚硫酸钠(7)连四硫酸钠(8)⼗⽔合硫酸钠(俗称芒硝)16-3 完成并配平下列反应⽅程式。
(1)H2S+ClO3-+H+ ------(2)Na2S2O4+O2+NaOH------(3)PbO2+H2O2 ------(4)PbS+H2O2 -------(5)S+NaOH(浓)------(6)Cu+H2SO4(浓)------(7)H+H2SO4(浓)------(8)H2S+H2SO4(浓)------(9)SO2Cl2+H2O------(10)HSO3Cl+H2O------解:(1)5H2S + 8ClO3- === 5SO42- + 2H+ + 4Cl2 +4H2O (2)Na2S2O4 + O2 +2NaOH === Na2SO3 + Na2SO4 + H2O (3)PbO2+H2O2 === PbO + H2O + O2↑(4)PbS+4H2O2 === PbSO4 + 4H2O(5)3S + 6NaOH(浓) === 2 Na2S + Na2SO3 + 3H2O (6)Cu +2H2SO4(浓) === CuSO4 + SO2↑+ 2H2O(7)S + 2H2SO4(浓) === 3SO2↑+2 H2O(8)H2S + H2SO4(浓) === S↓+ SO2+ 2H2O(9)SO2Cl2+2H2O === H2SO4+2HCl(10)HSO3Cl+H2O === H2SO4+HCl16-4 完成下列各反应的化学⽅程式。

第十三章氧族元素内容提要本章主要介绍氧气、臭氧、过氧化氢,硫化物、多硫化物,二氧化硫和亚硫酸盐,三氧化硫和硫酸盐,硫代硫酸盐、连二亚硫酸盐、过二硫酸盐、连多硫酸盐,硫的卤氧化物等化合物的结构、性质和用途;对硒和碲及其化合物只作简介。
15-1 氧族元素的通性15-1-1 氧族存在氧族元素包括氧、硫、硒、碲、钋五种元素。
氧是地球表面丰度最大的元素。
氧构成了大气质量的23%,岩石质量的46%,水质量的85%以上。
硫占地壳质量的0.034%,元素丰度序列中第16位,火山多发地区含有单质硫,天然气中的H2S、原油和煤中的有机硫化合物、硫铁矿及其它重金属硫化物矿、硫酸盐矿(石膏和重晶石矿)。
另外硫还存在于植物、动物的蛋白质中。
硒和碲共生于金属硫化物矿中,制备硒和碲的主要原料是电解法精炼铜的阳极泥和焙烧硫化物矿的烟道气尘。
钋,是居里夫人在铀矿和钍矿中发现的放射性元素。
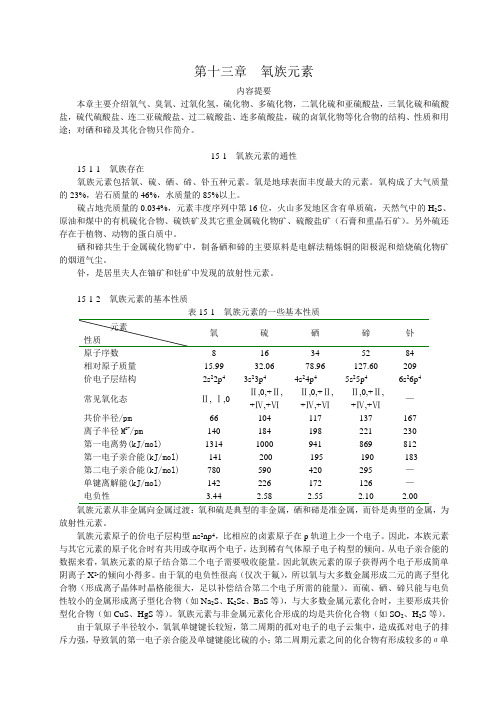
15-1-2 氧族元素的基本性质表15-1 氧族元素的一些基本性质原子序数8 16 34 52 84相对原子质量15.99 32.06 78.96 127.60 209价电子层结构2s22p43s23p44s24p45s25p46s26p4常见氧化态-Ⅱ,-Ⅰ,0 -Ⅱ,0,+Ⅱ,+Ⅳ,+Ⅵ-Ⅱ,0,+Ⅱ,+Ⅳ,+Ⅵ-Ⅱ,0,+Ⅱ,+Ⅳ,+Ⅵ—共价半径/pm66 104 117 137 167离子半径M2-/pm140 184 198 221 230第一电离势(kJ/mol)1314 1000 941 869 812第一电子亲合能(kJ/mol)-141 -200 -195 -190 -183第二电子亲合能(kJ/mol) 780 590 420 295 —单键离解能(kJ/mol) 142 226 172 126 —电负性 3.44 2.58 2.55 2.10 2.00氧族元素从非金属向金属过渡:氧和硫是典型的非金属,硒和碲是准金属,而钋是典型的金属,为放射性元素。

无机化学第二章答案【篇一:大学无机化学第二章(原子结构)试题及答案】txt>本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立学会讨论氢原子的玻尔行星模型e?第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(??2:学习运用不确定原理(?x??p?第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2;掌握核外电子排布的三个原则:1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低○的院子轨道。
2pauli原则——在同一原子中没有四个量子数完全相同的电子,或者说是在○同一个原子中没有运动状态完全相同的电子。
3hund原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式○hh)。
?pmv13.6ev。
n2h)。
2?m分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1从左向右,随着核电荷的增加,原子核对外层电子的吸引1:原子半径——○2随着核外电子数的增加,电子间的相互斥力力也增加,使原子半径逐渐减小;○也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。
化学组成物质的化学元素教案(沪教版)第一章:化学元素的基本概念1.1 元素的概念与命名介绍元素的概念,理解元素是构成物质的基本单位。
学习元素的命名规则,掌握元素名称与符号的对应关系。
1.2 元素周期表介绍元素周期表的构成,理解周期表中元素的排列规律。
学习周期表中常用的一些特殊标记,如金属、非金属、半金属的区分。
第二章:元素的原子结构与周期性2.1 原子结构的基本理论介绍原子的组成,理解原子核和电子云的概念。
学习原子的电子排布,掌握能级、轨道的概念。
2.2 元素周期律学习元素周期律的原理,理解周期表中元素周期性的体现。
掌握同一周期、同一族元素的性质变化规律。
第三章:化学键与化合物的类型3.1 化学键的基本概念介绍化学键的类型,理解离子键、共价键、金属键的区别。
学习化学键的形成与断裂过程。
3.2 化合物的类型学习离子化合物、共价化合物、金属化合物的特点与区别。
掌握一些常见的化合物类型及其应用。
第四章:元素的存在与分布4.1 元素在地壳中的分布学习地壳中元素的分布规律,理解地壳中元素含量的排序。
掌握一些重要元素的地质来源。
4.2 元素在生物体中的存在与作用学习生物体中元素的分布与作用,理解生物体对元素的摄取与利用。
掌握一些对人体健康重要的微量元素。
第五章:元素的主要化合物及其性质5.1 氧化物学习氧化物的概念,理解氧化物的分类与命名。
掌握一些常见的氧化物及其性质。
5.2 酸碱盐学习酸碱盐的概念,理解酸碱盐的分类与命名。
掌握一些常见的酸碱盐及其性质。
化学组成物质的化学元素教案(沪教版)第六章:金属元素6.1 碱金属学习碱金属的特性,理解它们在周期表中的位置。
掌握碱金属(如锂、钠、钾等)的物理和化学性质。
6.2 碱土金属介绍碱土金属的特点,理解它们在周期表中的排列。
学习碱土金属(如镁、钙、锶等)的典型化合物及其性质。
第七章:非金属元素(上)7.1 卤族元素学习卤族元素的基本概念,理解它们的原子结构。
掌握卤素(如氟、氯、溴等)的物理和化学性质。
无机化学练习题(含答案)第1章原子结构与元素周期系1-1试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-2Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
1-3氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5什么叫惰性电子对效应?它对元素的性质有何影响?1-6当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121.6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1键可由-、-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的键分别属于哪一种?2-2NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
第三章氧族元素VIA (16)83209Bi+1n83210Bi84210Po+-10e82206Pb+ O (Oxygen) S (Sulfur)Se (Selenium) Te (Tellurium) Po(Polonium)本章要点:1.掌握氧的成键特征;2.掌握氧、臭氧、过氧化氢的结构、性质和用途;3.掌握硫的成键特征;4.掌握硫的各种氧化态的重要化合物的结构、性质、制备和用途, 以及相互转化关系。
§3-1 氧族元素在自然界的存在形式O: 单质(O 2 、O 3)和化合态S: 单质和化合态Se, Te:分布于金属硫化物矿中自然硫黄碲矿(墨西哥)自然碲§3-2 氧族元素的通性一、氧族元素的物理性质•元素O S Se Te •电子构型:[2e][8e] [18e] [18e]2s22p4 3s23p4 4s24p4 5s25p4•常见氧化态-2,-1,0 -2,0,+2 -2,0,+2-2,0,+2+4,+6 +4,+6+4,+6•电负性 3.44 2.58 2.55 2.10•共价半径/pm 66 104 117 137•M2-离子半径/pm 140 184 198 221§3-3 氧及其化合物空气的组成CO 2O 2ArN 2沸点/K 194.7 90.1 87.2 77.2一、氧气的制备1.实验室制法2 KClO 32 KCl +3 O 22. 工业制法---液态空气的分馏MnO 2空气的分离:•气态空气加压力,冷却液化空气+CO(s)2•77K,精馏液化空气+ N(g)2•87.2K, 精馏液化空气+ Ar(g)•90.1K, 精馏O(g)2•O2+ Pt + 3 F2= O2+[PtF6]-O2+ PtF6= O2PtF6•O2的第一电离势:1175.7kJ/mol •Xe的第一电离势:1171.5 kJ /mol •第一个稀有气体化合物•Xe+PtF6= Xe+[PtF6]-基态O2,O2+, O2-, O22-的电子结构分子/离子能级键级磁性例O2KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4 (π2p*)2 2 顺O2O2+KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4 (π2p*)1 2.5 顺O2[PtF6]O2-KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4 (π2p*)3 1.5 顺KO2O22-KK(σ2s)2(σ2s*)2(σ2p)2(π2p)4 (π2p*)4 1 逆Na2O2三、氧气的化学性质1.强氧化性2.生成氧化物,过氧化物,超氧化物O+,含氧酸中的配位键,3.配位性: H3与血红素的二价铁络合•激发单线态氧分子在水溶液中的寿命:寿命:10-6~10-5s ,能量差:+ 92.0kJ/mol :寿命:10-9 s, 能量差:+154.8 kJ/mol )O (Δ21g 1∑+g 211)O (•单线态氧生成:光敏化法, 微波放电, 化学方法五、臭氧(Ozone )1. O2的同素异形体----O 32. 大气臭氧层的光化学平衡(高度20~40 km)形成: O 2+ h νO + OO + O 2 O 3消除: O 3+ h νO + O 2λ<185 nm λ= 220~320 nm 平衡:3. 大气层中臭氧空洞的形成•CF2Cl2+ hνCF2Cl ∙+ Cl∙Cl∙+ O3ClO∙+ O2ClO∙+ O Cl∙+ O2•NO2+ hνNO + ONO + O3NO2+ O2NO2+ O NO + O2λ<221 nmλ<426 nm4. 臭氧的化学性质-----氧化性比氧气更强2PbS + 3 O2= 2 PbO+ 2 SO2PbS+ 2 O3= Pb SO4+ O2CN-+O3 = OCN-+O2O2和O3的混合气体中O3浓度的测定:pH=9O3 + 2I-+ H2O = O2 + I2+ 2OH-路易斯结构式:O 3的化学键结构•2σ+ 1 ∏43•2σ:O (2) sp 2+ O (1) p yO (2) sp 2+ O (3) p y•1 ∏43:O (1) p z + O (2) p z + O (3) p z •∏34的键级=1平均每一个O-O 键的键级=1.56.离域∏p-p 键定义:含有三个或三个以上原子的π键叫离域π键,用表示,n代表原子数,m代表电子数.离域∏p-p 键生成的条件:a . 成键原子必须在同一个平面上, 或在同一条直线上.b. 具有π对称性的原子轨道,线形组合成具有π对称性的分子轨道。
第14章卤素14-2氟在本族元素中有哪些特殊性?氟化氢和氢氟酸有哪些特性?2、解:(1)由于F的半径特别小,故F2的离解能特别小,F-的水合热比其他卤素离子多。
(2)HF分子间存在氢键,因而HF分子的熔沸点和汽化热特别高。
(3)AgF为易溶于水的化合物。
(4)F2与水反应产物复杂。
(5)HF是一弱酸,浓度增大,酸性增强。
(6)HF能与SiO2或硅酸盐反应,生成气态SiF4;14-4根据电势图计算在298K时,Br2在碱性水溶液中歧化为Br-和BrO3-的反应平衡常数。
4、解:由公式:-ZFE=-RTlnK得:K=exp(ZFE/RT)=2.92×103814-5 三氟化氮NF3(沸点-129℃)不显Lewis 碱性,而相对分子质量较低的化合物NH3(沸点-33℃)却是个人所共知的Lewis 碱。
(a)说明它们挥发性差别如此之大的原因;(b)说明它们碱性不同的原因。
5、解:(1)NH3有较高的沸点,是因为它分子间存在氢键。
(2)NF3分子中,F原子半径较大,由于空间位阻作用,使它很难再配合Lewis酸。
另外,F原子的电负性较大,削弱了中心原子N的负电性。
14-9 如何鉴别KClO﹑KClO3和KClO4这三种盐?9、解:分别取少量固体加入干燥的试管中,再做以下实验加入稀盐酸即有Cl2气放出的是KClO;KClO+2HCl=KCl+Cl2+H2O加入浓盐酸有Cl2与放出且溶液变黄的是KClO3;8KC1O3+24HCl(浓)=9Cl2↑+8KCl+60ClO2(黄)+12H2O另一种则为KClO414-12利用电极电势解释下列现象:在淀粉碘化钾溶液中加入少量NaClO 时,得到蓝色溶液A,加入过量NaClO 时,得到无色溶液 B ,然后酸化之并加少量固体Na2SO3于B 溶液,则A的蓝色复现,当Na2SO3过量时蓝色又褪去成为无色溶液C ,再加入NaIO3溶液蓝色的A 溶液又出现。
指出A﹑B﹑C各为何种物质,并写出各步的反应方程式。