纯化水微生物限度检查法验证方案和验证报告.(DOC)
- 格式:docx
- 大小:44.58 KB
- 文档页数:22

*************有限公司文件编码:纯化水系统验证报告编制:审核:批准:年月日验证文件审批表文件编码:目录1.概述1)纯化水系统流程图2)制定依据2.验证目的3.职责1)验证委员会2)质保部3)工程部4)质检中心5)106车间4.验证内容1)纯化水系统安装确认2)纯化水系统运行确认3)纯化水系统性能确认4)纯化水系统清洁与消毒的确认5)纯化水系统过滤器滤芯更换周期的确认5.再验证周期6.验证记录一、概述本设备由******公司生产制造。
该公司是国家定点生产制水设备的企业。
我公司购置的纯化水系统由原水罐、原水泵、多介质过滤器、活性炭过滤器、加药系统(阻垢剂)、精密过滤器(滤芯为5微米)、1#高压泵、一级RO主机、中间储罐、加药系统(NaOH)、2#高压泵、二级RO主机、紫外线灭菌器、纯化水储罐和纯化水水泵等组成。
该纯化水系统可自动运行也可手动运行。
待纯化水罐水位处于高水位触点时系统自动停机,一旦纯化水罐处于低水位时系统又自动制水,反复循环。
原水罐水位过低或纯水罐水位过高,系统也会自动报警和停机。
1、主要技术参数2、制定依据《药品生产质量管理规范》(1998年修订)、《RO系列二级反渗透水处理机组使用说明书》和《中国药典》2005版二、验证目的为保证制备的纯化水符合《中华人民共和国药典》2005年版中纯化水的标准,证明制水系统在已有的或未来的操作情况下,工艺用水的质量与预期设计的相一致,能够稳定地生产出一定数量和质量且达到生产工艺要求的合格纯化水。
确认制定的“纯化水系统清洁和消毒规程”正确可靠性。
三、职责1)验证委员会a.负责验证方案的审批。
b.负责验证的协调工作,以保证本验证方案规定项目的顺利进行。
c.负责验证数据及结果的审核。
d.负责验证报告的审批。
e.负责发放验证证书。
f.负责再验证周期的确认。
2)质保部a.负责拟订验证方案。
b.负责组织检测用仪器的校正。
c.负责验证工作的具体组织实施。

微生物限度检查检验方法验证报告
方案编制年月日方案审核年月日方案批准年月日
上海美宝生命科技有限公司
7
7.1试验样品
确认人:日期:
7.2 产品试验组微生物生长情况:批号:
检验人:日期:复核人:日期:7.3 供试品对照组微生物生长检查情况:批号:
检验人:日期:复核人:日期:
7.4 稀释剂对照组微生物生长检查情况:批号:
检验人:日期:复核人:日期:7.5 菌液组微生物生长检查情况:批号:
检验人:日期:复核人:日期:
7.6稀释剂对照组菌回收率计算
检验人:日期:复核人:日期:7.7 试验组菌回收率计算
检验人:日期:复核人:日期:
7.8 结果说明
经过验证,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉的回收率分别为: %、 %、 %、 %、 %。
稀释剂回收率为: %、 %、 %、 %、 %。
7.9 结论
以上验证结果证明,本品(适合/不适合)采用上述方法进行微生物限度检查。
附录。

纯化水微生物限度滤膜法微生物检测:将适当孔径的滤膜放入滤器,过滤样品,由于滤膜的作用而将微生物保留在膜的表面上。
样品中微生物生长抑制剂可在过滤后用无菌水冲洗滤器而除去。
然后,将滤膜放在培养基上培养,营养物和代谢物通过滤膜的微孔进行交换,在滤膜表面上培养出的菌落可以计数,并和样品量相关。
滤膜法的优点:- 与直接法比较,可以检测大量的样品- 浓缩效应使微生物检测的准确度提高- 带有菌落的滤膜,可作为检测的永久记录存档- 可见的菌落和样品量直接对应,得出定量结果操作具体一点就是:薄膜过滤法检测,一个样过滤一份,就是200ml的纯化水通过滤膜,将该滤膜浸泡在灭菌好的l生理盐水中,再接种到平皿中,制成10级、100级、1000级稀释倍数的细菌、霉菌和酵母菌稀释培养皿,即可用平皿法检测纯化水的微生物限度摘要:目的探讨平皿法检查纯化水微生物限度的可行性。
方法采用《中华人民共和国药典》2005年版二部附录平皿法和薄膜过滤法同时时纯化水进行微生物限度检壹并作出比较。
结果平皿法操作简便,菌落清晰.准确可靠。
结论平皿法检测纯化水微生物限度是可行的,尤其适用药厂、医院开展此项检验。
关键词;纯化水;微生物限度;平皿法;薄膜过滤法纯化水为蒸馏法、离子交换法、反渗透法或其它适宜的方法制得的供药用的水,不含任何附加剂。
纯化水的优劣,直接关系到药品质量。
《中华人民共和国药典》2005年版规定其微生物限度检查采用薄膜过滤法。
并规定其细菌、霉菌和酵母菌总数每毫升不得过100个。
由于此法操作较繁,滤膜较小(直径只有50mm),菌落多时清晰度欠佳,影响计数的准确性。
笔者采用平皿法进行比较,该法操作简便,菌落清晰,计数准确,效果较为理想。
1 材料和仪器1.1 样品来源 19批纯化水系辖区内7家制药厂生产的为微生物限度检查验证用送样检品。
其中用盐水瓶盛装的12个批次,三角烧瓶盛装的7个批次。
1.2 培养基和仪器设备1.2.1 培养基:营养琼脂培养基批号050401,玫瑰红钠琼脂培养基批号050202,蛋白胨批号050523均为北京三药科技开发公司生产。

VM-1-2001-00 纯化水系统验证方案目录1.验证方案的起草与审批1.1验证方案的起草1.2验证方案的审批2.验证小组的组成及进程安3.概述4.验证目的5.文件6.检测仪器7.安装确认7.1主要设备的安装确认7.1.1设备概况7.2仪器、仪表检查7.3公用介质安装及检查7.3.1自来水安装及检查7.3.2电源连接检查8.运行测试9.监控10.日常监测11.最终评价和建议及验证报告1.验证方案的起草与审批3.概述本纯化水系统是由机械过滤器、活性碳过滤器、保安过滤器、反渗透装置、紫外线灭菌和终端过滤器组成。
其中反渗透装置是最新膜分离技术,能将原水中的离子、细菌等分离排除,获得符合中国药典标准规定的纯化水,本系统的生产能力为1T/h。
4.验证目的4.1检查并确认工艺用纯水系统设备安装符合设计要求,资料和文件符合GMP的管理要求。
4.2检查并确认主设备及管路分配系统、泵、阀门及贮罐等设备的运行性能达到设计要求,确保产水水质到达《中国药典》2010年版二部纯化水项下要求。
4.3检查并确认各独立单元设备出水量、水质达到设计要求,并能与生产规模相适应。
7.安装确认7.1主要设备的安装确认7.1.1设备概况目的:检查并确认主要设备的随机文件和资料以及附件符合使用和管理要求。
依据设备的装箱清单确认,随机附件及文件资料,检查主要设备安装是否布局合理;是否便于操作;是否利于监控。
检查结果于表中并作出评价主要设备概况检查记录表7.2仪器、仪表检查目的:检查并确认仪器仪表外观、性能、精度等符合规定要求。
检查:7.3公用介质安装及检查依据系统安装图的设计要求,检查系统安装的位置和空间能满足生产和维修的需要;各介质连接是否匹配,符合管理及安装规范要求。
7.3.1自来水连接及检查按设计要求检查自来水连接情况,记录于表中7.3.2电源连接检查7.4管路、管道分配系统、泵、阀门的安装及检查7.4.1验证目的:依据设计图纸及技术资料,检查各独立单元、安装是否符合设计和规范。
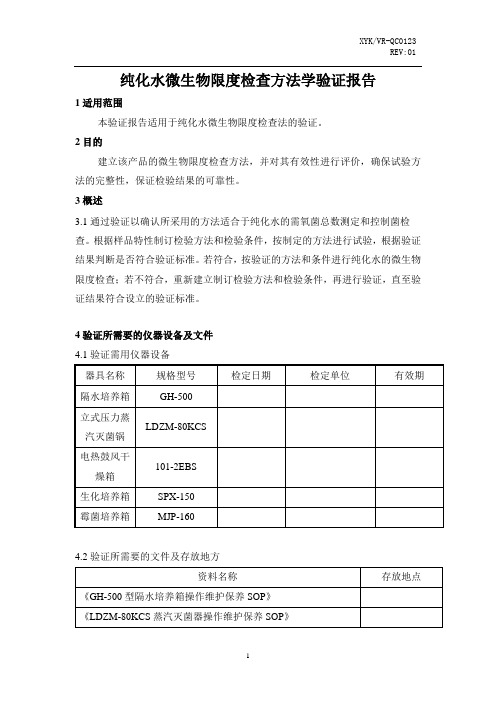
纯化水微生物限度检查方法学验证报告1适用范围本验证报告适用于纯化水微生物限度检查法的验证。
2目的建立该产品的微生物限度检查方法,并对其有效性进行评价,确保试验方法的完整性,保证检验结果的可靠性。
3概述3.1通过验证以确认所采用的方法适合于纯化水的需氧菌总数测定和控制菌检查。
根据样品特性制订检验方法和检验条件,按制定的方法进行试验,根据验证结果判断是否符合验证标准。
若符合,按验证的方法和条件进行纯化水的微生物限度检查;若不符合,重新建立制订检验方法和检验条件,再进行验证,直至验证结果符合设立的验证标准。
4验证所需要的仪器设备及文件4.1验证需用仪器设备4.2验证所需要的文件及存放地方5可接受的限度范围标准5.1纯化水微生物限度检查质量标准5.2计数方法适用性试验结果判断在3次独立的平行试验中,采用薄膜过滤法,若菌液对照组生长菌落符合要求,阴性对照组无菌落生长且试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值应在0.5~2范围内;若各试验菌的回收试验均符合要求,照所用的供试液制备方法及计数方法进行该供试品的需氧菌总数计数。
5.3控制菌检查方法验证结果判断在3次独立的平行试验中,采用薄膜过滤法,若阳性对照组检出试验菌(检出试验菌判断如下 5.3.1 5.3.2 5.3.3 5.3.4),阴性对照组未检出试验菌且实验组检出试验菌(检出试验菌判断如下 5.3.1 5.3.2 5.3.3 5.3.4)按此供试液制备法和控制菌检查法进行供试品的该控制菌检查;若试验组未检出试验菌,应采用其他方法消除供试品的抑菌活性,并重新进行验证。
5.3.1大肠埃希菌检查方法适用性试验结果判断若麦康凯琼脂培养基平板上有菌落生长,应进行分离、纯化及适宜的鉴定试验,确证是否为大肠埃希菌;若麦康凯琼脂培养基平板上没有菌落生长,或虽有菌落生长但鉴定结果为阴性,判供试品未检出大肠杆菌。
5.3.2沙门氏菌检查方法适用性试验结果判断若木糖赖氨酸脱氧胆酸盐琼脂培养基平板上有疑似菌落生长,且三糖铁琼脂培养基的斜面为红色、底层为黄色,或斜面黄色、底层黄色或黑色,应进一步进行适宜的鉴定试验,确证是否为沙门菌。

微生物限度检查方法验证——纯化水的微生物限度检查方法验证验证方案制定人:部门:日期:验证方案审核人:部门:日期:验证方案批准人:部门:日期:1验证目的:当建立纯化水的微生物限度检查法时,应进行细菌、霉菌和酵母菌检查方法的验证,以确认所采用的方法适合于纯化水的细菌、霉菌和酵母菌检查。
2验证方案:照《中国药典》2005版二部附录Ⅺ J 方法。
2.1仪器与试药2.1.2仪器:STV3无菌检查薄膜过滤器(浙江宁海白石药检仪器厂),微孔滤膜(孔径0.45um,直径50mm)。
2.1.3试药:2.1.4培养基:营养琼脂培养基,玫瑰红钠琼脂培养基,营养肉汤培养基。
来源:北京三药科技开发公司生产中国药品生物制品检定所监制2.1.5试液:生理盐水,pH7.0氯化钠-蛋白胨缓冲液。
(均按照《中国药典》2005版二部附录Ⅺ H、J要求配制)2.1.6对照菌株:大肠埃希菌[CMCC(B) 44 102]、金黄色葡萄球菌[CMCC(B) 26 003]、枯草芽孢杆菌[CMCC(B) 63 501]、白色念珠菌[CMCC(F) 98 001]、黑曲霉 [CMCC(F) 98 003]。
来源:广州药物研究中心2.2对照菌液的制备:取大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的营养琼脂斜面新鲜培养物各1环分别接种于15ml 营养肉汤培养基内,于30~35℃培养18~24小时后,稀释至1:105~1:107,,取1ml注入平皿中,注入约45℃的营养琼脂培养基约15ml,混匀,凝固后置30~35℃培养48h,进行活菌计数。
取白色念珠菌的玫瑰红钠琼脂斜面新鲜培养物1环接种于改良的马丁琼脂培养基内,于25~28℃培养24~48小时后稀释至1:105~1:106,取1ml注入平皿中,注入约45℃的玫瑰红钠琼脂培养基约15ml,混匀,凝固后置25~28℃培养72h,进行活菌计数。
取黑曲霉的玫瑰红钠琼脂新鲜培养物1环接种于改良的马丁琼脂培养基内斜面中,于25~28℃培养5~7天后,用3~5ml0.9%的无菌氯化钠溶液洗脱。
苏州东瑞制药有限公司AVR-MLT-PW纯化水微生物限度版本号:00纯化水微生物限度检查分析方法验证报告苏州东瑞制药有限公司AVR-MLT-PW 纯化水微生物限度版本号:00下面表格的签署表明该文件已经被审核和批准。
修订历史苏州东瑞制药有限公司AVR-MLT-PW 纯化水微生物限度版本号:00目录1.确认结论 (4)1.1过程描述 (4)1.2分析方法确认结论 (5)2.测试数据表及附件 (6)2.1测试数据表 (6)2.2附件 (7)苏州东瑞制药有限公司AVR-MLT-PW纯化水微生物限度版本号:001.确认结论1.1过程描述备注____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________苏州东瑞制药有限公司AVR-MLT-PW 纯化水微生物限度版本号:001.2分析方法确认结论通过验证,该分析方法是否适用于纯化水的细菌、霉菌及酵母菌数的测定:□适用□不适用评价和建议____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________ ____________________________________________________________________________苏州东瑞制药有限公司AVR-MLT-PW纯化水微生物限度版本号:002.测试数据表及附件2.1测试数据表苏州东瑞制药有限公司AVR-MLT-PW 纯化水微生物限度版本号:00 2.2附件。
纯化水微生物限度检查方法验证方案产品名称:纯化水验证类型:验证部门:质量部目录1、概述2、验证目的3、适用范围4、验证小组成员及职责5、验证项目6、验证内容7、验证总结论8、偏差处理情况9、再验证周期10、结果审批及综合评价11、参考文献验证方案签字表1、概述纯化水作为我公司的一种用于产品生产的原辅料及清洁用水,为保证产品的质量,应对纯化水进行微生物限度检查方法的确认,参照《中国药典》2015年版二部纯化水微生物限度的要求,重新建立微生物限度检查的试验,以确认改产品在该试验条件下所采用的方法适合于该产品的微生物限度检查。
2、验证目的按照《中国药典》2015年版规定对纯化水微生物限度检查采用薄膜过滤法进行试验,在现有检验程序、检测条件及培养条件下,通过试验以确认所采用的方法适合于纯化水需氧菌总数的测定;3、适用范围本验证方案适用于本公司 QC 实验室,对纯化水微生物限度检查方法(薄膜过滤法)适用性的验证。
4、验证小组成员及职责5、验证项目及描述5.1项目:需氧菌总数检查方法的验证5.2 描述取三个不同批号的纯化水用薄膜过滤法检测微生物限度,通过比较试验菌的恢复生长结果评价整个检验方法的准确性、有效性,通过计算回收率来判断检查方法是否有影响,通过验证来确认薄膜过滤法适合于纯化水需氧菌总数的测定。
三次试验中,稀释剂对照回收率应在 50%~200%范围内,试验组回收率也应在 50%~200%范围内。
进行微生物限度检查方法(薄膜过滤法)验证时,所有的平皿和稀释剂都应该严格灭菌消毒、灭菌,确保对试验结果没有影响。
6、验证内容:6.1 人员培训、仪器设备、培养基、菌种及相关文件的确认6.1.1人员培训6.1.2验证用仪器设备的确认6.1.3相关文件确认6.1.4 试验用菌株的确认6.1.5培养基及冲洗液的确认6.2试验步骤6.2.1.菌液的制备取铜绿假单胞菌、枯草芽孢杆菌工作用菌种挑取少量培养物接种至10ml胰酪大豆胨液体培养基中,30~35℃培养18~24小时。
该方案制定参与人:目录1. 引言 (01)2. 验证小组及各部门职责 (01)3. 检验依据 (01)4. 验证准备 (01)5. 操作方法 (02)6. 结果判断 (04)7. 结果统计 (04)8. 结果评定与结论 (04)附表1:设备确认记录 (05)附表2:试验器材确认记录 (05)附表3:试验用菌种确认记录 (06)附表4:培养基确认记录 (06)附表5:试剂确认记录 (07)附表6:器皿确认记录 (07)附表7:细菌数、霉菌数、酵母菌数计数验证结果原始记录 (08)1.1概述不同检品、不同的仪器或材料等均可能对检验结果产生影响,当检品有抑菌性时,会掩盖检品已受污染的事实或造成低于实际污染水平的检测结果;选用不适当的培养基,其促生长能力不符合要求,也会造成类似的后果。
为了使微生物限度检验方法的结果准确可靠,需要对检品的具体检验方法进行验证,以证明其对检品的适用性。
1.1OverviewDifferent samples, equipments and different materials ,as well as inappropriate media that the Growth-promoting capacity does not meet the requirements may have an impact on the test results, when the samples have antimicrobial activity,it will cover up the fact that inspected products have been contaminated or cause the pollution levels lower than the actual; To make the results of bioburden testing accurate and reliable,the methods need to be validated ,ensuring its applicability1.2 目的建立纯化水微生物限度检查方法。
公用工程验证方案* * * *制药厂目录1.验证方案的起草与审批1.1验证方案起草1.2验证方案的审批2.概述3.验证人员4.时间进度表5.验证目的6.验证内容6.1安装确认6.1.1文件资料6.1.2设备6.1.3管道分配系统6.1.4.公用介质6.1.5.安装确认小结6.2运行确认6.2.1检查并保证设备可运行6.2.2树脂再生处理6.2.3管道的清洗、钝化、消毒6.2.4运行检查6.2.5运行确认小结6.3性能确认6.3.1制水能力的确定6.3.2纯化水系统的监控及清洗周期的确定6.3.3性能确认小结7.再验证1验证方案的起草与审批1.1验证方案的起草1.2验证方案的审批2.概述该系统由机械过滤器、活性炭过滤器、精密过滤器、反渗透装置、混合床交换柱、纯水罐、紫外灭菌器、微孔过滤器、不锈钢循环管道组成,设计制水能力为0.5m3/h,满足生产各工序、岗位对纯化水的需求。
3.验证人员厂房设施、公用工程验证小组人员组成:4.时间进度表2001年9月1日至9月3日完成系统安装、运行确认;2001年9月3日至10月22日完成性能确认;2001年10月22日至10月25日数据汇总分析、完成验证报告。
5.验证目的(1)检查并确认纯化水系统安装符合设计要求,资料文件符合GMP管理规定。
(2)确认纯化水系统的运行性能符合设计及生产工艺要求。
(3)确认纯化水系统能稳定地供应规定数量和质量的合格用水。
6.验证内容6.1安装确认6.1.1文件及资料检查人:日期:6.1.2设备(1)设备材质检查人:日期:(2)仪表检查人:日期:(3)过滤材料检查人:日期:(4)树脂检查人:日期:6.1.3管道分配系统管道材质检查人:日期:6.1.4公用介质(1)电源检查人:日期:(2)原水检查人:日期:(3)压缩空气检查人:日期:6.1.5安装确认小结:小结人:日期:6.2运行确认6.2.1检查并保证设备可运行检查人:日期:6.2.2树脂再生处理操作人:日期:6.2.3管道的清洗、钝化、消毒①纯水循环预冲洗:利用纯水罐和纯水泵,与需处理的管道连成一个循环通路,在纯水罐中注入足够的常温纯化水,用水泵加以循环,15min后打开排水阀,边循环边排放;②碱度清洗:准备氢氧化钠化学纯试剂,加入热水(温度不低于70℃)配制成1%的碱液,用泵进行循环,时间为45min,然后排放;③冲洗:纯化水加入纯水罐,启动水泵,打开排水阀排放,直到各出口点水的电阻率与纯化水的电阻率一致;④钝化:用纯化水及化学纯的硝酸配制8%的酸液,循环60min后排放;⑤冲洗:用常温纯化水冲洗,直到各出口点水的电阻率与纯化水的电阻率一致;⑥消毒:用纯化水和化学纯的次氯酸钠溶液配制成50ppm(按活性氯计算)的消毒液,打循环将整个管道系统消毒30min后排放;⑦冲洗:用常温纯化水冲洗,直到各出口点水的电阻率与纯化水的电阻率一致;⑧填写好记录(见附表1)。
******* 有限公司验证文件纯化水微生物限度检查法验证方案纯化水微生物限度检查法验证方案起草、审核、批准:验证组织:目录1. 验证目的2. 验证人员职责3. 参照标准4. 验证项目内容5. 评价合格标准6. 验证试验材料7. 验证实施计划8. 菌液制备9. 供试液制备10. 计数方法验证11. 控制菌检查方法验证12. 验证结论和评价纯化水微生物限度检查法验证方案1. 验证目的:纯化水微生物限度试验采用薄膜过滤法检查。
确认该方法适合于纯化水细菌、霉菌及酵母菌数测定,控制菌的测定。
2.验证人员职责2.1 验证领导小组:2、1、1 负责验证方案及报告的批准2、1、2 组织协调验证工作2、1、3 签发验证证书。
2.2. 项目验证小组长2.2.1. 负责验证方案的起草2.2.2. 负责验证的协调工作,以保证本验证方案的顺利实施。
2.2.3. 负责验证报告的起草。
2.2.4. 负责再验证周期的确认。
2.3. 质量部2.3.1. 负责验证方案审核2.3.2. 负责取样及对样品的检验2.3.3. 负责收集验证记录,并加以分析后,协助项目验证小组长起草验证报告。
2.3.4. 负责验证数据及结果的审核3. 参照标准:2010 版中国药典一部附录XIII 微生物限度检查法。
4. 验证项目内容:细菌、霉菌及酵母菌计数方法的验证,控制菌检查方法验证。
5. 评价合格标准:试验组的菌回收率和稀释剂对照组的菌回收率均不得低于70%。
6. 验证试验材料:6.1. 被验证产品:品名纯化水取样点:(1)4T/h 纯水系统二级反渗透装置进纯水箱口;(2) 4T/h 纯水系统液体制剂二楼洁具间用水点;(3) 4T/h 纯水系统三楼固体制剂纯水箱总回水口检验量5ml /次6.2. 仪器设备:6.2.1. YX.400A 电热蒸汽压力消毒器6.2.2 YS-840 净化工作台6.2.3. 101型电热干燥箱6.2.4. SPX-250B 型生化培养箱6.2.5. PYX-DUS-X 型隔水式电热恒温培养箱6.2.6 303A-4 型电热培养箱6.2.7 天平6.3. 稀释剂:PH7.0氯化钠- 蛋白胨缓冲液;0.9%的无菌氯化钠溶液6.4. 验证用培养基6.5.78. 菌液制备8.1.大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌菌悬液的制备①取大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜斜面培养物 1 白金耳接种至10ml 营养肉汤培养基中,35℃培养18~24 小时。
②取经35~36℃培养18~24 小时的大肠埃希菌、金黄色葡萄球菌、与枯草芽孢杆菌营养肉汤新鲜培养物1ml 加入到9ml0.9%无菌氯化钠溶液中,10倍稀释至10-6~10-7约为50~100cfu∕ml 的菌悬液备用。
8.2 白色念珠菌、黑曲霉菌悬液的制备①取白色念珠菌的新鲜斜面培养物 1 白金耳接种至10ml 改良马丁培养基中,25℃培养24~48小时。
取培养物1ml,加入9%灭菌生理盐水9ml,混匀,10倍稀释至10-5~10-6细菌数约50~100cfu∕ml 的菌悬液备用。
②接种黑曲霉的新鲜培养物于改良马丁琼脂斜面培养基上,25℃培养5~7 天至大量孢子产生。
加0.9%无菌氯化钠溶液10ml 将孢子洗脱。
然后吸出孢子悬液,加入蒙有灭菌纱布的无菌试管中。
取此孢子悬液1ml 加到9ml0.9%无菌氯化钠溶液中,逐管10 倍稀释至-510-5约为50~100cfu∕ml 的菌悬液备用。
9. 供试品制备供试品名称及取样点:纯化水取样点( 1)4T/h 纯水系统二级反渗透装置进纯水箱口;(2) 4T/h 纯水系统液体制剂二楼洁具间用水点;(3) 4T/h 纯水系统三楼固体制剂纯水箱总回水口。
方法建立:2010 版中国药典规定纯化水微生物限度试验采用薄膜过滤法检查。
但没规定取样量,由于所使用的滤膜孔径不大于0.45um ,直径为50mm, 规定每片滤膜上的菌落数应不超过100 个。
如果取样量过大,样品含菌量较多,就会造成细菌不宜分散, 点计困难; 如果取样量过少,不能有效反映样品染菌量。
为此采用每张滤膜取样品5ml。
10. 计数方法验证枯草芽孢杆菌、大肠埃希菌、白色念珠菌、黑曲霉菌菌液(50~100cfu/ml)各1ml,平行两张滤膜,过滤后,取滤膜,将其菌面朝上贴于相应培养基上培养。
10.2菌液组大肠埃希菌、金黄色葡萄球菌与枯草芽孢杆菌分别取1ml 面液分别注入平皿中,并立即倾注营养琼脂培养基,每个面液分别制备二个平皿,置35~36℃培养24小时;白色念珠菌、黑曲霉分别取1ml 面液分别注入平皿中,并立即倾注玫瑰红钠琼脂培养基,每个面液分别制备二个平皿,置24~25℃培养48小时。
菌落计数结果( 2 个平皿计数取平均值)见下表菌落计数结果(cfu∕ ml)10.3 供试品对照组取纯化水5ml,以无菌操作加入过滤器内,用0.9%无菌氯化钠溶液冲洗滤膜 3 次,每次100ml,平行两张滤膜,过滤后,取出滤膜,菌面朝上贴于琼脂培养基平板上培养。
细菌、霉菌及酵母菌各制备 2 个平皿,测定供试品本底菌数。
10.4. 稀释剂试验组取0.9%无菌氯化钠溶液300ml,以无菌操作加入过滤器内,每次100ml,在最后一次的冲洗液中分别加入上述的金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、白色念珠菌、黑曲霉菌菌液(50~100cfu/ml)各1ml,平行两张滤膜,过滤后,取滤膜,将其菌面朝上贴于相应培养基上培养。
10.5. 稀释剂对照组取0.9%无菌氯化钠溶液300ml,以无菌操作加入过滤器内,平行两张滤膜,减压抽干后,取出滤膜,菌面朝上贴于琼脂培养基平板上培养,平行制备 2 个平皿,置适宜温度培养48~72h,观察结果,测定菌数。
枯草芽孢杆菌、大肠埃希菌、白色念珠菌、黑曲霉菌菌液(50~100cfu/ml)各1ml,平行两张滤膜,过滤后,取滤膜,将其菌面朝上贴于相应培养基上培养。
10.6. 结果见附表11、控制菌检查方法验证(常规法)11.1 试验组取纯化水5ml,以无菌操作加入过滤器内,用PH7.0氯化钠- 蛋白胨缓冲液,冲洗滤膜3次,每次100ml,在最后一次的冲洗液中分别加入上述的金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、白色念珠菌、黑曲霉菌菌液(50~100cfu/ml )各1ml,平行两张滤膜,过滤后,取滤膜,接入胆盐乳糖培养基100ml 中,按相应控制菌检查法进行检查。
试验结果:上述试验组检出试验菌,按此控制菌检查法进行供试品的该控制菌检查。
故可按常规法进行控制菌检查。
12 验证结论和评价根据验证试验结果,纯化水微生物限度检查按照2010 版中国药典二部附录XIII 微生物限度检查法检验,细菌、霉菌及酵母菌计数可采用薄膜过滤法检查。
试验时间年月日完成时间年月日结论:本次试验各试验组的菌回收率和各稀释剂对照组的菌回收率均不低于70%,按标准规定, 本次试验结果符合规定。
复核人(签名):试验人(签名):试验时间年月日完成时间年月日结论:本次试验各试验组的菌回收率和各稀释剂对照组的菌回收率均不低于70%,按标准规定, 本次试验结果符合规定。
复核人(签名):试验人(签名):试验时间年月日完成时间年月日结论:通过三次独立试验,证明所采用的供试液制备方法及薄膜过滤法适合于纯化水细菌、霉菌及酵母菌数测定。
试验时间年月日完成时间年月日复核人(签名):试验人(签名):有限公司验证文件纯化水微生物限度检查法验证报告目录1、验证目的2、参照标准3、验证项目内容4、评价标准5、验证实施时间6、验证方法7、验证结论和评价、验证目的根据中国药典2010 年版的要求,纯化水微生物限度试验采用薄膜过滤法检查。
为了确认该方法适合于本公司纯化水细菌、霉菌及酵母菌数计数测定,控制菌的测定。
特对此检测方法进行验证。
二、参照标准中国药典2010 版二部附录微生物限度检查法。
三、验证项目内容细菌、霉菌及酵母菌计数方法验证,控制菌的验证。
四、评价标准试验组的菌回收率和稀释剂对照组的菌回收率均不得低于70%。
五、验证实施我们项目验证小组从(微生物限度检验室完成验证时间开始)开始,进行各种菌液、供试液的制备,开始验证工作。
1、菌液制备1.1 大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌菌悬液的制备①取大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜斜面培养物 1 白金耳接种至10ml 营养肉汤培养基中,35℃培养18~24 小时。
②取经35~36℃培养18~24 小时的大肠埃希菌、金黄色葡萄球菌、与枯草芽孢杆菌营养肉汤新鲜培养物1ml 加入到9ml0.9%无菌氯化钠溶液中,10倍稀释至10-6~10-7约为50~100cfu∕ml 的菌悬液备用。
1.2 白色念珠菌、黑曲霉菌悬液的制备①取白色念珠菌的新鲜斜面培养物 1 白金耳接种至10ml 改良马丁培养基中,25℃培养24~48小时。
取培养物1ml,加入9%灭菌生理盐水9ml,混匀,10倍稀释至10-5~10-6细菌数约50~100cfu∕ml 的菌悬液备用。
②接种黑曲霉的新鲜培养物于改良马丁琼脂斜面培养基上,25℃培养5~7 天至大量孢子产生。
加0.9%无菌氯化钠溶液10ml 将孢子洗脱。
然后吸出孢子悬液,加入蒙有灭菌纱布的无菌试管中。
取此孢子悬液1ml 加到9ml0.9%无菌氯化钠溶液中,逐管10 倍稀释至10-5约为50~100cfu∕ml 的菌悬液备用。
2.供试品制备供试品名称及取样点:纯化水。
取样点(1)4T/h 纯水系统二级反渗透装置进纯水箱口;(2) 4T/h 纯水系统液体制剂二楼洁具间用水点;(3) 4T/h 纯水系统三楼固体制剂纯水箱总回水口。
按照验证方案,采用每张滤膜取纯化水5ml。
六、验证方法(一)、细菌、霉菌及酵母菌计数方法1、试验组取纯化水5ml,以无菌操作加入过滤器内,用0.9% 无菌氯化钠溶液冲洗滤膜 3 次,每次100ml ,在最后一次的冲洗液中分别加入上述的金黄色葡萄球菌、枯草芽孢杆菌、大肠埃希菌、白色念珠菌、黑曲霉菌菌液(50~100cfu/ml)各1ml,平行两张滤膜,过滤后,取滤膜,将其菌面朝上贴于相应培养基上培养。
计数。
2、菌液组大肠埃希菌、金黄色葡萄球菌与枯草芽孢杆菌分别取1ml 面液分别注入平皿中,并立即倾注营养琼脂培养基,每个面液分别制备二个平皿,置35~36℃培养24小时;白色念珠菌、黑曲霉分别取1ml 面液分别注入平皿中,并立即倾注玫瑰红钠琼脂培养基,每个面液分别制备二个平皿,置24~25℃培养48小时。
菌落计数结果( 2 个平皿计数取平均值)见下表菌落计数结果(cfu∕ ml)3 供试品对照组取纯化水5ml ,以无菌操作加入过滤器内,用0.9%无菌氯化钠溶液冲洗滤膜 3 次,每次100ml,平行两张滤膜,过滤后,取出滤膜,菌面朝上贴于琼脂培养基平板上培养。