纯化水微生物限度检查表
- 格式:doc
- 大小:36.50 KB
- 文档页数:1


纯化水微生物限度滤膜法微生物检测:将适当孔径的滤膜放入滤器,过滤样品,由于滤膜的作用而将微生物保留在膜的表面上。
样品中微生物生长抑制剂可在过滤后用无菌水冲洗滤器而除去。
然后,将滤膜放在培养基上培养,营养物和代谢物通过滤膜的微孔进行交换,在滤膜表面上培养出的菌落可以计数,并和样品量相关。
滤膜法的优点:- 与直接法比较,可以检测大量的样品- 浓缩效应使微生物检测的准确度提高- 带有菌落的滤膜,可作为检测的永久记录存档- 可见的菌落和样品量直接对应,得出定量结果操作具体一点就是:薄膜过滤法检测,一个样过滤一份,就是200ml的纯化水通过滤膜,将该滤膜浸泡在灭菌好的l生理盐水中,再接种到平皿中,制成10级、100级、1000级稀释倍数的细菌、霉菌和酵母菌稀释培养皿,即可用平皿法检测纯化水的微生物限度摘要:目的探讨平皿法检查纯化水微生物限度的可行性。
方法采用《中华人民共和国药典》2005年版二部附录平皿法和薄膜过滤法同时时纯化水进行微生物限度检壹并作出比较。
结果平皿法操作简便,菌落清晰.准确可靠。
结论平皿法检测纯化水微生物限度是可行的,尤其适用药厂、医院开展此项检验。
关键词;纯化水;微生物限度;平皿法;薄膜过滤法纯化水为蒸馏法、离子交换法、反渗透法或其它适宜的方法制得的供药用的水,不含任何附加剂。
纯化水的优劣,直接关系到药品质量。
《中华人民共和国药典》2005年版规定其微生物限度检查采用薄膜过滤法。
并规定其细菌、霉菌和酵母菌总数每毫升不得过100个。
由于此法操作较繁,滤膜较小(直径只有50mm),菌落多时清晰度欠佳,影响计数的准确性。
笔者采用平皿法进行比较,该法操作简便,菌落清晰,计数准确,效果较为理想。
1 材料和仪器1.1 样品来源 19批纯化水系辖区内7家制药厂生产的为微生物限度检查验证用送样检品。
其中用盐水瓶盛装的12个批次,三角烧瓶盛装的7个批次。
1.2 培养基和仪器设备1.2.1 培养基:营养琼脂培养基批号050401,玫瑰红钠琼脂培养基批号050202,蛋白胨批号050523均为北京三药科技开发公司生产。

纯化水检测项目一、酸碱度1.试剂a .甲基红指示液:取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml使溶解,再加水稀释至200ml。
变色范围PH4.2-6.3(红→黄)b .0.05mol/L氢氧化钠溶液:取0.2g分析纯氢氧化钠,用水稀释至100ml。
c .溴麝香草酚蓝指示液:取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.2ml使溶解,再加水稀释至200ml。
变色范围pH6.0—7.6(黄→蓝)。
2、操作取纯化水10ml,加甲基红指示液2滴,不得显红色;另取纯化水10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
二、硝酸盐1.试剂a. 10%氯化钾溶液:取氯化钾10g,加水使溶解成100ml,即得。
b. 0.1%二苯胺硫酸溶液:取二苯胺0.1g,加硫酸100ml使溶解,即得。
c. 标准硝酸盐溶液:取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1µg NO3)。
2、操作取本品5ml置试管中,于冰浴(0℃)中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
三、亚硝酸盐1、试剂a. 稀盐酸溶液:取盐酸234ml,加水使稀释至1000ml,即得。
本液含HCl应为9.5%-10.5%。
b. 对氨基苯磺酰胺的稀盐酸溶液(1→100):取氨基苯磺酰胺1g,加稀盐酸溶液使溶解成100ml。
c. 盐酸萘乙二胺溶液(0.1→100):取盐酸萘乙二胺0.1g,加水使溶解成100ml。
d. 标准亚硝酸盐溶液:取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50 ml,摇匀即得(每1ml相当于1µgNO2) 。
云南永安制药有限公司原始记录第1 页共 1 页
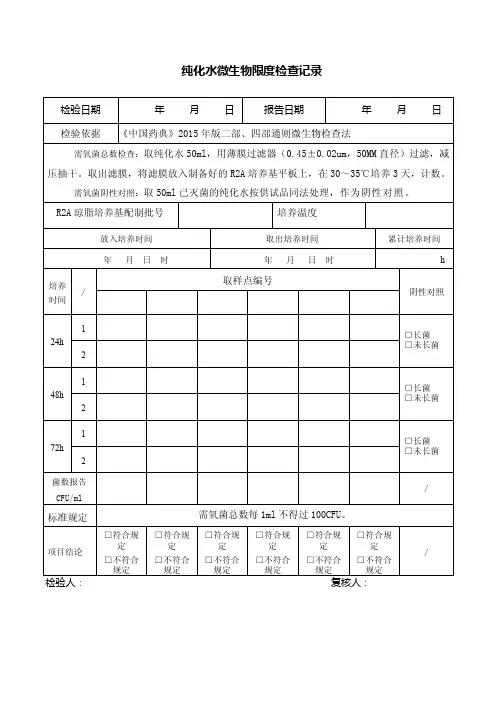
纯化水微生物限度检验原始记录REC-ZL-17002-02
品名纯化水批号检验日期报告日期温度℃湿度% R 2 A琼脂培养基批号配制批号培养温度:30-35℃仪器型号:SPX--250 型生化培养箱;编号:04030206
操作过程取本品ml(不少于1ml),经薄膜过滤法(0.45μm孔径)处理后,在无菌条件下,用经高温灭菌的镊子取出滤膜,菌面朝上贴于R 2 A 琼脂培养基平板上,滤膜贴于平板上时,不得有空隙或气泡,30〜3 5℃培养不少于5天,逐日记录检测结果。
标准规定lml供试品中需氧菌总数不得过100cfu。
超净台菌落数取水点1天2天3天4天5天6天cfu/2ml 报告数cfu/ml 培养1天2天3天4天5天6天
平皿1菌落数
平皿2菌落数
平皿3菌落数
手检操作前操作后
接触碟1
接触碟2
接触碟3
结果判断:
取水点
符合规定,
结果取水点不符合规定。
检验人/日期复核人/日期。

微生物限度检查方法验证——纯化水的微生物限度检查方法验证验证方案制定人:部门:日期:验证方案审核人:部门:日期:验证方案批准人:部门:日期:1验证目的:当建立纯化水的微生物限度检查法时,应进行细菌、霉菌和酵母菌检查方法的验证,以确认所采用的方法适合于纯化水的细菌、霉菌和酵母菌检查。
2验证方案:照《中国药典》2005版二部附录Ⅺ J 方法。
2.1仪器与试药2.1.2仪器:STV3无菌检查薄膜过滤器(浙江宁海白石药检仪器厂),微孔滤膜(孔径0.45um,直径50mm)。
2.1.3试药:2.1.4培养基:营养琼脂培养基,玫瑰红钠琼脂培养基,营养肉汤培养基。
来源:北京三药科技开发公司生产中国药品生物制品检定所监制2.1.5试液:生理盐水,pH7.0氯化钠-蛋白胨缓冲液。
(均按照《中国药典》2005版二部附录Ⅺ H、J要求配制)2.1.6对照菌株:大肠埃希菌[CMCC(B) 44 102]、金黄色葡萄球菌[CMCC(B) 26 003]、枯草芽孢杆菌[CMCC(B) 63 501]、白色念珠菌[CMCC(F) 98 001]、黑曲霉 [CMCC(F) 98 003]。
来源:广州药物研究中心2.2对照菌液的制备:取大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的营养琼脂斜面新鲜培养物各1环分别接种于15ml 营养肉汤培养基内,于30~35℃培养18~24小时后,稀释至1:105~1:107,,取1ml注入平皿中,注入约45℃的营养琼脂培养基约15ml,混匀,凝固后置30~35℃培养48h,进行活菌计数。
取白色念珠菌的玫瑰红钠琼脂斜面新鲜培养物1环接种于改良的马丁琼脂培养基内,于25~28℃培养24~48小时后稀释至1:105~1:106,取1ml注入平皿中,注入约45℃的玫瑰红钠琼脂培养基约15ml,混匀,凝固后置25~28℃培养72h,进行活菌计数。
取黑曲霉的玫瑰红钠琼脂新鲜培养物1环接种于改良的马丁琼脂培养基内斜面中,于25~28℃培养5~7天后,用3~5ml0.9%的无菌氯化钠溶液洗脱。
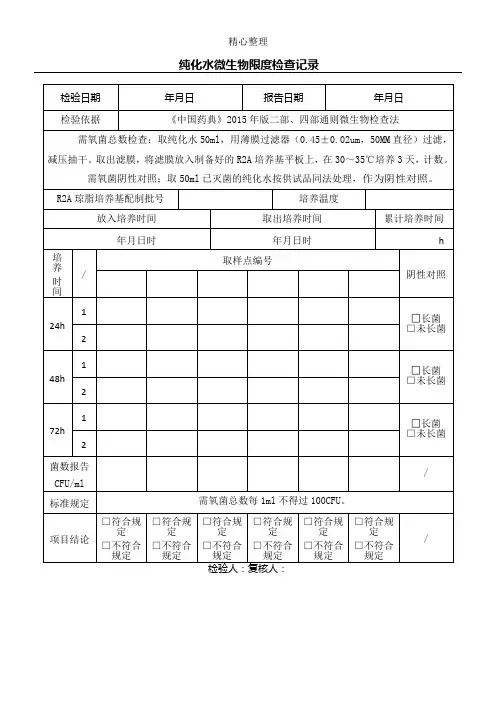

纯化水检测项目一、酸碱度1、试剂a. 甲基红指示液:取甲基红0.1g,加0.05mol/L氢氧化钠溶液7.4ml 使溶解,再加水稀释至200ml。
变色范围pH4.2—6.3(红→黄)。
b. 0.05 mol/L氢氧化钠溶液:取0.2g分析纯氢氧化钠,用水稀释至100ml。
c. 溴麝香草酚蓝指示液:取溴麝香草酚蓝0.1g,加0.05mol/L氢氧化钠溶液 3.2ml使溶解,再加水稀释至200ml。
变色范围pH6.0—7.6(黄→蓝)。
2、操作取纯化水10ml,加甲基红指示液2滴,不得显红色;另取纯化水10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
二、硝酸盐1、试剂a. 10%氯化钾溶液:取氯化钾10g,加水使溶解成100ml,即得。
b. 0.1%二苯胺硫酸溶液:取二苯胺0.1g,加硫酸100ml使溶解,即得。
c. 标准硝酸盐溶液:取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μg NO3)。
2、操作取本品5ml置试管中,于冰浴(0℃)中冷却,加10%氯化钾溶液0.4ml 与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液0.3ml,加无硝酸盐的水 4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
三、亚硝酸盐1、试剂a. 稀盐酸溶液:取盐酸234ml,加水使稀释至1000ml,即得。
本液含HCl应为9.5%-10.5%。
b. 对氨基苯磺酰胺的稀盐酸溶液(1→100):取氨基苯磺酰胺1g,加稀盐酸溶液使溶解成100ml。
c. 盐酸萘乙二胺溶液(0.1→100):取盐酸萘乙二胺0.1g,加水使溶解成100ml。
d. 标准亚硝酸盐溶液:取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50 ml,摇匀即得(每1ml相当于1μgNO2) 。

中国药典2015年版溶液的澄清度与颜色取本品,加水制成每lml中约含阿魏酸钠20m g的溶液,溶液应澄清无色;如显浑浊,与1号池度标准液(通则0902第一法)比较,不得更浓;如显色,与黄色或黄绿色3号标准比色液(通则0901第一法)比较,不得更深。
有关物质避光操作。
取本品,加流动相溶解并稀释制成每l m l中约含0. 7m g的溶液,作为供试品溶液;精密量取lm l,置200m l量瓶中,用流动相稀释至刻度,摇勻,作为对照溶液。
照阿魏酸钠有关物质项下的方法测定。
供试品溶液的色谱图中如有杂质峰,各杂质峰面积的和不得大于对照溶液的主峰面积(0.5%)。
水分取本品,照水分测定法(通则0832第一法1)测定,含水分应为13.0%〜16.0%(供无菌粉末用)或应不超过3.0%(供无菌冻干品用)。
热原取本品,加灭菌注射用水制成每l m l中含阿魏酸钠5m g的溶液,依法检查(通则1142),剂量按家兔体重每l k g 缓慢注射3m l,应符合规定。
无菌照阿魏酸钠项下的方法检査,应符合规定。
其他应符合注射剂项下有关的各项规定(通则0102)。
【含置测定】避光操作。
取装量差异项下的内容物约0.15g,精密称定,加冰醋酸20m l使阿魏酸钠溶解,照阿魏酸钠项下的方法,自“加醋酐3m l”起,依法测定。
每l m l高氣酸滴定液(0.lm o l/L)相当于25.22mg的C10H9N a04•2H20。
【类别】同阿魏酸钠。
【规格】(1)0. lg(2)0. 3g【贮藏】遮光,密封保存。
纯化水ChunhuashuiPurified WaterH2018.02本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【性状】本品为无色的澄清液体;无臭。
【检査】酸碱度取本品10m l,加甲基红指示液2滴,不得显红色;另取10m l,加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐取本品5m l置试管中,于冰浴中冷却,加10%氣化钾溶液0.4m l与0.1%二苯胺硫酸溶液0.1m l,摇匀,缓缓滴加硫酸5m l,摇勻,将试管于50T:水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100m l,摇匀,精密量取l m l,加水稀释成100m l,再精密量取10m l,加水稀释成100m l,摇匀,即得(每l m l相当于1吨N03)]0.3m l,加无硝酸盐的水4.7m l,用同一方法处理后纯化水的颜色比较,不得更深(0.000006%)。

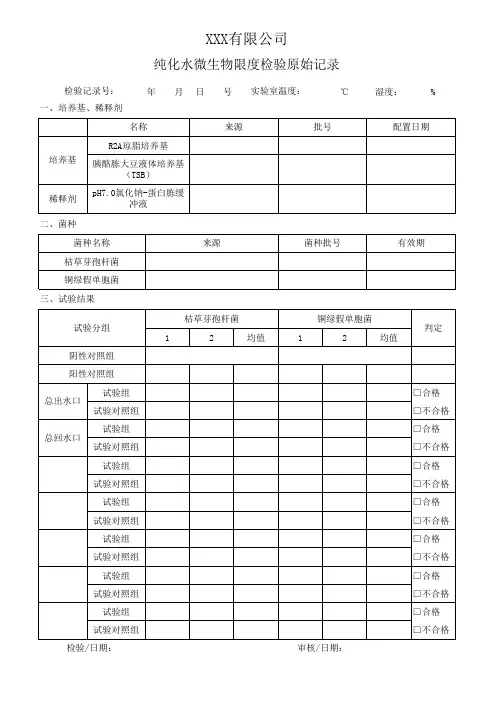
目录A、验证方案1.概述2.适用范围3.验证目的4.验证小组及职责分工4.1 验证小组4.2 职责分工5.验证内容6.漏项与偏差及采取的纠偏措施.7.验证结论8.验证方案批准B、验证报告1.概述2.适用范围3.验证目的4.验证小组及职责分工4.1 验证小组4.2 职责分工5.确证内容6.漏项与偏差及采取的纠偏措施.7.验证结论8.最终批准9. 再验证周期与年度回顾性验证1 概述由于某些供试品抗菌活性,在建立测定方法或原测定法的检验条件发生改变时,可能影响检验结果的准确性,必须对供试品的抑菌活性及测定方法的可靠性、重现性进行验证。
验证时,按供试液的制备和细菌、霉菌及酵母菌计数所规定的方法进行。
对各试验菌的回收率应逐一进行验证。
2 适用范围纯化水微生物限度检查——薄膜过滤法的验证。
3 验证目的验证纯化水微生物限度检查——薄膜过滤法符合《中国药典》2005年版二部的规定要求。
4 验证小组及职责分工5 验证内容5.1 品种:纯化水5.2 验证方法:《中国药典》2005年版二部微生物限度检查——薄膜过滤法5.3 计数方法的验证5.3.1 验证试验用菌种验证试验用的菌株传代次数不得超过5代(从菌种保存中心获得的冷冻干燥菌种为第0代),并采用适宜的菌种保藏技术,以保证试验菌株的生物学特性。
大肠埃希菌(Escherichia coli)〔CMCC(B) 44 102〕金黄色葡萄球菌(Staphylococcus aureus) CMCC(B) 26 003〕枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B) 63 501〕白色念珠菌(Candida albicans)〔CMCC(F) 98 001〕黑曲霉(Aspergillus niger)〔CMCC(F)98 003〕5.3.2 菌液制备取经32.5℃培养18~24小时的大肠埃希菌、金黄色葡萄球菌与枯草芽孢杆菌营养肉汤液体培养物,用0.9%无菌氯化钠溶液制成每1ml含菌数为50~100cfu的菌悬液。
1.饮用水⑴取样于500ml玻璃瓶中加入2毫升1.5%硫代硫酸钠溶液,加盖后高压蒸汽灭菌。
(121℃,30分钟)。
取样前,先用酒精灯将水龙头烧灼消毒,然后把水龙头完全打开,放水1~3分钟后取样。
⑵细菌数检查(不得过100个/ml)①以无菌操作方法用灭菌吸管吸取1ml充分混匀的水样,注入灭菌平皿中,倾注约15ml 已融化并冷却至45℃左右的营养琼脂培养基,每个水样应倾注二个平皿,待培养基冷却后将平皿置于37℃恒温箱内培养24小时。
②菌落计数按微生物限度检查法菌落计数项进行计数。
③菌落计数的报告:菌落数在100以内时按实有数报告,大于100时,采用二位有效数字,在二位有效数字后面的数值,以四舍五入方法计算。
⑶大肠菌群(不得检出)①取10ml水样接种到10ml双料乳糖蛋白胨培养液中,取1ml水样接种到10ml单料乳糖蛋白胨培养液中,另取1ml水样注入到9ml灭菌生理盐水中,混匀后吸取1ml(即0.1ml 水样)注入到10ml单料乳糖蛋白胨培养液,每一稀释度接种5管。
对已处理过的出厂自来水,可直接种5份10ml水样双料培养基,每份接种10ml水样。
②分离培养将产酸产气的发酵管分别转种在伊红美蓝琼脂平板上,于36℃±1℃培养箱内培养18h~24h,观察菌落形态,挑取符合下列特征的菌落作革兰氏染色,镜检和证实实验。
深紫黑色,具有金属光泽的菌落;紫黑色,不带或略带金属光泽的菌落;淡紫红色,中心较深的菌落。
③证实实验经上述染色镜检为革兰氏阴性无芽孢杆菌,同时接种乳糖蛋白胨培养液,置36℃±1℃培养箱中培养18h~24h,有产酸产气者,即证实有总大肠菌群存在。
④结果报告根据证实为总大肠菌群阳性的管数,查MPN检索表,报告每100ml水样中的总大肠菌群最可能数(MPN)值。
5管法结果见表表2 用5份10ml水样时各种阳性和阴性结果组合时的最可能数(MPN)2.纯化水⑴测定:取供试品10ml,加pH7.0无菌氯化钠-蛋白胨缓冲液至100ml,取10ml,照薄膜过滤法,过滤,取出滤膜,菌面朝上,分别贴于营养琼脂培养基、玫瑰红钠琼脂培养基平板上培养,每种培养基至少制备一张滤膜。
中国药典2020版二部纯化水微生物检查【原创实用版】目录1.概述2.中国药典 2020 版二部纯化水微生物检查的标准3.微生物检查的方法4.微生物检查的注意事项5.结论正文1.概述纯化水是制药工业中常用的一种水质,其微生物质量对于药品的质量和安全性至关重要。
为了保证纯化水的微生物质量,我国制定了一系列的标准和方法。
本文将介绍中国药典 2020 版二部纯化水微生物检查的相关内容。
2.中国药典 2020 版二部纯化水微生物检查的标准中国药典 2020 版二部对于纯化水的微生物检查有严格的标准。
其中,纯化水的微生物限度要求如下:- 细菌总数:≤10cfu/ml- 霉菌和酵母菌:≤1cfu/ml- 细菌内毒素:≤0.25EU/ml3.微生物检查的方法微生物检查通常包括以下几个步骤:- 采样:在纯化水的生产过程中随机采样,保证样品具有代表性。
- 培养:将样品在适当的培养基中进行培养,以便微生物生长和繁殖。
- 计数:在适当的时间点对培养基中的微生物进行计数,以了解样品中微生物的数量。
- 鉴定:通过显微镜观察和生化试验等方法,对微生物进行鉴定,以确定其种类。
4.微生物检查的注意事项在进行纯化水微生物检查时,应注意以下几点:- 采样时应保证样品的无菌性,避免样品被污染。
- 选择适当的培养基和培养条件,以保证微生物的生长和繁殖。
- 在进行微生物计数时,要保证计数方法的准确性和精度。
- 定期对纯化水微生物检查的设备和方法进行验证,以确保检查结果的可靠性。
5.结论通过对中国药典 2020 版二部纯化水微生物检查的研究,我们可以了解到,我国对于纯化水的微生物质量有着严格的要求。
微生物检查的方法和注意事项也需要我们在实际操作中严格遵守,以保证药品的质量和安全性。
本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
纯化水为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
酸碱度:取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色;硝酸盐取本品5ml置试管中,于水浴中冷却,加10%氯化钾溶液0.4ml 与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1ugNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000006%);亚硝酸盐取本品10ml,置纳氏管中,对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(0.1→100)1ml,产生粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.75g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1ugNO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000002%);氨取本品50ml,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氨化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.00003%);总有机碳不得过0.50mg/L(0.5ppm 、500ppb)(通则0682 2015版药典第四部 P85)易氧化物取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失;以上总有机碳和易氧化物两项可选做一项不挥发物取本品100ml,置105℃恒重的蒸发皿中,在水浴上蒸干,并在105℃干燥至恒重,遗留残渣不得过1mg;重金属取本品100ml,加水19ml,蒸发至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,加硫代乙酰胺试液2ml,摇匀,放置2分钟,与标准铅溶液1.0ml加水19ml用同一方法处理后的颜色比较,不得更深(0.000 01%);电导率(10℃,≦3.6µs/cm),(20℃,≦4.3µs/cm),(25℃,≤5.1µs/cm)(通则0681 2015版药典第四部P84);微生物限度取本品,采用薄膜过滤法处理后,依法检查(附录ⅪJ),细菌、霉菌和酵母菌总数每1ml不得过100个(通则1105 2015版药典第四部P140)。